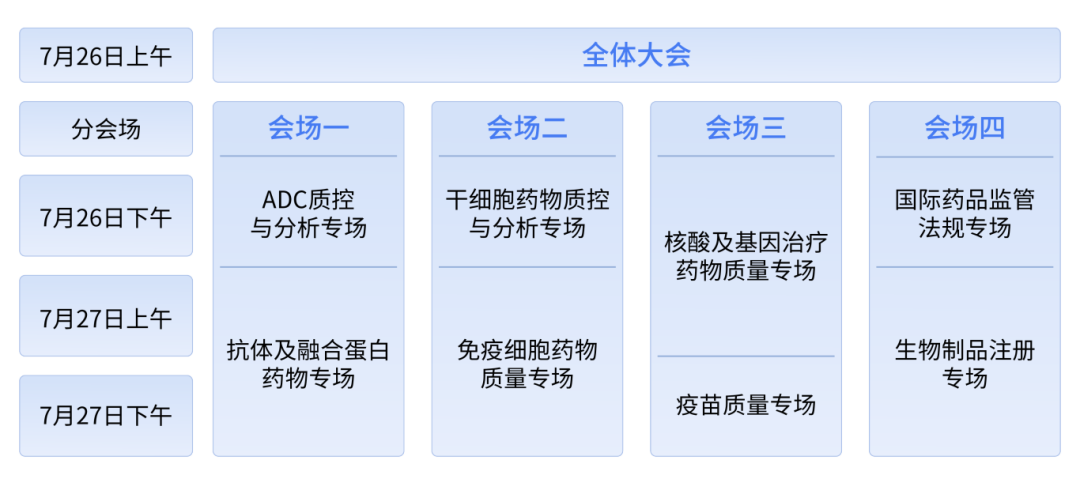
大会时间 | 2024年7月26-27日(周五、周六)
QbD是国内第一个聚焦生物药质量和政策法规领域的千人大会。大会历经四载,吸引了众多行业同仁的持续关注,2024第五届生物药质量科学大会围绕“创新破局,“质”在必行”的主题,将重点讨论创新生物药的质控、分析、法规等内容。截止目前,28位质量大咖已确认加盟,从案例、实践出发,深度解读创新药质量研究管理的进程,深化QbD理念。
刘铭松
华润医药 研发执行总监
Topic:CMC开发过程中分析方法变更,替换带来的挑战及应对策略浅谈
在华润医药主要负责分析开发及质量控制工作。曾在百特 (Baxter),武田(Takeda)/夏尔(Shire),龙沙(Lonza)等多家国际知名的生物制药公司任职。具有二十多年的生物大分子研发及生物制药经验,曾参与过多个生物大分子药物(抗体类及重组蛋白药物等)从临床一期直至BLA申报注册的相关研发工作并做出相应的显著贡献。
金秀梅
明济生物 质量管理部&分析部高级总监
Topic:抗体药物杂质研究的思考
毕业于沈阳药科大学-药物化学专业,2018年加入明济生物,现任质量管理及分析科学部高级总监,主要负责质量控制,质量保证,分子评价分析及制剂工艺等工作。擅长突破项目技术难点,尤其在大分子表征方面拥有丰富的经验。
顾明洋
昂科免疫 质量保证部负责人(总监)
Topic:新一代靶向CTLA4抗体药物开发及进展
17年外资药企和药明系工作经验,擅长无菌制剂的厂房设施、项目调试确认与验证管理,熟悉研发质量体系和商业化质量体系搭建、体系优化、技术转移以及GMP审计,多次参与并主导研发项目中美IND申报、国内外注册现场核查和研制现场核查、符合性检查(中国、日本PMDA、欧盟QP、津巴布韦GMP审计等)等,具有药品完整的全生命周期工作经验。
李树德
华润医药 首席制造官
Topic:生物制药企业,对质量合规数据管理的智能化,案例、现况与发展
曾在天境生物、百济神州、喜康生物等公司任职。也曾在BI勃林格、Roche罗氏、GSK葛兰素等跨国药企担任高管。多次负责生物制药新工厂建设项目的筹建以及新厂的运营,工作内容涉及产品技术转移、工艺设备与系统的安装、GEP优良工程实践的执行、设施的调试、验证体系全生命周期的管理,以及cGMP合规体系的建立、智能化/数字化运行与合规体系的建立等。
陆军波
多禧生物 质量中心总监
20多年的生物医药工作管理经验,担任各类高管工作10多年;熟悉化药、生物药的质量管理工作,丰富的各类审计认证经验;四次带领团队零缺陷通过美国FDA的现场检测;带领团队多次通过NMPA、欧盟EU、韩国MFDS认证、日本PMDA认证;带领团队通过各大MNC医药公司的检查认证;带领团队完成各类法规国家注册文件,完成CMC文件超过100份;良好的药监系统关系。
王林林
安腾瑞霖 分析科学部副总监
拥有近9年生物医药研发,表征分析和申报经验,2014年加入Henlius,共参与了20多个IND项目和5个现已上市产品的研制、表征、申报和现场核查工作。其中主导负责了贝伐珠单抗生物类似药的NDA上市研究表征工作,具有丰富的产品结构表征,可比性和相似性研究的经验。
单晓鹏
泽辉辰星 质量总监/质量负责人
Topic:细胞治疗产品控制策略
从事制药行业近二十多年,职业经历涵盖药品和保健食品的生产、研发质量管理、及质量管理等各大职能区块。十年外资企业质量工作经验,国内大型质量保证负责人、以及国内知名制药公司的质量负责人和质量受权人;有注射剂(大容量注射剂)、化药固体制剂、中药制剂,原料药、细胞药物等剂型领域的质量管理经验。先后从事药品检验、注册和生产和研发质量管理工作。
邹沛华
茵冠生物 质量总监
Topic:间充质干细胞质量控制与质量体系的搭建
具有多年细胞治疗产品生产质量管理工作经验与丰富的ISO质量管理体系认证经验,参与多个干细胞以及免疫细胞产品IND申报工作并获受理和审批,参与多个细胞治疗产品药物临床研究试验工作。
陶铜静
原启生物 质量副总裁
Topic:CGT药物CMC质量控制策略
曾任生物药无菌制剂商业化生产质量负责人和放行人,曾任中国首个CAR-T细胞治疗产品的质量负责人和质量受权人。参与上海医药行业协会组织起草的团体标准《细胞和基因治疗产品快速无菌检查法的验证技术要求》,参与新版《GMP实施指南 无菌分册》中相关细胞治疗产品的质量管理章节的编写。在原启生物负责公司细胞治疗产品从研发至上市的全生命周期的质量风险控制体系的搭建,负责品IND及NDA阶段的质量风险策略制订及控制。
杨月峰
景达生物 CEO/首席科学官
Topic:通用现货型NK细胞的工艺开发及质量控制
先后承担了国家“863”青年科学家课题、国家自然科学基金、北京市科技新星、浙江省自然基金等8项省部级以上课题;第一作者或通讯作者发表SCI论文17篇;申请国家发明专利20项,其中授权12项;作为主要完成他人,参与3项基因治疗药物临床前及临床研究,均已获药物临床试验批文;作为主要完成人,获得牙髓间充质干细胞的新药IND批件,并获准4项临床研究备案许可。
贾文文
国家干细胞转化资源库 副主任
发表SCI论文40余篇;授权实用新型专利9项,发明专利7项;主持国家自然科学基金3项,国家重点研发计划课题组长项目1项,国家973项目子课题1项,上海市自然科学基金1项。作为主要起草人制定并发布《干细胞制剂制备与质检行业标准(试行)》、《干细胞制剂放行检验规范(试行)》、《人组织来源神经干细胞资源库建设技术规范(试行)》、《人干细胞来源细胞外囊泡制备通用要求》等干细胞相关行业标准、团体标准、规范。
张秀军
北京循生转化医学研究院 研究院院长兼理事长
北京大学医学部免疫药理学硕士, 师从免疫药理学泰斗, “国际灵芝之父”林志彬教授。10年新药研究背景如不同多糖类毒理学和免疫抗肿瘤活性研究及开发等。25年国际Top10跨国企业新药研发中心工作,曾在在德国拜耳公司、美国强生等公司担任15年高级管理职务, 参与多个国际创新药研究和临床开发并获得产品上市批件。
高 博
宇玫博生物 CEO&创始人
Topic:外泌体药物载体开发的技术挑战
曾在上海吉凯基因化学技术有限公司任职近10年,负责重组病毒载体的开发和生产管理,参与多项生物技术项目的管理及产品的开发工作。2016至今担任上海宇玫博生物技术有限公司首席运营官,负责外泌体的产品的开发和工艺研发,包括分离纯化、检测鉴定、载体标记、药物装载等工艺开发。参与多项国家、省市课题项目,拥有17项已授权发明专利,参与发表了多篇SCI论文。
赵忠亮
中吉智药 质量总监
Topic:慢病毒载体造血干细胞基因治疗质量控制
北京协和医学院博士,德国国家癌症中心博士后;中国科学院副研究员。十余年病毒生产工艺的开发经验和质检方法开发经验。现为中吉智药质量总监,负责质量体系和分析方法开发。领导团队完成慢病毒载体造血干基因治疗全套检测方法。
罗光佐
贝思奥生物 创始人、CSO
Topic:AAV药物关键质量属性及其分析质控难点
具有多年国际大药企及初创公司的研发和管理经验。曾作为主要负责人之一参与FDA批准的第一个体内基因药物LUXTURNA (2017)、第一个CAR-T药物CTL019 (2017)和体内基因治疗药物BEQVEZ (2024)的CMC工作。曾作为两个主要负责人之一组建了Spark Therapeutics的CMC质控平台,并全程参与了Luxturna的成功上市。
徐程飞
药明海德 中国质量负责人&高级主任
在生物制药和CDMO行业工作十余年,拥有丰富的疫苗和单抗研发、厂房新建、设施设备验证、质量体系搭建、产品质量控制、GMP申报及审计经验。参与过十多个中试、临床和GMP厂房的设计、施工和验收,负责C&Q管理及质量体系搭建,其中涉及的9个产品系列已注册上市。领导过疫苗WHO预认证的准备和申报,以及相关生产工艺和质量体系的提升。对接过国内外各类客户并实现项目交付,通过FDA、EMA或NMPA的审计。
伊 静
中因科技 QC总监
Topic:rAAV基因治疗产品的质量研究和质量控制
毕业于中国协和医科大学病原生物学专业。有十余年生物制药公司质量管理经验,曾负责多个生物大分子药物IND项目质量分析和中美申报资料撰写工作;并拥多年商业化生产质量控制经验,经历多次GMP认证。现任北京中因科技有限公司QC总监,负责公司多个基因治疗项目的质量分析管理工作。
李志红
斯丹姆医药 总经理助理兼质量总监
Topic:生物样本分析实验室质量管理探讨
20多年GMP工作经历,大型药企担任10余年质量负责人和质量受权人,近5年的生物医药质量管理经验,具有丰富的质量搭建和应用、质量审计及迎检整改的实战经验。
王海盛
思合基因 创始人/CEO
北京大学药化博士,美国UMSL和Auburn大学博士后,中欧国际工商学院EMBA。曾在保诺科技、百济神州、扬子江药业、哈药集团担任研发高管,曾创立专注研发咨询的药酚享智库;20余年新药研发经验,熟悉新药研发法规及企业管理工作。
吴 克
博沃生物 CEO
湖北省政府特聘产业教授,免疫学博士,中国疫苗行业协会糖疫苗专委会副主委、中国食药促进会疫苗专委会副主委、中国疫苗国际合作促进会委员。从事生物医药研发及产业化工作,主持过国家重点研发计划、上海市重大科技攻关等,带领团队当选首届和第二届“湖北省自主创业战略团队”、获评德勤”中国明日之星”和“中国最具成长性疫苗企业十强”。
杜 新
埃格林医药 CEO
对生物制药和小分子产品有着丰富的经验。曾在FDA担任CMC审评专家,后就职于安万特、惠氏、诺华、BMS, NPS等制药公司,多次经历并购和被并购,具有独特的FDA和工业界相结合的药品注册监管经验,深知FDA及全球对药品开发、生产、 质量管理、临床设计和试验的相关法规, 有“FDA与工业界的跨界法规专家”之称。曾在一年内帮助企业获得两个生物药许可证的批准,占当年FDA CBER批准的生物药许可证数量的一半;还获得了关键的生产许可批准。
陈兆荣
祐和医药 首席执行官&首席医学官
Topic:遵循监管政策,加速新药研发
曾任琅铧医药、喜康生物医药、菲吉乐科生物医药、和英创远达生物医药的首席医学官。也曾在Sanofi、Bayer Schering Pharma、GSK中国/香港区任职。从事医药研发30余年,做过医学研究,各期药物研发,药物审评,药物注册,和药物安全等工作,具有丰富得经验。他曾获 Florey研究基金在阿德雷得皇家医院工作。曾在澳大利亚药品管理局从事药物审评与审批工作。
蒋燕敏
和铂医药 副总裁,质量部负责人
拥有近30年的医疗和制药行业经验,包括5年临床医疗,10年临床试验项目监查和运营管理,10余年药企GxP质量管理系统建设和运营管理。之前曾服务于赛诺菲中国研发中心,全面负责中国研发中心的日常运营及全球项目执行;曾负责中国研发中心GxP质量管理系统和运营,协助运营部门确保临床和非临床的数据质量;曾从事药物临床研究和运营十年,成功领导肿瘤、心血管等不同治疗领域的数个大型临床试验。现任中国质量保证论坛(CQAF)的顾问团成员,并任国家药品监督管理局高级研修学院和亦弘商学院的课程教授。
文继川
复宏汉霖 药政事务高级总监
他拥有16年生物制药行业相关经验,包括生产、研发和注册。目前任职于复宏汉霖,担任药政注册高级总监,负责制定符合整体研发战略的国内外申报策略并顺利推进项目执行。曾领导和参与了多个IND、NDA/BLA、重大变更、再注册申请的策略制定、实施、申报和获批,负责多次与监管机构的沟通交流、注册核查检验和上市后产品维护相关工作。
徐 娜
思路迪医药 企业战略发展部和药政事务部总监
Topic:生物制品全生命周期注册管理流程及重点关注
曾就职于国内外大型药企,拥有十几年法规事务和医药研发相关经验。主要负责中国、美国和欧盟的IND/BLA药品注册申报。根据现行法规指导药品开发策略,关注法规动向,为决策者提供前瞻性建议。基于风险评估现有的申报策略,为快速审批提供法规建议。制作高质量,符合药监当局的申报文件;申报过程中支持来自中国、美国和欧洲等药监当局的问题及其沟通。已获得20多个药品批件,包括生物制品和化药。
张长风
上海医药 生物治疗注册总监
Topic:细胞治疗产品BLA审评要点及主要挑战
师从“CAR-T之父”Carl June院士,深度参与Kymriah(全球首款CAR-T)等十余个产品在FDA的申报工作,回国后作为总负责人斩获国内首个基因敲除CART、首个多靶点联合抗体分泌CART等7个IND批件,并数次与CDE、中检院等药政监管部门联合举办细胞治疗中美政策研讨会。迄今已在Nature Medicine, Blood, JCI-insight等国际权威期刊发表多篇论文,并组织开展多项临床研究,治疗白血病、骨髓瘤等各类癌症患者1000余人。
赵 婷
中国工业微生物菌种保藏管理中心(CICC) 质量负责人/正高级工程师
更多确认嘉宾持续公布中...
7月北京,即将启幕!
创新破局,“质”在必行~
HER2的优势及差异化开发时质量管理策略分析
B7-H3的布局与研发质控的关注点
适应症拓展及临床质量研究主要考量要点
联合用药的安全性和有效性考量
ADC在非肿瘤适应症方面的开发与展望
干细胞制剂成瘤性的质控与CMC难点
通用型干细胞产品的质量标准开发与实践
干细胞制品规模化生产后的质量检定与分析方法开发
间充质干细胞外泌体质量控制标准
iPSC细胞产品批量制备和质量控制策略
干细胞临床研究质量控制的策略探讨和案例分析
《细胞治疗产品生产质量管理指南》解读及实施案例
细胞治疗产品全过程质控体系建立与实施
细胞治疗药物质量表征方法的开发与优化
γδ-t细胞质量控制及安全性评价
细胞治疗产品生产关键物料的无菌保障策略
CAR-T生产中慢病毒载体的质量检验方法和标准
UCAR-T细胞产品质量控制与稳定性研究
如何优化TCR-T细胞治疗产品活性测定方法
标准化TIL细胞制备工艺与质控体系
工程化NK细胞的质量控制和放行要点
DC细胞制备过程中的检测与质控
基因疗法裸质粒DNA的药学关键质控要素
病毒载体类基因制品的生产质控与检测
AAV药物关键质量属性及其分析质控难点
基因治疗产品的质控分析方法及研究
基因制品分析方法的开发、验证与稳定性研究
基因治疗制品中HCD的风险评估和放行检测研究
核酸药物质量研究中基因毒性杂质的质控策略
小核酸药物的关键质量属性分析及表征
mRNA放大生产与质量控制方法探索
寡核苷酸的固相合成技术及质量标准
mRNA疫苗质量分析方法开发
基于大肠杆菌表达的HPV疫苗质量研究进展
从HPV疫苗案例中借鉴疫苗的质量研究
基于VLP的治疗性疫苗质量分析方法与表征策略
疫苗规模化生产的质控挑战及案例解析
疫苗工艺相关杂质控制及评价标准
生物药质量监管的挑战及应对策略
委托生产现场检查指南解读和实践
GMP生产工艺和质量标准的生命周期
FDA关于生物药审计现场准备和缺陷解析
生物制品现场核查问题分析及案例解读
中美欧关于GMP监管的差异考量
生物药无菌生产的GMP要求
生物制品分段生产法规及实践研究
中国创新药注册分类的研究和思考
国产PD-1出海的法规依据解读
生产工艺、开发流程的描述及注意事项
CP/DCP递交流程简介和关键节点
生物制品eCTD资料各国提交要求
生物药品BLA所需材料解读
FDA生物制品BLA的审批过程概述及主要步骤
CAR-T药物的BLA审评复盘和技术解析
ADC药物BLA审评要点解析
生物制品全生命周期注册管理流程及重点关注
药企人员/科研院所/监管机构人员免费参会(人数有限,先到先得,需要审核);本次报名为预登记报名,组委会审核通过后,您将收到邮件通知!
药企人员免费参会(需审核)
▼
2024第五届QbD生物药质量科学大会招商火热进行中,明星展位火热抢购中....
媒体合作/学术报告/参会报名请联系 Abby Jiang 18217659261(微信同号)
定制参展/商务合作请联系 Stephen Sun 15966587556(微信同号)
【备注:QbD2024,进入大会群聊】