
2021-11-02 14:38:59来源:药智网浏览量:754
导读:捧起来难,摔下去疼~
Best还是Worst,一款新药的真正成功取决于其商业潜力。
药监机构的批准仅仅只是开始,批准过后充分发挥商业潜力可确保其制造商能够收回研发成本,为未来的药物发现提供资金,并以丰厚的利润满足投资者的需求,是药物生命周期存续关键性的一步。
据此前LEK咨询公司报告显示,2004 年至 2016 年间获得FDA批准的450种新分子实体中,约有 40%的产品上市后销售额低于预期20% 以上。
近日,Fierce Pharma整理出过去5年上市后10大最显失败的药物。包括销售不及预期,或销售额稳定,但仍遭遇重大挫折,引发长期商业价值质疑的药品。
TOP10药品覆盖肿瘤、免疫学、传染病、眼科、血液疾病、脑部疾病以及心血管和代谢疾病等多个领域。涉及辉瑞、诺华、礼来等这种制药巨头,也有Amarin、蓝鸟生物等这样的生物技术初创型公司。
值得提及的是除了 Amarin 的 Vascepa 之外,其余药品均为企业初创型药物。
上市“最失败”新药TOP 10
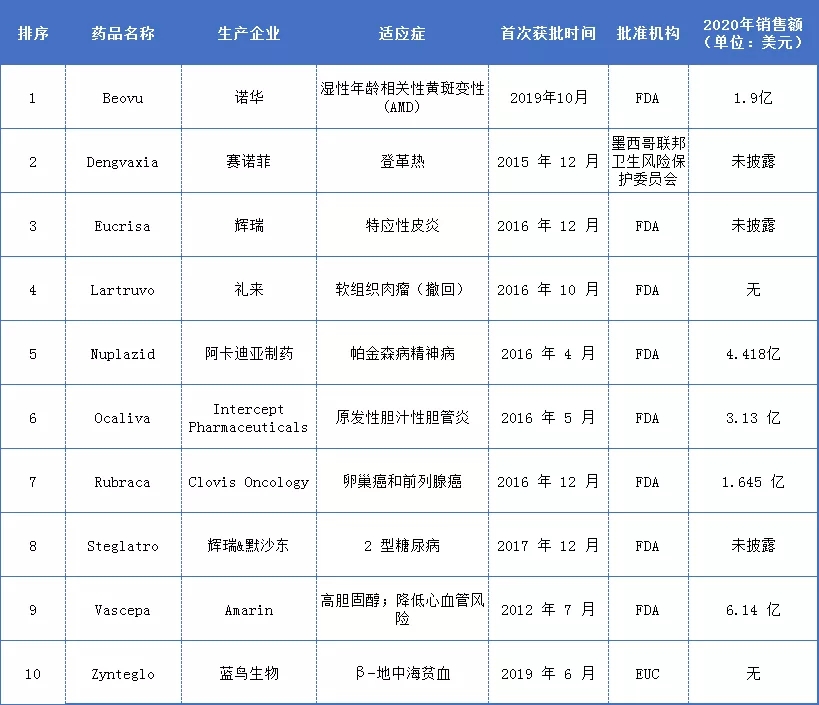
严重安全问题
“重磅炸弹”变“雷弹”?
带着莫大的期望上市,但上市后的安全性评估出现问题,给予新药推出致命的打击,如诺华的Beovu、赛诺菲的Dengvaxia、以及阿卡迪亚的Nuplazid 获批后安全性问题;使得原本预期为重磅炸弹药品变成了“哑弹”,销售业绩远不及预期。
诺华:Beovu
Beovu是诺华制药研发的一种新一代抗血管内皮生长因子(VEGF)药物,于2019年10月通过FDA优先审评获批用于治疗湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD)。
在未上市以前一直被市场看好媲美再生元重磅眼科产品Eylea(aflibercept,阿柏西普),认为有望打破取代Eylea全球畅销药的地位,成为在减少视网膜液方面表现更优的抗VEGF药物。
不过,由于其严重的副作用,存在血管炎和其他可能导致视力丧失的并发症,2020年4月被美国FDA予以黑框警告。此外,今年6月,因安全性受挫,与接受阿柏西普治疗的患者相比,Beovu 的眼内炎症发生率翻倍,诺华提前叫停了Beovu 3 项临床试验。
大大降低了Beovu的市场渗透率。此前华尔街分析师预测诺华的新眼药将在 2026 年位居市场榜首;预计到2021年底的收入约为43.8亿美元。然财报显示,2020年Beovu销售额仅为1.9 亿美元,2021 Q1 Beovu 的销售额仅实现了3900 万美元,比上一年下降了 44%(2021年截至目前的销售额也仅为 8700 万美元,与去年同期相比下降了 16%);而相比之下,阿柏西普同期在美国的销售额增长了 15%,达到 13.5 亿美元。
赛诺菲:Dengvaxia
Dengvaxia是赛诺菲呕心沥血花费15 亿欧元、历时20年研发的全球首个也是目前唯一一个上市的登革热疫苗。一度被认为是赛诺菲的又一款重磅炸弹产品;不曾想却成为一个“雷弹”。
根据赛诺菲公布的Dengvaxia临床试验随访数据显示,对于接触过登革热病毒的人,疫苗如期发挥作用;然而对于之前没有感染登革热的患者而言,预防接种可能会引起严重的重症病情,甚至导致休克综合症而死亡。且遭到菲律宾取消疫苗接种计划、并对赛诺菲追责退款。至此,Dengvaxia被打入冷宫,2020年销售数据亦未披露。
阿卡迪亚:Nuplazid
Nuplazid是由阿卡迪亚(Acadia)开发的靶向5-羟色胺2A受体(5-HT2A)的反向激动剂。是目前唯一获得FDA批准上市的,用于治疗因帕金森病引起幻觉或妄想症的药物。被誉为潜在10亿美元级别的重磅炸弹药。
然而,Nuplazid自2016年获批以来就饱受争议,能够上市得益于这个适应症非常缺乏新药。2017年11月ISMP统计到自Nuplazid上市到2017年间共有244名服用Nuplazid的患者死亡,2018年4月美国CNN报道称数百名名PD患者在服用Nuplazid后死亡,CNN怀疑患者出现安全事故与Nuplazid脱不了干系,当天Acadia的股价就下跌20%。
此外,2019年7月Nuplazid研究ENHANCE的精神分裂三期临床失败,令人质疑其活性范围。今年4月FDA拒绝了其治疗与痴呆相关的精神病(DRP)相关幻觉和妄想的补充新药应用(sNDA)。
2020年销售额仅4.418亿美元,远不及预期。
差异化优势不显
遭竞品碾压
不能做第一个吃到螃蟹的人,那么后继者必须具备突出优势,才能在掘金赛道闪光。然而Clovis Oncology 在 PARP 抑制剂领域的 Rubraca,以及默克公司和辉瑞在 SGLT2 领域的 Steglatro等均不具有明显的差异化优势,没能超越前者,还被后来者追赶。
辉瑞:Eucrisa
Eucrisa为一种非甾体外用 PDE4 抑制剂,为辉瑞 2016 年斥资 52 亿美元收购 Anacor Pharmaceuticals 时所交易的核心产品,同年获FDA批准用于治疗特应性皮炎 。辉瑞曾一度认为其Eucrisa销售额峰值有可能达到或超过 20 亿美元。
然而,万万没有想到受到晚于其三个月获批的赛诺菲和再生元的抗体注射 Dupixent 压迫竞争。Dupixent现在被公认为湿疹的首选。而Eucrisa 主要销售增长的窗口正在迅速关闭。2019 年全年,Eucrisa 的销售额 仅有1.38 亿美元,低于前一年的1.47亿美元。
与此同时,更多新增竞争对手也在加速瓦解瓜分辉瑞Eucrisa特异性皮炎市场,如刚刚获FDA批准的首个也是唯一一款JAK抑制剂Incyte公司的Opzelura;以及同为 PDE4 抑制剂的 Arcutis Biotherapeutics 的ARQ-151,目前正处于临床3期。
Clovis Oncology:Rubraca
Rubraca是一种口服、小分子的多聚ADP核糖聚合酶(PARP)抑制剂。是继2014年阿斯利康Lynparza后第二个在美国上市的PARP抑制剂。FDA曾授予Rubraca优先审评和突破性药物治疗的资格认定,同时还获得了孤儿药物的认定。
分析师曾预计Rubraca 2021 年的销售额可能达到 6.63 亿美元。然而,2021 年上半年,Rubraca 的销售额仅为 7490 万美元。相比之下,Lynparza 同期的销售额为 11.3 亿美元。
与此同时,随着PARP抑制剂市场的快速发展,Rubraca 的优势在竞品默沙东Zejula与阿斯利康Lynparza的光彩中失去了关注,且在维持治疗成为晚期卵巢癌患者的标准疗法这一领域已被Zejula和Lynparza抢去先发优势;此外,还葛兰素史克和辉瑞研究投资其他 PARP 抑制剂亦正在追随,后期Rubraca的商业之路更加困难重重。
默沙东/辉瑞:Steglatro
Steglatro为钠-葡萄糖协同转运蛋白-2 (SGLT-2)抑制剂,由默沙东和辉瑞共同开发,于2017年获FDA批准用于针对通过运动和饮食控制仍血糖不佳的2型糖尿病患者。
众所周知,2型糖尿病用药市场一直是一个成熟拥挤的赛道,在Steglatro获批之前,已有强生的 Invokana、阿斯利康的 Farxiga 和勃林格殷格翰以及礼来的 Jardiance 等其他 SGLT2 治疗药物进入市场,并已成熟商业化。2020 年这些药品达到了61.5 亿美元的总销售额,而预计2022年销售10.9 亿美元的Steglatro,2020年业绩却未被披露,意味着不尽如意。
默沙东和辉瑞试图通过价格竞争脱颖而出,将 Steglatro 及其 Segluromet 组合的定价定为 8.94 美元/天,而 Jardiance 为 13 美元/天,Farxiga 为 11.57 美元/天,优势并未凸显。
此外,在Vertis CV 试验中Steglatro 错过所有次要终点,该药物没有延长心血管死亡或因心力衰竭住院的时间,也没有预防肾脏问题,再次落后强生与阿斯利康等的同类产品。
Amarin:Vascepa
Vascepa常被简称为鱼油药,是一种来自鱼类,经过复杂工艺生产的单分子处方产品,由以乙酯形式的ω-3脂肪酸组成(通常叫做EPA),是一种经过FDA认定的新化学实体。2012年首次获批用于降低甘油三酸酯水平,时隔7年后,2019年12月获批降低心血管风险。寄希望于迎来新的业绩增长点。
但看似转变性的批准,将成为业绩新的引擎之后;Vascepa被美国内华达州地区法院裁定其关键专利无效,尽管Amarin辩称REDUCE-IT临床研究显示出的显著疗效证明了专利的合理性,然而法院并不买账。并且随着上诉失败,Amarin危机四伏,仿制药也在逼近,总部位于伦敦的 Hikma 推出的 Vascepa 仿制药已于2020年5月获FDA批准上市。
Leerink 分析师估计,到 2023 年,Vascepa 的销售额可能会下降 6% 至 22%,具体取决于 Amarin 新战略的成功以及 Vascepa 将在美国面临的仿制药竞争的程度。
适应症扩大遇阻
市场拓展有限
尽管上市后,阶段性取得客观的销售业绩。但是单一的适应症毕竟市场有限,唯有不断激发潜力,拓展新的适应症方能更受青睐。礼来的Lartruvo 和Intercept 的Ocaliva 就因扩大适应症失败而遭业绩滑铁卢。
礼来:Lartruvo
Lartruvo是人源IgG1单克隆抗体,对人血小板衍生生长因子受体-α (PDGFRα)有较高的靶向亲和力。Lartruvo由礼来开发,于2016年10月获FDA批准,是40年来,FDA加速批准的首个软组织肉瘤一线药物。
上市后,Lartruvo一直拥有不错的销售业绩,据公开数据显示,在上市的第一年,Lartruvo 的销售额达到了 2.03亿美元。2018 年,销售额为 3.047 亿美元。2019 年,分析师对Lartruvo 的销售额预测为3.745 亿美元。
然而在一个代号为ANNOUNCE大型三期临床试验中,结果显示患者使用Lartruvo后可能没有任何效果。随后,FDA 和欧洲药品管理局鉴于这个三期临床试验数据,建议停止使用Lartruvo;2019年4月,礼来将其从全球市场撤出,并于同年9月正式向FDA申请撤回Lartruvo。此外,FDA于2020年2月25日撤销了其批准。等了40年的明星抗癌药Lartruvo,就这样黄了。
Intercept :Ocaliva
Ocaliva(obeticholic acid,OCA)是Intercept开发的一款创新药物法尼酯X受体(FXR)激动剂,这是一种人类胆汁酸模拟物。于2016年获FDA加速批准上市,用于原发性胆汁性胆管炎(PBC)患者。
然而在扩大适应症方面,Ocaliva作为唯一一款获FDA授予治疗伴纤维化NASH突破性药物资格的实验性药物,在取得III期临床数据后, FDA多次推迟了对 NASH 药物的审查,不确定服用该药后给予患者的益处能抵御风险,这让 Intercept 重新回到了设计阶段。
FDA的拒绝,直接阻断了Ocaliva的市场拓展,原本被认为至少能达到16亿美元、至高能有86亿美元的销售峰值,2020年仅产生了 3.13 亿美元的收入。
错误估计市场
高昂定价折戟市场
药物开发商常常因未能获得有利的报销状态或错误估计市场对新产品的接受度而陷入困境。蓝鸟生物就是典型。由于其昂贵的基因疗法 Zynteglo 在欧洲未能获得覆盖,它最近从一家商业公司转变为一家临床阶段的生物技术公司。
蓝鸟生物:Zynteglo
Zynteglo 是一种旨在治疗血液疾病 β-地中海贫血的基因疗法,于2019年5月获EMA附条件批准上市;然为改进其药品规格和制造工艺,蓝鸟生物将其上市时间推迟到2020年;后又遇新冠疫情,首例患者今年2月才注射成功。
鉴于β地中海贫血和镰状细胞病的市场潜力,2019 年初的 Evaluate Pharma 将 Zynteglo 列为年度最有价值的药物发布之一,估计2024年的销售额为 18.7 亿美元。
然而推出之路阻碍重重。就在Zynteglo首例接种患者注射同月,在Lenti Globin针对镰刀状细胞贫血症(SCD)的临床研究中,出现了血癌病例;迫使蓝鸟暂停了Lenti Globin的临床研究和Zynteglo的销售。后经数据分析与审评,认为Zynteglo的收益大于风险,才于7月Zynteglo重新恢复了在市销售。
另外,Zynteglo在欧洲的价格标签高达157.5万欧元(约合183万美元),是继诺华脊髓性肌萎缩症基因疗法Zolgensma之后全球第二贵药物,高昂的定价再次引发争议。且未能与欧洲政府达成有关Zynteglo售价的协议,导致其公司将其撤出欧盟市场;与此同时有消息称蓝鸟生物也将撤回Zynteglo在英国的上市申请。如此看来,Zynteglo的推出之路还任重道远,短期内给予高额的利润回报是不可能的。
此外,有分析人士认为如果蓝鸟生物降低该疗法在欧洲的费用,那么在美国的收费也必须降低,如此一来,整个基因疗法领域的收费标准也将会面临崩溃。这应该是导致Bluebird Bio撤出欧盟市场的重要原因。
结语
以上10种只是新药脱轨众多绊脚石中的一小部分。尤其是在目前me-too类药品白热化竞争,first in class和me better面临着巨大挑战的中国,或许从cost center(成本中心)变成profit center(利润中心)是每个开发新药企业当务之急。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!