
2022-01-11 14:34:22来源:药智网浏览量:822
导读:今年,这些生物公司命运将会如何?
在中国进行的临床试验能否获得美国的批准?结果即将揭晓。
2022年,美国FDA将决定多个中国造的PD-(L)1单抗能否在美国上市,包括:信达/礼来(信迪利单抗)、君实生物/Coherus(特瑞普利单抗)、康方生物(派安普利单抗)、百济神州/诺华(替雷利珠单)。
2022年美国FDA关于PD-(L)1 单抗的审批计划
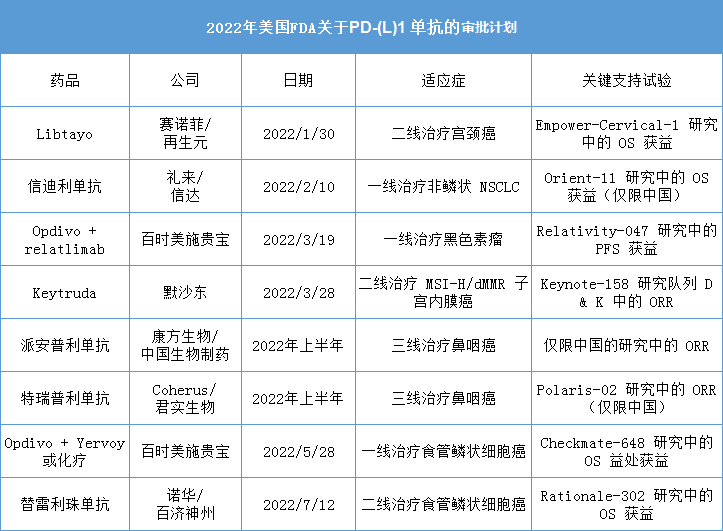
资料来源:evaluate
PD-(L)1全球都在“卷”
根据药智数据,截至2022年1月6日,PD-1靶点药物全球临床试验总数量已达3471项,其中中国(CDE注册)为675项,约占全球的19.5%。数据显示,全球PD-1临床试验数量从2012年开始飞速增长,并于2016-2020年间达到相对稳定的高峰,2021年开始有所下降。
PD-1研究在全球1-3期临床试验占比分别是13%、47%和26%,剩余占比为1/2期,4期,3/4期等。
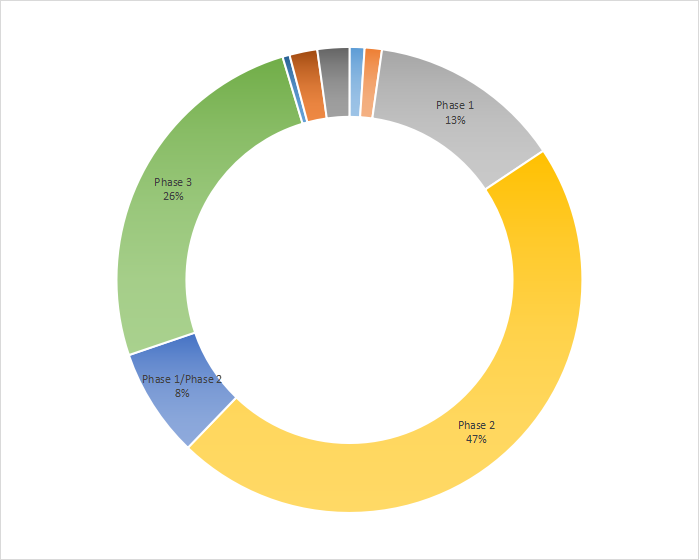
数据来源:药智数据
截至目前,中国共有12款PD-(L)1获批上市(8款为国产新药,4款为进口药)。
美国共上市11个PD-1类生物制品,涵盖7个上市品种。
默沙东:Keytruda
在所有上市的PD-(L)1单抗中,默沙东公司的Keytruda为销售冠军。
Keytruda是全球第二款获批上市的PD-1药物,Keytruda自上市以来已获批超20项肿瘤适应症。目前正在开展的1400余项临床试验中,与其他肿瘤治疗途径结合的临床试验超过1000余项。
2020年,Keytruda全球销售额143.80亿美元,2021年前三季度销售额为125.78亿美元。作为PD-1/L1抑制剂的领头羊,Keytruda有望于2025年登顶全球畅销药榜首,预计全球销售额将突破220亿美元。
2021年8月,美国FDA受理了Keytruda的一份补充生物制品许可申请(sBLA):作为一种单药疗法,用于治疗在任何情况下经先前系统治疗后疾病进展、且不适合进行根治性手术或放疗的微卫星高不稳定性(MSI-H)或错配修复缺陷(dMMR)晚期子宫内膜癌患者。PDUFA日期为2022年3月28日。
百时美施贵宝:Opdivo
销售额排名第二的是百时美施贵宝的Opdivo,2020年销售额为79.2亿美元,2021年前三季度销售额为60.3亿美元。
今年,Opdivo或将再收获两项一线治疗适应症。
美国FDA已受理LAG-3阻断抗体relatlimab与PD-1阻断抗体Opdivo固定剂量组合的生物制品许可申请(BLA),并授予了优先审查。PDUFA日期为2022年3月19日。
另一项适应症,Opdivo联合抗CTLA-4疗法Yervoy、Opdivo联合化疗(氟尿嘧啶+顺铂),一线治疗不可切除的晚期、复发或转移性食管鳞状细胞癌(ESCC)成人患者,PDUFA日期为2022年5月28日。
4大国产PD-1出海!结果即将揭晓
2021年让人印象深刻的词,除了创新出海、医保谈判等,还有“失败”。
去年12月初,万春医药的普那布林遭到了FDA的“劝退”。FDA在回应函中表示,单一注册试验的结果不足以证明效益,需要进行第二次良好的对照试验以满足支持适应症的实质性证据要求。其中,临床III期入组美国患者人数较少也是被拒的原因之一,在临床III期入组患者中,仅有13%来自美国和澳大利亚,剩余87%均来自中国。
不久前,美国FDA专家Pazduer博士又在会议上表示,新药获批仅靠一个国家的临床数据,比如只靠中国的临床数据,显然是有问题的,这和美国在临床试验中努力增加患者多样性的原则背道而驰。他的观点被解读成,美国FDA可能会对临床数据完全来自中国的新药收紧审核。
对于正在寻求出海的多个国产PD-(L)1单抗,投资者不免担忧。不过,能否获批结果很快就会知道了。
特瑞普利单抗
去年2月,君实生物与美国生物药公司Coherus就特瑞普利单抗在美国和加拿大的开发和商业化达成合作。3月,君实生物披露公告,已经向FDA提交特瑞普利单抗用于治疗复发或转移性鼻咽癌的BLA。
特瑞普利单抗是全球首个获批鼻咽癌治疗的抗PD-1单抗。截至目前,美国FDA没有批准过任何肿瘤免疫疗法作为鼻咽癌的治疗选择,而特瑞普利单抗已获美国FDA用于治疗食管癌、黏膜黑色素瘤、鼻咽癌及软组织肉瘤等4项孤儿药资格认定,美国FDA还授予特瑞普利单抗2项突破性疗法认定,并于2021年12月被授予优先审评,将10个月标准审评时间缩短至6个月。
特瑞普利单抗采取的是“滚动申请”,即药企在申请新药上市许可时,可以将申报文件分批次提交FDA进行审评,而无需等待申报文件全部完成后才向FDA提交申请,此举可缩短新药的审评周期。
信迪利单抗
信达生物是第二家向FDA提交PD-1上市申请的国产创新药企。2021年5月,美国FDA正式受理了信迪利单抗联合培美曲塞和铂类用于非鳞状非小细胞肺癌(NSCLC)一线治疗的新药上市申请BLA。
信达生物采取的是“正常申请”,通常需要10个月时间,耗时更长,但因为君实生物目前还没有完成申请,仍然处于滚动中的状态。而信达生物比较明确的一点是,FDA对信迪利单抗的上市申请作出决议的目标日期是2022年3月前。
派安普利单抗
康方生物是第三家向FDA递交PD-1上市申请的国内企业,派安普利单抗(AK105)向美国FDA提交BLA申请的适应症为:三线治疗转移性鼻咽癌。
派安普利单抗是中国首个在FDA的RTOR(实时肿瘤审评)项目下进行BLA的PD-1药物。
据悉,加入RTOR计划的药物,相较过去快速审评通道、突破性疗法或者孤儿药等方式,批准所需时间将大大缩短,是FDA药物审评最快的通道。
替雷利珠单抗
2021年9月,美国FDA受理了替雷利珠单抗的新药上市申请(BLA),用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。PDUFA目标日期为2022年7月12日。
早在2021年1月,诺华就与百济神州达成合作与授权协议,诺华获得替雷利珠单抗在美国、加拿大、墨西哥、欧盟、英国、日本等多个国家的开发、生产和商业化权利,总交易金额达22亿美元,而百济神州获得的首付款就高达6.5亿美元,刷新了中国新药“出海”首付金额的历史记录。百济神州此次出海似乎信心满满。
结语
PD-(L)1赛道日益拥挤,国内“内卷”尤其严重,再加上医保价格战激烈,因此“出海”被认为是重要商业路径。
但“出海”也不是一件容易的事。
2021年以来,在10项PD-(L)1单抗“悬而未决”的加速批准中,有四项由于响应率低而被自愿撤回。其余六项在 2021 年 4 月的肿瘤药物咨询委员会(ODAC)会议上进行了讨论:三项计划被撤回;一项转换为常规批准,用于更有限的适应症;另外两项正在进行验证性试验和监管审查。
由此可见,在PD-(L)1的审核上,美国FDA也已经调高了难度。
在这场国产PD-1“出海大战”中,2022年将是重要的一年,美国FDA首张上市批文何时获得、花落谁家,让我们拭目以待。
参考来源:
1.https://www.evaluate.com/vantage/articles/events/company-events/days-reckoning-immune-checkpoint-blockers
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!