
2022-03-04 16:50:04来源:药智网浏览量:823
导读:盲目me too是不行的。
自信达生物PD-1在美国FDA的审批受阻以来,创新药市场悲观情绪再度蔓延,不过这并没有持续太久。
2022年2月28日,传奇生物传来好消息,公司自主研发的BCMA靶向CAR-T疗法西达基奥仑赛(英文商品名:CARVYKTI®,英文通用名ciltacabtagene autoleucel,简称Cilta-cel)正式获得美国FDA批准上市, 用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者。
这是继2019年百济神州泽布替尼后,第二款由中国企业研发,获FDA批准的抗癌新药。也是传奇生物自成立以来第一款获批上市的产品。

优秀的临床数据才是出海的底气
对比信达生物PD-1本身的me-too属性及利用单一国家数据报批,本次传奇生物Cilta-cel优秀的临床试验为其获得批准提供了基础。
1.FDA认为信达生物现有的试验并非是临床未满足的需求,现有的同类药物K药已经满足了需求。而传奇生物的BCMA CAR-T美国只有一款产品(BMS/蓝鸟的Abecma)并且在有效性和安全性上做到了best in class。
2.FDA认为信达生物临床终点设计存在缺陷,以PFS而非是OS;而传奇生物主要终点设置为ORR,与已获批的Abecma设置标准对应。
3.FDA认为信达生物单一中国病人的生物多样性无法确认;而传奇生物采取的是多中心临床(美国、日本、欧盟等)。
基于此,在获批之前,大家对Cilta-cel的期待一直很高。
当然,Cilta-cel的底气还在于优秀的临床数据。
在关键的CARTITUDE-1研究中,97例R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%(95%CI:92.7-99.7),78%的患者获得了严格的完全缓解(sCR,95%CI:68.8-86.1)。在18个月的中位随访时间中,中位缓解持续时间(DOR)为21.8个月(95% CI,21.8-无法预估)。这证明了Cilta-cel是靶向BCMA的多发性骨髓瘤的BIC产品。
全球上市CAR-T疗法一览
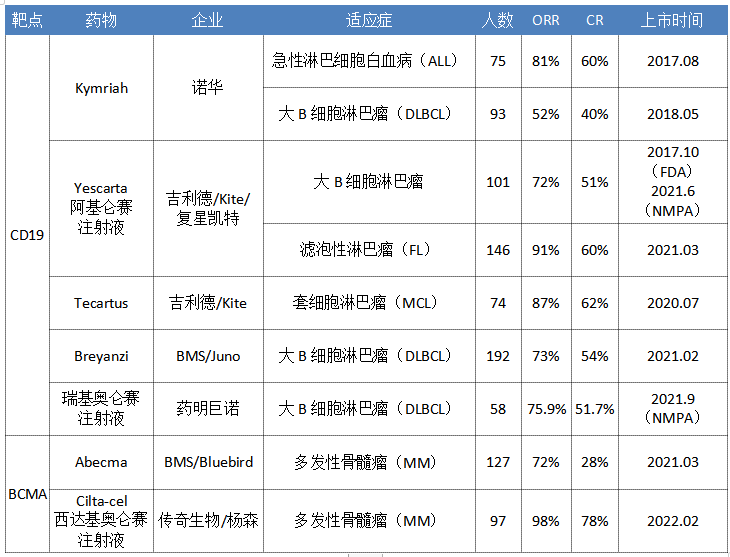
数据来源:药智数据、企业公告等
FIC/BIC出海加速
创新药为什么一定要出海?当然是为了追求创新市场最大化。
面临国内集采政策与国家医保谈判所带来的药价压力,大家开始意识到国内市场很难再有10亿美元以上的重磅炸弹级药物。仅局限于国内市场的药企将面临研发投入无法收回的困境。在此趋势下,走国际化路线,参与全球竞争将是中国药企未来的必然选择。
据悉,早在2009年,恒瑞医药的磷酸瑞格列汀临床研究就进行了中美双报,并获得了批准。
不过,直到2017年,我国正式加入国际人用药品注册技术协调会(ICH)之后,本土药企创新药进行中美双报和同步开发才成为主流。2017年之后中美双报的临床获批数量较2017年前翻了近10倍。
2019年,泽布替尼成为中国首个在美国获批的本土研发抗癌新药。
泽布替尼开展了全球多中心、头对头试验:ALPINE研究和SEQUOIA研究,针对临床具有统治地位的伊布替尼和苯达莫司汀+利妥昔单抗(B+R治疗方案)发起挑战,成功证明自己的同类最优潜力。
百济神州的付出很快得到了回报。2021年,泽布替尼全球累计销售额约14亿元,同比增长423%。在美国全年销售额为1.157亿美元,同比增长535%。而且,泽布替尼2021年在美国已新增两项适应症,今年底有望再增两项适应症,成长潜力巨大。
2022年2月,传奇生物BCMA CAR-T疗法西达基奥仑赛获得美国FDA批准上市,成为新的里程碑。Cilta-cel的定价为46.5万美元,其主要竞争者百时美施贵宝的Abecma定价为41.95万美元。强生曾预估Cilta-cel有望达到50亿美元的销售峰额。
结语
从泽布替尼到Cilta-cel的成功出海,都在告诉我们,具有临床价值的创新药才是市场期待的,扎堆的me too行不通。创新药出海,要么像百济神州,敢于开展“头对头”研究证明自己BIC属性;要么像传奇生物,在立项之初便独辟蹊径,将研发方向定位为解决未被满足的临床需求,选择全新靶点进行研究。
希望未来国内能孵化出更多FIC、BIC,造福患者。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!