
2022-07-08 14:34:09来源:医药魔方info浏览量:1285
7月6日,CytomX Therapeutics宣布,praluzatamab ravtansine在激素受体阳性(HR+)/人表皮生长因子受体2 (HER2)-非扩增性乳腺癌(A组)患者中进行的II期研究达到了主要疗效终点,经中心放射科审查(central radiology review)确认的客观缓解率(ORR)大于10%。

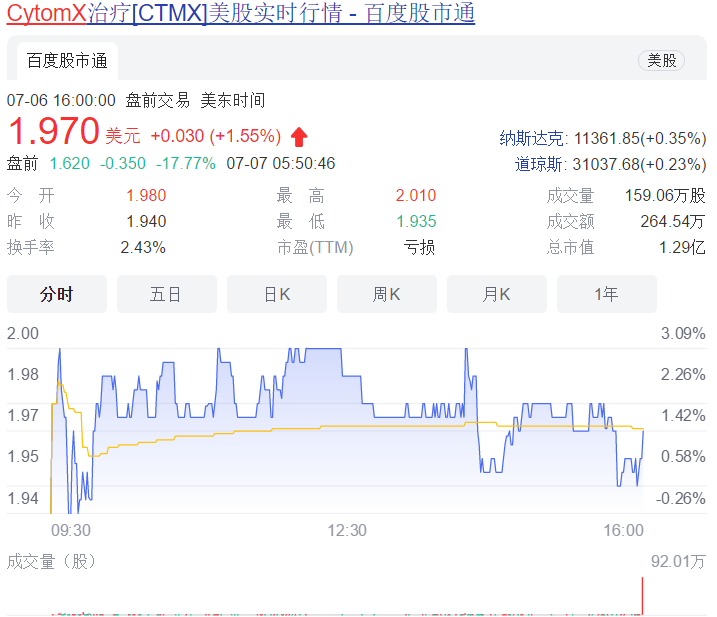
受此消息影响,CytomX股价盘后大跌近18%。
Praluzatamab ravtansine是一款first-in-class、DM4-偶联、靶向CD166的条件激活抗体药物偶联物(ADC),由CytomX公司全资拥有。其采用了CytomX公司Probody®平台技术,结合掩蔽肽来覆盖和阻断抗体的细胞结合区域。优势在于ADC只有在肿瘤微环境中被特定酶有条件激活后,才能与表达CD166的癌细胞结合。从而大大提高了安全性,并扩大治疗窗口。

至2022年5月13日数据截止时,47名晚期HR+/HER2-非扩增乳腺癌患者(未检测CD166表达情况)可评估主要疗效终点。中心放射科审查的ORR为15%。研究者确认的24周临床受益率 (CBR24)为40%(定义为24周内达到任何缓解(确认或未确认)或疾病稳定的概率);中位无进展生存期为2.6个月。
A组中的所有患者均以每三周给药7mg/kg的初始II期起始剂量进行治疗。B组在晚期三阴性乳腺癌(TNBC)患者中未达到方案定义的无效边界(ORR小于 10%),B组和C组均将终止受试者入组。
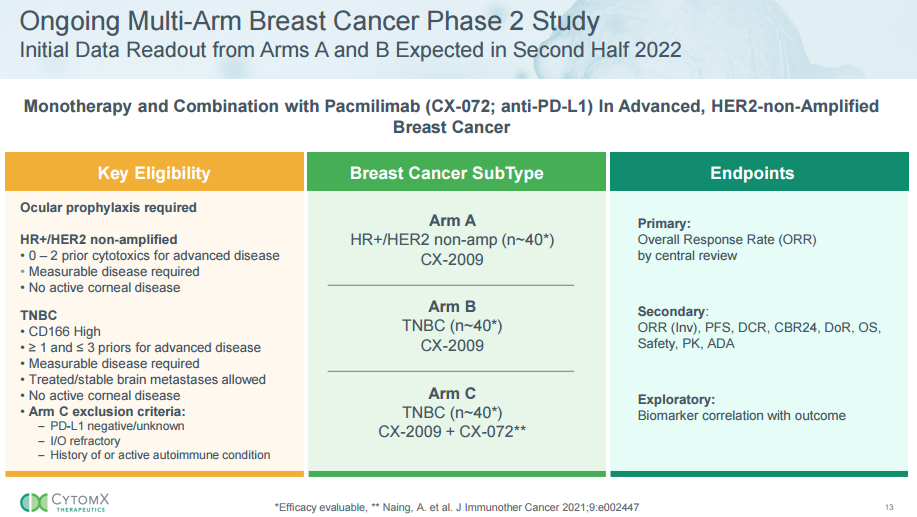
安全性方面,数据截止日期,A组中praluzatamab ravtansine的安全性与 I 期研究中观察到的毒性和DM4有效载荷基本一致;即,导致剂量调整的高级别毒性主要为眼毒性和神经毒性。30%的患者因不良事件 (AE) 而停止治疗。3级及以上眼部和神经毒性发生率分别为15%和10%。
B组在TNBC患者中评估了7mg/kg和6mg/kg的效果。7mg/kg起始剂量的毒性特征与A组一致。在6mg/kg队列中,无患者因AE相关事件停止治疗,3级及以上眼部或神经病变发生率分别为3%和0%。生物标志物分析正在进行中。
首席执行官兼董事长 Sean McCarthy 博士表示:“praluzatamab ravtansine的II期评估结果支持了这种新型候选药物在激素受体阳性乳腺癌中的单药活性,这些患者仍有显著的未满足需求。然而,不认为7mg/kg的中位无进展生存期支持该剂量下的进一步评估。虽然我们对6mg/kg的安全指标感到鼓舞,但鉴于目前的金融市场状况,我们不会单独推进这一项目,将寻求合作伙伴。”
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!