据外媒Endpoints、fiercepharma以及ALS协会官网报道,FDA已于9月29日批准Amylyx公司Relyvrio(苯丁酸钠和牛磺酸二醇口服固定剂量配方,AMX0035)用于治疗肌萎缩侧索硬化(ALS)成人患者,商品名为Relyvrio。该药物是首款在随机、安慰剂对照临床试验中显著延缓ALS疾病进展并能延长生存期的治疗药物,也是116年以来FDA批准的第3款ALS治疗药物。
目前还没有关于价格的信息,Relyvrio在加拿大的售价约为16.3万美元,该药于今年6月获加拿大卫生部有条件获批,商品名Albrioza,是Albrioza在全球范围内的首次批准上市(见:全球首批!“渐冻人”症迎来创新疗法)。
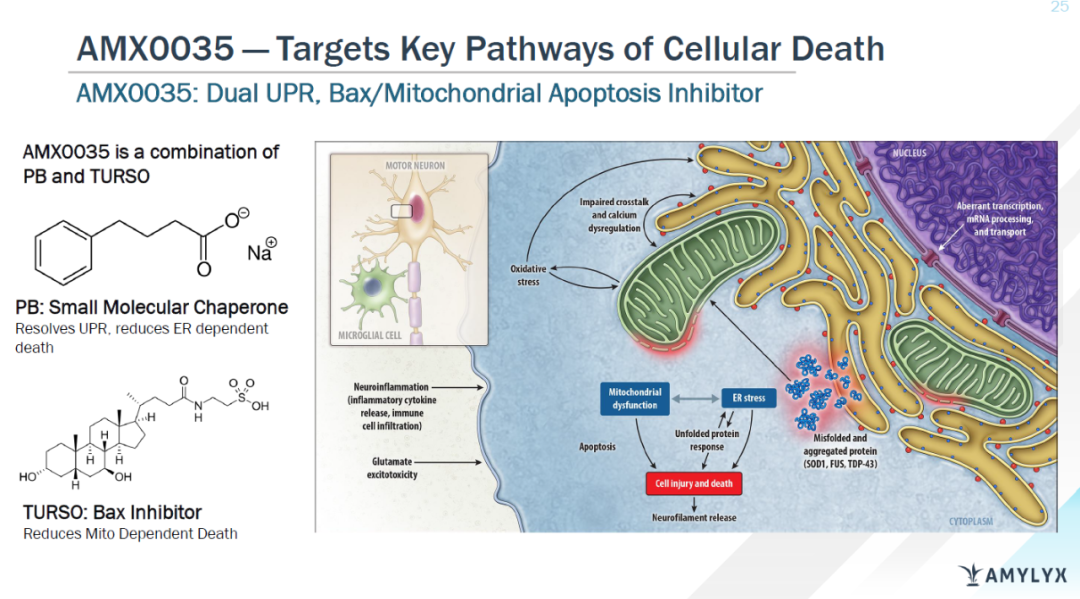
ALS协会也在庆祝这一批准。 该协会在一份声明中表示,该组织将2014年ALS冰桶挑战筹得的220万美元投资于这种药物的研发。它还领导了长达数年的宣传运动,以使这一疗法获得批准,包括在2020年9月向FDA提交了超过5万个签名,呼吁该机构批准该药物。分析人士预计,尽管Relyvrio的患者人数相对较少,但其销售情况还是会比较强劲。假设其定价与加拿大相似,Relyvrio的销售额可能达到每年8亿美元左右的峰值。不过,考虑到所需的时间,Amylyx可能需要一两年的时间才能实现这一目标。预计Relyvrio 2023年的销售额将达到5.45亿美元。 肌萎缩侧索硬化症(简称ALS),俗称“渐冻症”,这是一种不可逆的致死性运动神经元病,主要症状为四肢和躯干肌肉表现进行性加重的肌肉无力和萎缩,逐渐失去运动功能,像被“冻住”一般,所以俗称“渐冻人”。该病一般进展迅速,半数以上患者确诊后平均生存时间为3-5年,最后多死于呼吸肌无力导致的呼吸衰竭。据估计,ALS在全球范围内的发病率约为十万分之二。FDA分别于上世纪90年代和2017年批准了另外两款ALS治疗药物利鲁唑和依达拉奉,但它们对功能、生存和症状管理的影响不大。今年早些时候,FDA还批准了依达拉奉的一种新的口服制剂,该药物此前通常是通过静脉输液给药。 目前,ALS的发病机制尚不明确,科学家普遍认为其病因是基因与环境共同作用的结果。较为常见的ALS致病基因包括SOD1,TDP-43,研究显示,25.6%~30.6%的家族性ALS患者有SOD1突变。其它可能的发病机制包括RNA加工异常、谷氨酸兴奋性毒性、细胞骨架排列紊乱、线粒体功能障碍、病毒感染、细胞凋亡、生长因子异常、炎症反应等。Albrioza(AMX0035)是一种由苯丁酸钠(sodium phenylbutrate,PB)和牛磺酸二醇(taurursodiol,TURSO,又名ursodoxicoltaurine)组成的专有口服固定剂量复方制剂。PB是一种小分子伴侣,旨在减少未折叠蛋白反应(UPR),防止因UPR导致的细胞死亡。TURSO是一种Bax抑制剂,旨在通过凋亡减少细胞死亡。PB和TURSO在固定剂量配方中联合使用,靶向肌萎缩侧索硬化症(ALS)和其他神经退行性疾病中的内质网和线粒体依赖性神经元退行性变通路,减少神经元死亡和功能障碍。2022年3月,PCNSDAC以6:4的投票,表达了对AMX0035现有数据说服力的怀疑——包括试验规模小、缺失数据、用于分析主要终点的统计方法的适当性以及随机化方案等问题。这些最终指向了一个结论——II期结果虽然具有统计学意义,但仍不足以确定AMX0035可以改善疾病进展。在II期CENTAUR试验中,研究人员在137名ALS患者中测试了AMX0035与安慰剂为期六个月的治疗效果,研究的主要终点是ALS功能评定量表总分的下降率。结果显示,接受AMX0035治疗的患者平均得分高出2.32分,下降速度减缓25.3%,具有统计学意义。长期随访研究表示,3年左右时AMX0035仍可表现一定生存益处。与安慰剂相比,AMX0035可将死亡风险降低约44%。但在6个月的随机期间,Amylyx没有发现统计学上显著的生存差异。2022年6月,FDA通知Amylyx,将AMX0035的PDUFA日期延长至2022年9月29日,以便有更多时间审查AMX0035临床研究数据的额外分析。2022年9月8日,FDA外周和中枢神经系统药物咨询委员会(PCNSDAC)以7:2的投票结果赞成该公司在研药物AMX0035的现有研究数据足以支持其用于治疗肌萎缩侧索硬化的上市申请。PCNSDAC的投票结果虽不具有约束力,但本次FDA批准AMX0035的上市申请应予以考虑了专家组的建议。AMX0035在ALS患者中的III期临床试验正在进行中,计划于2023年底或2024年年初完成。下一个ALS新药可能也会很快到来,今年7月渤健和Ionis的在研反义寡核苷酸疗法tofersen(BIIB067)上市申请已获FDA受理,用于治疗超氧化物歧化酶1 (SOD1)突变所致的ALS。FDA同时授予其优先审评资格,PDUFA日期定于2023年1月25日。与 Amylyx 一样,Biogen也面临着关于其数据质量的问题。与安慰剂相比,Tofersen在ALS评定量表上未能达到统计学意义,但Biogen正试图利用替代终点生物标志物赢得批准。通过降低患者血液和脑脊液中被称为神经丝蛋白的蛋白质,Biogen认为tofersen的作用很可能转化为临床获益。ALS协会官网链接:https://www.als.org/stories-news/fda-approves-first-als-treatment-funded-ice-bucket-challenge
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!