
2022-11-08 14:54:22来源:药智网浏览量:750
导读:乳腺癌“神药”威力再显。
近日,第一三共发布了二季度财报,其与阿斯利康合作的重磅ADC药物Enhertu(DS-8201)上半年销售额795亿日元,约合5.68亿美元(140日元兑1美元),更上调了全年业绩,预测Enhertu 22年全球销售额将达到1952亿日元(13.93亿美元)。
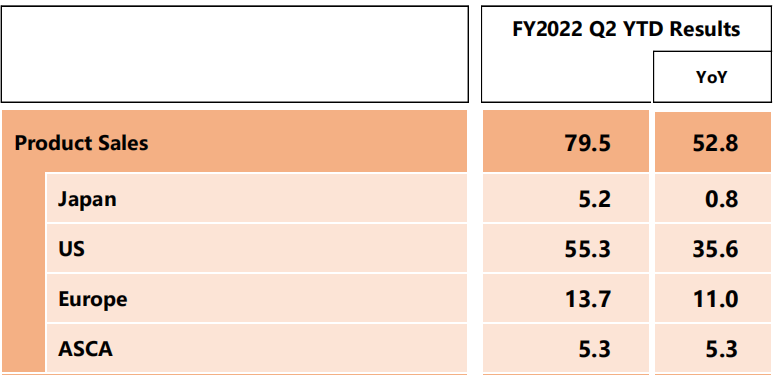
图1 Enhertu的各地区销售情况
来源:二季度报(十亿日元)
据不完全统计,目前上市的14款ADC药物中,只有Seagen/武田的Adcetris和罗氏的Kadcyla,在去年的全球销售额超过10亿美元。
Seagen/武田的Adcetris,突破10亿美元的销售大关,用时将近10年;罗氏Kadcyla则用了5年时间,而乳腺癌神药Enhertu(DS-8201)或将仅仅只用两年时间。
最快破$10亿ADC药物?乳腺癌“神药”Enhertu究竟有何魅力,谁能与HER2 ADC一战?
01 乳腺癌“神药”威力再显
Enhertu是阿斯利康和第一三共联合开发的一款靶向HER2的抗体药物偶联物,通过一种4肽链接子将靶向HER2的人源化单克隆抗体trastuzumab(曲妥珠单抗)与一种新型拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)链接在一起,可靶向递送细胞毒制剂至癌细胞内。
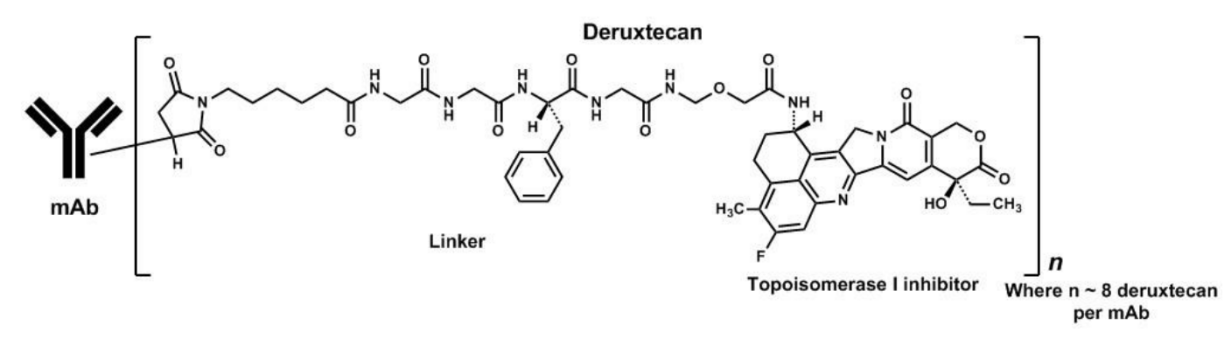
图2 Enhertu的组成
来源:说明书
具备4大优点:
更高的载药量:运用独特的疏水性连接子与半胱氨酸残基定点偶联技术,降低了ADC的疏水性,T-DXd(Enhertu)每个抗体可以携带7-8个DXd分子。药物与抗体比率(DAR)高于T-DM1(Kadcyla)的3-4。
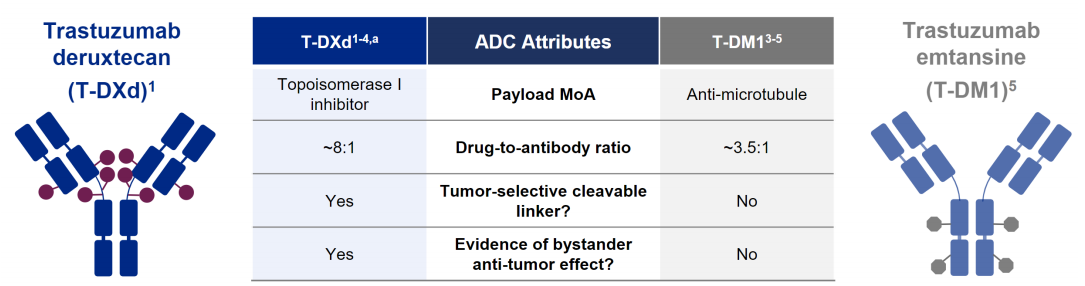
图3 T-DXd相较于T-DM1的优势
来源:华创证券
弹头选择:DXd与微管抑制剂相比,其毒性更强,半衰期更短,毒素在人体内存留的时间更短
linker设计:T-DXd的疏水性四肽linker可以被肿瘤细胞中高表达的溶酶体酶降解从而释放DXd,并可避免药物聚合。
另外,DXd具有较高的膜穿透性,释放后的DXd可以穿透至邻近肿瘤细胞,通过“旁观者效应”发挥杀伤作用。
2019年3月,阿斯利康和第一三共签订全球合作开发和商业化协议,以首付款13.5亿美元+潜在里程碑55.5亿美元的金额大笔获得Enhertu。
这次的交易总额达到69亿美元,作为回报阿斯利康将与第一三共平等的分享日本以外的全球利润,对阿斯利康来说这是其扩大肿瘤学影响的一场豪赌。
现在看来是值得。
三季报中提到随着新适应症的获批以及市场渗透率增长,Enhertu销售必将实现稳定增长。
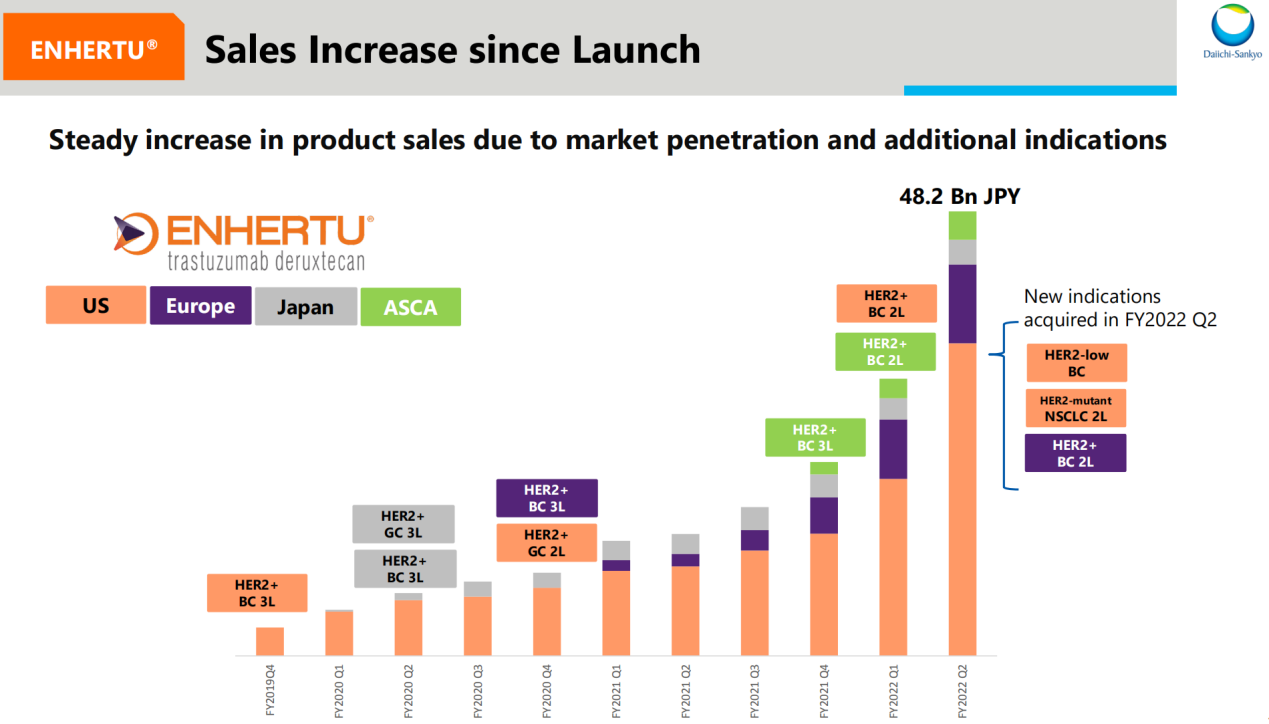
图4 Enhertu适应症获批进度和主要地区销售情况
来源:二季度报
乳腺癌
乳腺癌患者中根据癌细胞表达的受体类型可分为三类:HER2阳性、HR阳性/HER2阴性、和三阴性(ER-PR-HER2-)乳腺癌。
其中HER2阳性乳腺癌患者占比约20%,首选疗法是HER2靶向治疗,已有多款HER2靶向药物获批。
HER2阴性患者(约占80%)治疗选择相对有限,HER2低表达的乳腺癌患者占比约50%。
HER2阳性乳腺癌
2019年12月FDA批准Enhertu用于治疗接受过2种或以上抗HER2疗法治疗的无法切除或转移性HER2阳性乳腺癌患者。
Enhertu与大名鼎鼎的ADC药物Kadcyla头对头试验的基础上被FDA获批,根据发表在NEJM的研究显示(DESTINY-Breast03),Enhertu vs Kadcyla的12个月PFS率为75.8%vs 34.1%;12个月OS率为94.1%vs 85.9%;Enhertu vs Kadcyla的ORR为79.7%vs 34.2%,可见Enhertu在头对头研究中展现出远超Kadcyla的疗效。
2022年5月FDA批准Enhertu用于治疗无法切除或转移性HER2阳性乳腺癌患者,这些患者曾经接受过一种抗HER2靶向疗法的治疗。
HER2低表达乳腺癌
2022年8月FDA批准Enhertu用于治疗不可切除或转移性HER2低表达(免疫组化[IHC]1+或2+/原位杂交[ISH]阴性)乳腺癌成人患者。
其中HER2低表达的乳腺癌患者占比约50%,治疗手段有限以化疗手段为主。Enhertu成为首个在HER2-low的人群中做出生存优势的HER2靶向治疗,这有望重新定义HER2-low乳腺癌治疗。
FDA的批准是基于DESTINY-Breast04 III期试验的结果。
在该试验中,与医生选择的化疗相比,Enhertu将激素受体阳性(HR+)或激素受体阴性(HR-)的HER2低表达转移性乳腺癌患者的疾病进展或死亡风险降低了50%,PFS:9.9月对比5.1个月(HR:0.50;95%CI 0.40-0.63;p<0.0001)。接受Enhertu治疗的患者的OS为23.4个月,而化疗组为16.8个月,Enhertu与化疗相比将死亡风险降低了36%(HR 0.64;95%CI 0.49-0.84;p=0.001).
胃癌
2021年1月FDA批准Enhertu用于治疗HER2阳性转移性胃或胃食管交界(GEJ)腺癌患者,是第一个被批准治疗HER2阳性胃癌的ADC药物。
Enhertu在美国和日本的胃癌适应症批准,均基于开放标签、随机2期DESTINY-Gastric01试验的结果。研究中,患者(先前接受过2种或多种方案(包括5-FU、含铂化疗、曲妥珠单抗)但病情进展)以2:1的比例随机分配,接受Enhertu(6.4mg/kg)或研究调查员选择的化疗(紫杉醇或伊立替康单药治疗),每三周一次。结果显示,Enhertu组的ORR为51.3%(95%CI:41.9-60.5%)、化疗组为14.3%(95%CI:6.4-26.2%)。在一项预先指定的中期分析中,Enhertu组与化疗组相比死亡风险降低41%(HR=0.59;95%CI:0.39-0.88;p=0.0097)。Enhertu组的中位OS为12.5个月、化疗组为8.4个月。
肺癌
2022年8月,FDA批准Enhertu用于治疗携带激活性HER2突变的无法切除或转移性NSCLC患者。这也是FDA批准治疗HER2突变NSCLC的首款药物。加速批准的疗效基于DESTINY-Lung02。患者(患有不可切除或转移的HER2突变非鳞状非小细胞肺癌,并在先前的全身治疗后疾病进展)通过静脉输注接受Enhertu 5.4mg/kg,每3周一次,直到出现不可接受的毒性或疾病进展。试验结果显示客观缓解率为58%,中位缓解持续时间为8.7个月。
02 谁能与Enhertu一战?
在全球以企业主导的ADC药物临床研发共约350项,中国约166项,占比约为47%,全球在研ADC药物的靶点前三分别为HER2、TROP2和CLDN18.2。
HER2是目前全球ADC药物开发的头号靶点,全球有接近50款已上市或在研的靶向HER2的ADC药物,其中有3款已经获批上市,分别是罗氏的Kadcyla、第一三共的Enhertu还有首款国产ADC药物荣昌生物的RC48(维迪西妥单抗)。
在国内市场,HER2同样是ADC研发的头号靶点,Claudin-18.2、Trop-2等靶点的竞争亦非常激烈,从研发进度上来看目前国内的企业研发的ADC药物多数处于早期研究,进展较快的集中于HER2和TROP2等靶点。
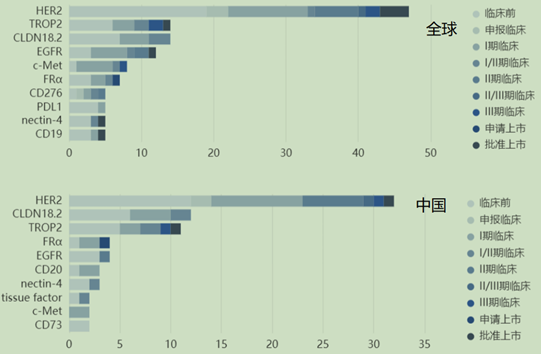
图5 全球和中国ADC药物临床阶段各靶点占比
来源:东吴证券
在国内,荣昌生物自主研发的HER2ADC维迪西妥单抗已经获批上市用于治疗胃癌和尿路上皮癌,还在就治疗多种实体瘤进行临床试验,如乳腺癌、非小细胞肺癌、胆道癌、妇科恶性肿瘤、晚期黑色素瘤等。除此之外,恒瑞的SHR-A1811、东曜药业的TAA013等也已经进入3期临床……
小结
ADC药物现在是生物医药医药领域最为火热的赛道之一,Enhertu的大卖必将该赛道的竞争推向白热化,DS-8201的降维打击不仅让T-DM1胆战心惊,后面一众跟进的企业想要在DS-8201的绞杀下分一杯羹更是谈何容易。
去年百奥泰最终宣布停止ADC项目BAT8001,Ambrx Biopharma宣布考虑到HER2靶点的竞争格局,将HER2 ADC ARX788移出内部研发管线,虽然将与合作伙伴新码生物继续合作推动ARX788的开发,但是能够在头对头试验中胜出结果未可知。
这些故事给所有后来者都敲响了警钟。
目前来看,无论是全球还是中国在整个ADC领域都存在适应症和靶点扎推的现象,HER2靶点更是成为焦点,DS-8201的优异表现让所有HER2 ADC赛道的玩家都如坐针毡,在ADC领域谁有能力与之一战,我们拭目以待!
参考资料:
1.ADC爆发,半年营收翻倍,阿斯利康......
2.刚刚!重磅ADC药物DS-8201,获NMPA受理,AZ为它花了69亿美元!
3.69亿美元!阿斯利康与第一三共达成肿瘤学战略合作,开发靶向HER2的抗体药物偶联物DS-8201。
4.第一三共将在2022年ESMO年会上介绍DXd ADC产品组合,全力推动肿瘤领域进展
5.第一三共二季度报、华创证券、东吴证券、国金证券、FDA等网上公开资料。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容