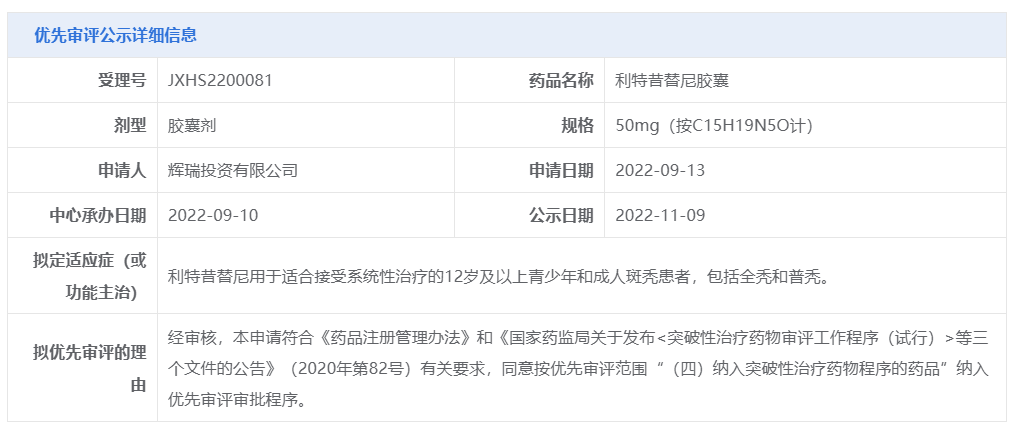
11月9日,CDE官网显示,辉瑞的利特昔替尼胶囊(ritlecitinib)上市申请拟纳入优先审评,用于适合接受系统性治疗的12岁及以上青少年和成人斑秃患者,包括全秃和普秃。此前,该适应症曾获CDE突破性疗法认定。
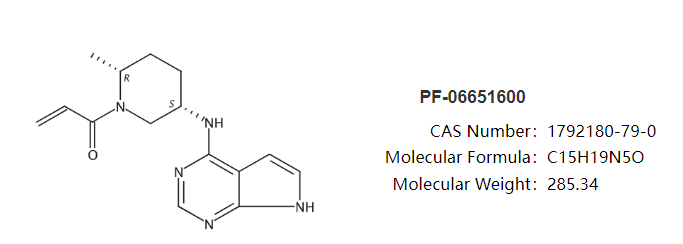
利特昔替尼是由辉瑞开发的一款新型口服靶向Janus激酶3(JAK3)抑制剂。研究证明,利特昔替尼可阻断信号分子和免疫细胞活性,而这些信号分子和免疫细胞被认为是导致斑秃的原因。与第一代泛JAK抑制剂相比,利特昔替尼在降低毒性方面更有优势。今年9月,利特昔替尼治疗斑秃的上市申请相继获美国FDA和欧洲EMA受理,预计分别在2023年第二季度、第四季度作出监管决定。该药在欧美的上市申请是基于既往公布的IIb/III期ALLEGRO研究和正在进行的III期ALLEGRO- LT长期研究的结果。ALLEGRO是一项随机、双盲、安慰剂对照、IIb/III期研究,旨在评估ritlecitinib治疗12岁及以上斑秃患者(n=718)的疗效和安全性。入组患者至少有50%的头发因斑秃而脱落,包括全秃(头发全部脱落)和普秃(全身毛发均脱落)患者,并且已持续6个月至10年的斑秃发作。患者随机接受每日1次ritlecitinib 30mg或50mg(接受或不接受1个月的初始治疗:每日1次ritlecitinib 200mg)、ritlecitinib 10mg或安慰剂治疗。主要终点为第24周时绝对SALT评分≤20,对ritlecitinib治疗有反应的头皮毛发再生患者比例。SALT是一种测量头皮脱发量工具,评分越高,脱发越严重。结果显示,每日服用30mg和50mg ritlecitinib治疗的患者(无论是否接受为期4周的初始治疗)在24周时,头皮毛发覆盖率≥80%的患者比例显著高于安慰剂组。总的安全性数据表明,ritlecitinib在成人和青少年患者中耐受性良好。最常见的不良事件为头痛、鼻咽炎和上呼吸道感染。ALLEGRO-LT是一项正在进行的开放标签的、长期的III期研究,旨在评估ritlecitinib在脱发率为25%或以上的成人斑秃患者和脱发率为50%或以上的12岁青少年斑秃患者中的安全性和有效性。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容