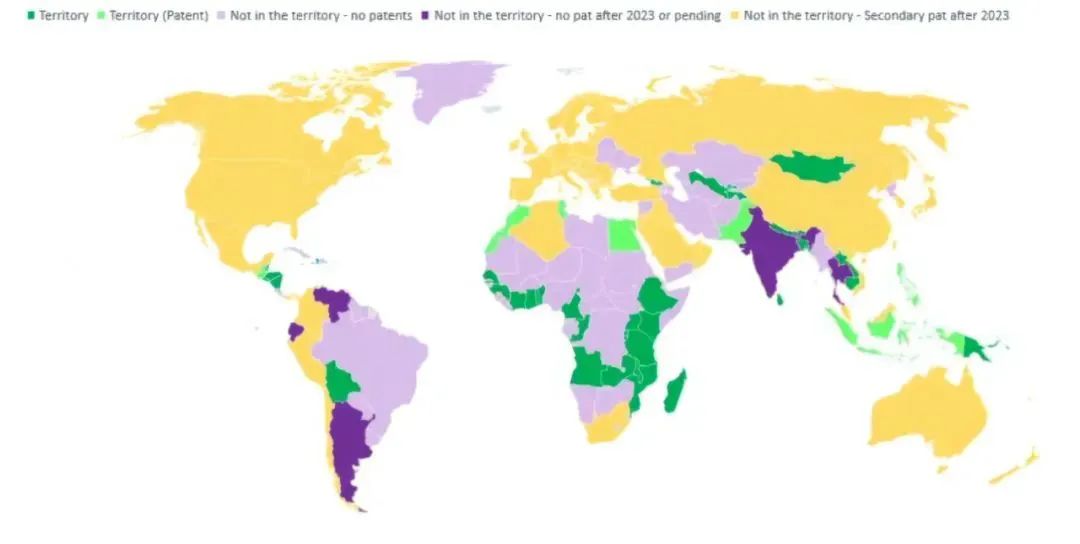
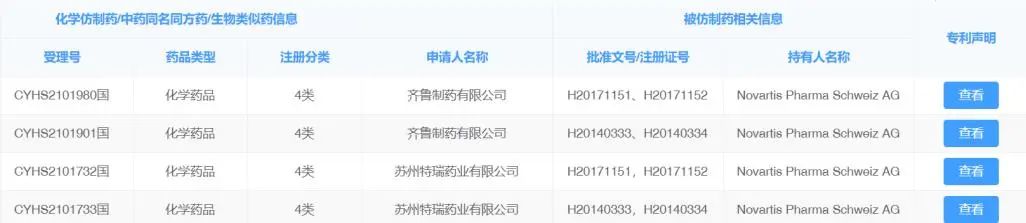
近日,在第27届世界癌症大会上,药品专利池宣布与诺华公司就治疗慢性髓细胞白血病(CML)药物尼洛替尼(Nilotinib)签订一项专利许可协议,以扩大尼洛替尼在中低收入国家的可及性。通过该协议,选定的仿制药企业可以在许可地区开发、生产和供应尼洛替尼仿制药。这是药品专利池为推动抗癌药在中低收入国家可及性而签订的首个专利许可协议。2018年热映的《我不是药神》讲述的就是一群慢性髓细胞白血病患者努力寻求救命药“格列宁”(真实药名格列卫,通用名甲磺酸伊马替尼)的故事。尼洛替尼是慢性髓细胞白血病二线治疗药物,对慢性骨髓性白血病患者服用伊马替尼而产生的抗药性有很好的疗效,可用于成人和至少1岁以上儿童的治疗。2007年尼洛替尼获得美国FDA批准, 2009年获得欧盟EMA的批准。尼洛替尼分别于2017年和2019年被列入世界卫生组织基本药物示范目录成人版和儿童版。根据2019年全球疾病负担研究,全球约有25万慢性髓细胞癌病例,其中20-25%对当前通用的一线治疗耐药,全球可以接受尼洛替尼治疗的患者人数估计为50300至63000人。尼洛替尼也是药品专利池2022年优先级列表中的药物。尼洛替尼的化合物专利将于2023年7月到期,但诺华还在一些国家申请了晶型、中间体和用途等专利,将持续到2026年至2030年到期。尼洛替尼的化合物专利在印度获得授权,但诺华撤回了其他专利的申请。因此,2023年7月之后,尼罗替尼在印度再无专利保护。2022年5月,诺华与药品专利池加入了“获取肿瘤药物联盟”(ATOM)。这是由国际抗癌联盟(UICC)及合作伙伴发起的一项新的全球倡议,旨在改善中低收入国家基本抗癌药物的可及性和可负担性。这个倡议的主要任务之一是对具有公共健康重要性的抗癌药专利许可提供便利,这项任务由作为ATOM观察员的药品专利池来实现。药品专利池签定的专利许可协议最受关注的就是许可范围,即经由专利许可在哪些国家可以生产和销售仿制药。这个协议覆盖两类国家:第一类是44个中低收入国家,在这些国家,尼洛替尼的化合物专利将于2023年7月到期;第二类是七个中等收入国家,分别是埃及、危地马拉、印度尼西亚、摩洛哥、巴基斯坦、菲律宾和突尼斯。诺华在这七个国家就尼洛替尼布局了化合物专利之外的其他专利,有效期还将持续若干年,某些专利还在申请中。这个许可范围的实际意义如何?协议覆盖的第一类44个国家由诺华遴选,与ATOM工作的目标国家范围一致。但按药品专利池专家咨询小组的分析,许可协议对这44个国家并无太大意义,因为尼洛替尼的化合物专利于2023年7月到期后,印度企业生产的仿制药便可在这些国家销售,完全可以绕过药品专利池,也不必遵循经由药品专利池许可生产的仿制药须经严格监管机构批准或世卫组织预认证的要求。也就是说,2023年7月后,这个协议真正覆盖的国家只有七个。根据数据统计,即便没有药品专利池的许可协议,2023年7月之后,仿制药企业可以在108个中低收入国家和22个高收入国家销售尼洛替尼仿制药(见下图),因为这个时间点后,尼洛替尼在这些国家都不受专利保护。而协议覆盖的七个国家需要尼洛替尼治疗的患者人数只有约900至1100人,实际受益人数相当有限。协议还约定按净销售额5%收取专利许可费,只针对在上述七个国家的销售。这笔许可费将投资用于ATOM实现其使命。药品专利池专家咨询小组对这个协议所覆盖的国家范围有不同观点。一种观点认为,在非传染性疾病领域,局限如此大的协议对未来类似抗癌药专利许可设定了非常低的门槛,实际影响却很有限。鉴于ATOM与制药行业紧密关联,ATOM的目标国家范围较小,药品专利池许可协议覆盖范围与之绑定会对以公共健康为导向的药品专利池的声誉带来风险。另一种观点认为,这个许可协议显示了药品专利池的许可模式对推动非传染性疾病治疗药物的可及性有积极作用。诺华及其他企业的其他抗癌药产品可以遵循。至于许可协议覆盖的国家范围,会随时间推移和企业逐渐熟悉药品专利池对抗肿瘤药物专利许可的实践而扩大。药品专利池在2010年建立之初,工作范围仅限于艾滋病、结核、疟疾危及全球公共健康的三大传染性疾病,现在开始尝试在非传染性疾病领域进行探索,这样的努力值得肯定。尽管抗癌药新技术取得了巨大突破和快速发展,但中低收入国家癌症患者的需求远远没有得到满足。2020年,中低收入国家新增癌症病例超过350万例,估计约230万人死于癌症。如果不加以控制,到2040年,中低收入国家死于癌症的人数预计将增至400万。许多中低收入国家没有足够的资源满足癌症患者的需求,获得良好的癌症治疗和护理所需的基本药物和诊断。但是否能够真正有效促进抗癌药在中低收入国家的可及性还有待观望。尼洛替尼于2009年在中国获批上市,治疗2岁以上儿童慢性髓细胞白血病、对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病(Ph+CML)慢性期或加速期成人患者及新诊断的费城染色体阳性的慢性髓细胞白血病(Ph+CML)成人患者。除了即将到期的化合物专利外,诺华在中国布局了若干盐、晶型和用途等专利,最晚授权的专利在中国到期时间为2030年11月。从“中国上市药品专利信息登记平台”专利声明部分检索到的信息,国内至少有两家企业申报了尼洛替尼仿制药。从专利声明的具体信息看,苏州特瑞药业有限公司的声明中做了4.1类声明,即被仿制相关药品相关专利权应当被宣告无效,说明有意拿下首仿。但如果最晚授权的专利不被宣告无效,尼洛替尼仿制药短期内可能无法上市。药品专利池的许可协议暂时无法让中国市场和中国患者受益,但不妨碍中国企业可以尝试通过药品专利池将抗癌药推向有需求的中低收入市场。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容