
2022-12-06 11:04:02来源:药智网/费翔浏览量:923
导读:6家药企布局一览。
我国脂肪肝患者约1.5亿,且在不断增加,NASH(非酒精性脂肪性肝炎)是脂肪肝中比较严重的类型。
据悉,有1.1亿轻度脂肪肝患者,可以通过饮食及锻炼好转,但是上千万中度重度NASH患者不能通过该方法恢复。且NASH需要终生用药,市场规模大。
预测在2030年内,NASH将超过乙肝,成为威胁人类健康的又一杀手。预计国际NASH的市场规模,在2025年能达到350-400亿美元。
不过,好消息是Madrigal公司最近披露,旨在治疗NASH的新药Resmetirom首个全球III期临床研究积极的试验数据,给NASH患者带来新希望的同时,也预示着NASH领域的新药开发即将迎来新一轮“黄金期”。
6家药企布局一览
雅创医药:FXR激动剂HPG-1860
雅创医药的HPG-1860,国内研发进度最快的FXR激动剂之一。具有高度选择性的非胆汁酸结构的FXR激动剂。
FXR通过调控胆汁酸合成相关的基因表达,成为胆汁酸稳态的关键控制器。研究表明NASH疾病进展中FXR的表达下调,且FXR在炎症调节中的作用已被广泛关注并研究。
HPG1860在临床前研究和早期临床试验中表现出卓越的FXR靶向激活特性和良好的安全性。不过,由于FXR激活剂主要改变脂肪代谢途径,有增加血脂的副作用,因此心血管疾病患者不宜使用,即使能成功上市后市场受限。
歌礼制药:FXR激动剂ASC40
歌礼制药发布公告称,其研发的FXR激动剂ASC42用于治疗原发性胆汁性胆管炎(PBC)的一项药物-药物相互作用(DDI)研究临床试验申请,已获得FDA批准,该研究将为后续在中国、美国和欧盟开展ASC42 III期临床试验提供更多支持。
不过,FXR激动剂在不同临床试验中,均出现剂量依赖的皮肤瘙痒和血脂异常,这些是FXR激活后的靶效应。
目前,面临的主要挑战是优化FXR激动剂的结构并确定最佳剂量,在减轻不良反应的同时,保持确定性的肝组织学改善和临床疗效,这是一个有待解决的两难选择。
广东众生药业:ZSP1601
该企业在NASH领域布局了6个产品,分别是ZSP1601、ZSP0678、ZSYM008及RCYM001、RAY001以RAY002布局了覆盖肝脂肪,炎症,纤维化等不同作用靶点,并且有联合用药潜力的产品管线。
其中,ZSP1601已完成Ib/IIa期临床试验,试验获得了积极结果,达到了主要终点,支持ZSP1601片继续开展IIb期临床试验,在国内研发进展位于第一梯队。
深圳君圣泰:HTD1801
其研发的新药全球同步开发,且已有2个品种进入到临床II期,并获得美国FDA的快速审评通道资格认定2项和孤儿药认定1项。
拓臻生物:FXR激动剂TERN101
主要针对NASH、肝纤维化、肝细胞癌等慢性肝脏疾病的全新疗法,去年成功登陆纳斯达克。
TERN-101正是来自于礼来的授权许可。与其他FXR激动剂相比,TERN-101具有更好的组织特异性,在肝脏分布高,最大限度减少肠道通路的激活,从而减少瘙痒和不良脂质变化等副作用,提高了药物的耐受性。
另外,还有SSAO抑制剂TERN-201、THR-β激动剂TERN-501、以及一款GLP-1R激动剂。
韩国LG-Chem VAP-1抑制剂LR20056
LG化学从国内药捷安康获得授权的LR20056,是一种新型、强效、选择性和不可逆的半衰期敏感胺氧化酶(SSAO,又称血管粘附蛋白-1(VAP-1))抑制剂,拟作为非酒精性脂肪性肝炎(NASH)的口服治疗药物,正在美国进行临床I期实验。
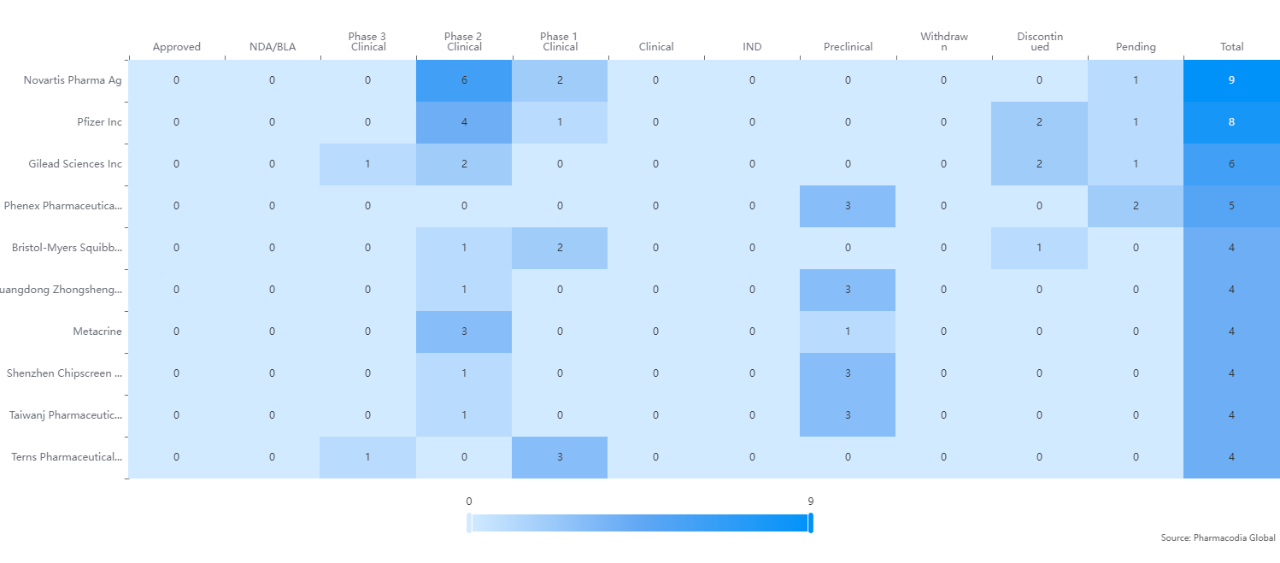
图1 NASH研发十大药企布局
图片来源:pharmacodia global数据库
NASH药物研发策略
目前,NASH靶向药物治疗策略主要可以分为四大类:
第一类,靶向改善胰岛素敏感性的代谢靶点,抑制参与新脂肪生成的不同酶,或改善线粒体对脂肪酸的利用;
第二类,靶向炎症或细胞损伤靶点,抑制炎症细胞的招募或阻断炎症信号传导,减少氧化和/或内质网压力,或抑制肝细胞凋亡;
第三类,调节胆汁酸肠道肝脏循环和信号,或改变肠道微生物群的肝肠轴靶标;
最后一类,直接针对肝星状细胞的抗纤维化目标,减少肝脏中胶原蛋白的沉积,减少肝纤维化。表1总结了具有代表性的五款药物。
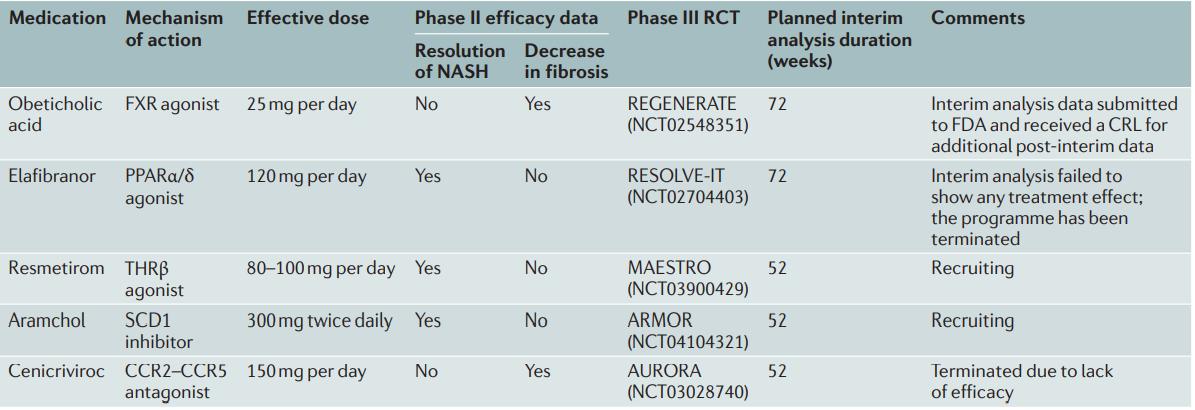
图2 NASH及纤维化通过临床II期以上的药物
图片来源:《自然》综述doi.org/10.1038/s41574-021-00507-z
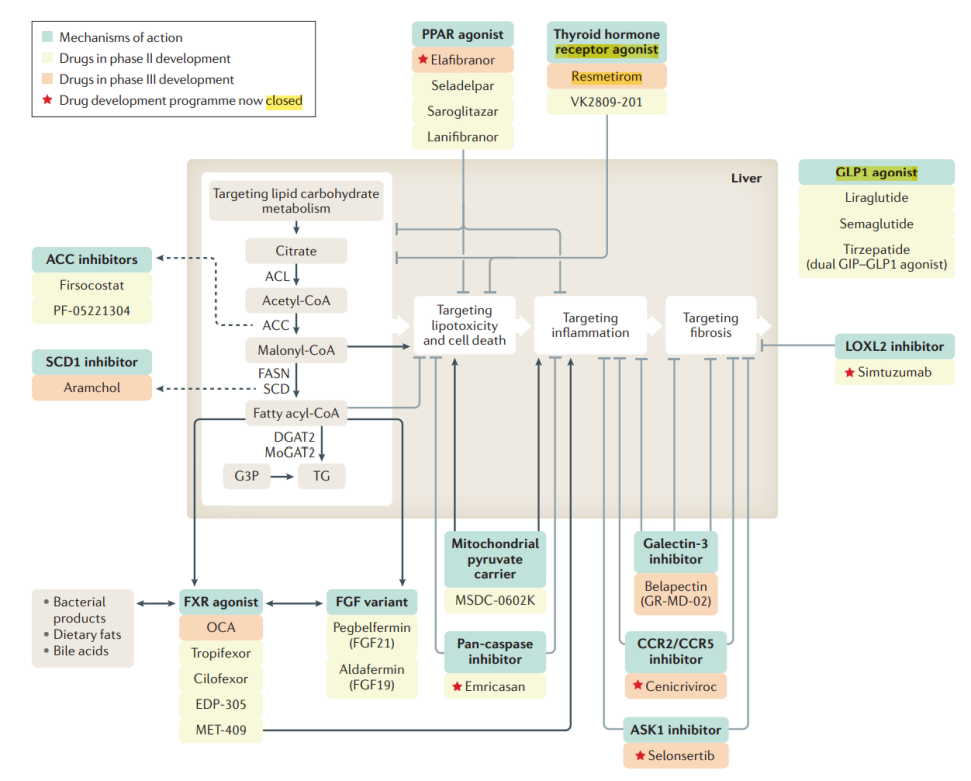
图3临床实验中的NASH代表药物及靶点一览
图片来源:Nature Reviews Gastroenterology&Hepatology,18(6),373-392.
靶向胆汁酸受体
研究发现,胆汁酸作为信号分子与受体结合,在NAFLD/NASH发生、进展和消退中起关键作用。2015年FLINT试验中期结果“奥贝胆酸(OCA)通过激活法尼醇X受体(FXR)可以降低NASH患者的NAFLD活动性评分(NAS)及纤维化“程度”引起业界关注。
FXR激动剂奥贝胆酸,虽然已在临床III期研究中达到FDA设定的临床终点。但其是否能够被批准上市,尚有很大的不确定性。
更重要的问题是:是否值得继续开发更好的FXR小分子激动剂?答案似乎是肯定的,但摆脱骚痒这样的副作用,也可能只是研究者的一厢情愿。
加上其它可能的肝毒性,这就限制药物能使用的剂量,其总体疗效就很有限。最近发布了两个FXR激动剂,EDP-305和MET409的临床II期数据,但瘙痒仍然是很大的问题。
2019年9月25日,Enanta Pharmaceuticals发布了另一个FXR激动剂,EDP-305的临床2a研究(ARGON-1)数据。该研究测试了两个剂量(1mg和2.5mg)的EDP-305,高剂量组的肝酶水平下降了28单位/升,而安慰剂组下降了15单位/升。结果刚刚超过有统计学意义的阈值,与OCA临床测试中减少28单位/升的指标一致。
接受高剂量EDP-305的患者肝脂肪(MRI-PDFF)在统计学上显著减少。45%受试者是MRI-PDF应答者,即取得≥30%的脂肪减少。EDP-305也表现出强大的靶标参与度,如C4的减少以及FGF-19和ALP的增加;也观察到了GGT的强力降低。
总体而言,EDP-305总体上是安全的,大多数与治疗相关的不良事件(TEAEs)是轻度至中度。最常见的(≥5%)包括瘙痒(pruritus),胃肠道(GI)相关症状(恶心,呕吐,腹泻),头痛和头晕。
迄今为止,在所有研究中,在400多个接受EDP-305的受试者中,都观察到了一致的安全性特征。至于EDP-305在这个为期12周的临床2a研究中的耐受性,则不令人乐观:
在2.5mg剂量组中,大约51%的受试者存在瘙痒,而在1mg手臂中,低于10%的受试者出现瘙痒;大多数瘙痒是轻度或中度。因瘙痒导致的停药率分别为1.8%(1 mg剂量组)和20.8%(2.5 mg剂量组)。在2.5mg剂量组中,所有停药都是由于中度瘙痒。
2020年8月27日,位于美国加州圣地亚哥的Metacrine,Inc.,发布了为期12周的随机,安慰剂控制的MET409临床1b研究最终的积极结果,MET409是该公司的非胆汁酸FXR激动剂,用于治疗NASH。
靶向PPARs
过氧化物酶体增殖物激活受体(PPAR),是核激素受体超家族的配体依赖性转录因子,包括PPARα、PPARγ和PPARβ/δ三种亚型。其中,PPAR-α的激活可降低甘油三酯水平并参与能量稳态的调节,而PPAR-β/δ的激活增强了脂肪酸代谢。
PPARγ激动剂吡格列酮可在改善胰岛素抵抗基础上促进脂肪重新分布,减轻肝脂肪变性、炎症和肝纤维化。
PPARα和PPARγ激动剂saroglitazar于2020年3月在印度获批上市,用于治疗非肝硬化NASH,是全球首个获批用于NASH治疗的药物,其既可减少肝内脂肪含量,降低肝酶水平,又可通过调节糖脂代谢降低心血管疾病危险因素,适用于合并他汀类药物不能控制的糖尿病和高脂血症的NASH患者。
近期,印度研究报告,saroglitazar(4mg/d)治疗9个月可降低NAFLD患者的血清总胆固醇和肝酶水平,改善肝脏硬度。临床研究显示,PPARα和PPARδ双重激动剂elafibranor和泛PPAR激动剂lanifibranor等均可降低NAFLD患者的血脂水平和改善肝脏组织病理学。
但这个靶点最近也是困难重重:苏州泽璟暂停“ZG0588非酒精性脂肪性肝炎适应症临床前研究、临床研究及药学研究”项目的原因中就强调:PPAR激动剂在治疗NASH的临床研究中疗效低于预期,如2020年5月,Genfit公司宣布其PPAR激动剂elafibranor治疗非酒精性脂肪肝(NASH)的III期临床研究未能达到预先设定的主要终点。
靶向肝脏特异性甲状腺受体(THRs)
甲状腺激素调节肝脏甘油三酯和胆固醇代谢的很多过程,甲状腺受体的两种亚型THRα和THRβ在大多数组织中都有表达,其中THRβ是在肝脏中表达的主要形式,选择性更高。
Resmetirom是目前在NASH适应症上研发进展最快的THRβ激动剂,今年1月底,上文提到的Madrigal Pharmaceuticals宣布药物在III期研究中达到了主要终点和关键的次要终点,患者肝脏脂肪和致动脉粥样硬化的脂质实现了“显著的、临床相关的”减少,且安全性良好。

图4 Resmetirom优化合成路径
图片来源:J.Med.Chem.2014,57,3912-3923
国内公司自主研发的产品中,进展最快的是拓臻生物的TERN-501。今年3月已经在美国启动了单药以及与FXR激动剂TERN-101联合用药的II期临床。
靶向GLP-1受体
胰高血糖素样肽-1(GLP-1)受体激动剂,属于肠促胰岛素类似物,已被广泛用于2型糖尿病的治疗。越来越多的证据发现,这类药物可改善NASH患者的肝脏脂肪含量。
司美格鲁肽用于320名NASH患者的II期多中心研究结果显示,在所有剂量组中均达到NASH消退和肝纤维化未恶化的主要终点。另外,GIP和GLP-1受体双重激动剂替尔泊肽的II期研究证实了药物使得NASH患者的ALT、K-18和Pro-C3标志物降低。
国内的先为达生物专注于研发慢性代谢性疾病的创新药物,有多款GLP-1受体激动剂产品在进行NASH适应症的研究。去年底,该公司将一款临床前长效GIP受体激动剂项目的全球开发和商业化权益授权给赛诺菲。
靶向ACC
GS-0976(firsocostat)是一款肝乙酰辅酶A羧化酶(ACC)直接抑制剂,吉利德引自Nimus。另一在研的此类药物是辉瑞公司的ACC1/2双重抑制剂PF-05221304(clesacostat)。
这两个药物均在包括中国在内的多个国家开展治疗NASH的II期研究,初步研究显示了积极结果,但都发现甘油三酯升高这一主要的不良事件。
联合用药探索
NASH发病机制复杂,单一药物的临床研究有些未能显示出显著的组织学改善,且高剂量应用时会出现耐受性问题。因此,目前也有不少联合用药的研究正在开展,以提高疗效,减轻潜在的耐受性问题,并提高依从性。
吉利德开展了非甾体FXR激动剂cilofexor(GS-9674)和ACC抑制剂firsocostat(GS-0976)联用的II期研究。早期研究显示,联合用药可以降低患者的肝脂肪,但是对于有严重肝纤维化(F3-F4期)的患者,未达到改善纤维化的主要终点。不过,研究达到了多项次要终点,包括NAS积分的改善。
吉利德于去年下半年和诺和诺德合作,启动了诺和诺德GLP-1受体激动剂semaglutide与cilofexor和firsocostat固定剂量复方三药联合的IIb研究。
此外,辉瑞和诺华也在包括中国在内的多个国家开展了两药联合治疗NASH的II期研究。辉瑞的组合为ACC抑制剂PF-05221304联合DGAT2抑制剂PF-06865571(ervogastat),诺华为FXR激动剂tropifexor联合SGLT1/2抑制剂LIK066(licogliflozin)。不过,鉴于诺华已经终止了两项tropifexor的研究,该联合研究也面临终止风险。
小结
对于新药开发来说,虽然NASH市场巨大,但也是一个深不见底的黑洞:已有多款药物研发失败,且这个名单还在不断增加中,很多药物都是在进入晚期临床研究后宣告失败。
道阻且长,行则将至;行而不辍,未来可期!期待国内外创新药企,在NASH领域的快速崛起。
参考资料:
1、自然子刊综述:Therapeutic pipeline in nonalcoholic steatohepatitis
https://www.nature.com/articles/s41575-020-00408-y
2、Madrigal公司resmetirom介绍 https://www.madrigalpharma.com/our-programs/resmetirom/
Targeting progression of liver damage in NASH(astrazeneca.com)
3、NASH在研新药分析 http://www.phirda.com/artilce_28446.html?cId=1
4、非酒精性脂肪性肝病的药物治疗进展
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2022.07.033?viewType=HTML
5、歌礼医药NASH管线 https://www.gannexpharma.com/portal/list/index/id/9.html
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容