
2022-12-06 11:12:57来源:医药魔方浏览量:513
2022年12月10日~13日,第64届美国血液学协会(ASH)年会将在美国新奥尔良举办,届时全球各大药企将携多款产品的临床试验数据亮相其中。截至目前,国内已有多家药企公布了即将展示的产品最新临床数据。本文在此汇总国内部分公司较为亮眼的数据,供大家参考。
适应症:R/R CLL/SLL
APG-2575是全球第2个、国内首个进入关键注册性临床阶段且具有明确疗效的Bcl-2选择性抑制剂,亚盛医药也在积极探索APG-2575在多个适应症中的治疗潜力。
本次大会,亚盛医药首次公布了APG-2575联合BTK抑制剂acalabrutinib或利妥昔单抗治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞白血病(R/R CLL/SLL)患者的初步数据。结果显示:APG-2575联合acalabrutinib治疗R/R CLL/SLL的客观缓解率(ORR)达98%;APG-2575联合利妥昔单抗治疗的ORR达87%,展现了极高的有效率和安全性。
据公开消息,APG-2575单药治疗R/R CLL/SLL的Ib/II期研究结果显示,中位治疗7个周期里,29/34可评估患者达到完全缓解(CR)或部分缓解(PR),ORR为67.4%,最终确定II期推荐剂量为600mg。
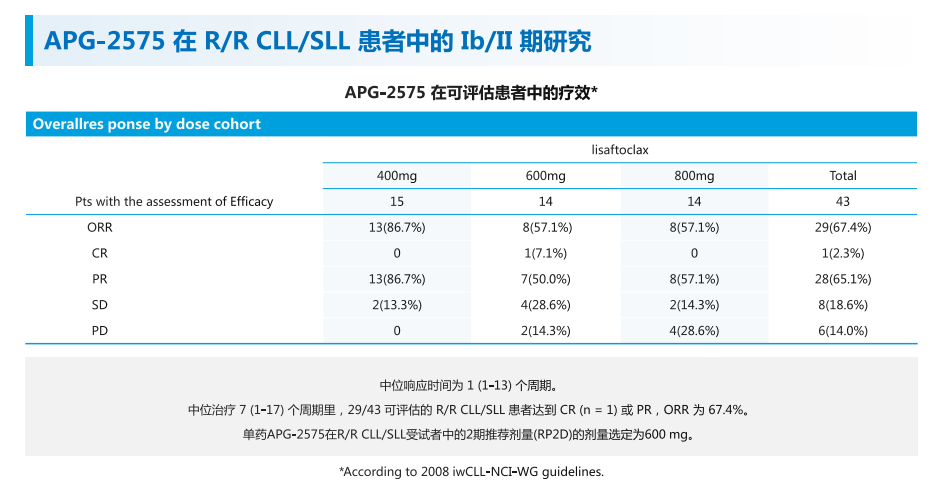
来源:亚盛医药官网
由此可见,无论是单药治疗,还是联合用药,APG-2575都展现了优秀的疗效和出色的安全性。
适应症:R/R B-NHL
BRL-201是全球首个靶向CD19非病毒PD1定点整合CAR-T细胞疗法,可在不使用病毒载体的情况下一步制备获得,适应症为复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL),目前处于早期研发阶段。
在12个月的中位观察期内,8例R/R B-NHL患者的完全缓解率(CR)为87.5%,在最后一次随访时,有5例患者表现出持久反应,6个月时有2例患者出现疾病复发,客观缓解率为100%。
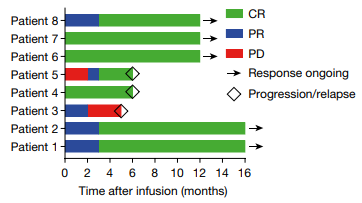
来源:Nature
邦耀生物表示,首例接受治疗的患者无癌生存期最长已超过2年,目前仍处于完全缓解状态中。
适应症:NDMM
GC012F是一款双靶点自体CAR-T疗法,同时靶向BCMA和CD19,目前开展的适应症包括复发/难治性多发性骨髓瘤(RRMM)、多发性骨髓瘤高危初诊患者(NDMM)、复发/难治性B细胞非霍奇金淋巴癌(r/r B-NHL)。
本次ASH年会公布的是GC012F治疗NDMM的由研究者发起的临床试验(IIT)初步数据。在中位随访时间为5.3个月(2.3~12.5个月),13例疗效可评估患者的总体应答率高达100%,69%的患者取得了严格意义上的完全缓解(sCR),所有患者均达到微小残留病灶(MRD)阴性。
本次临床数据也初步显示了优异的安全性:仅23%(3/13)的患者发生了1~2级细胞因子释放综合征(CRS);未出现3级及以上的CRS,且并未观察到任何级别的免疫效应细胞相关神经毒性(ICANS)发生。
适应症:慢性移植物抗宿主病
TQ05105是一款新型口服JAK1/2和ROCK1/2双重抑制剂,适应症为慢性移植物抗宿主病(cGVHD)。除此之外,该产品用于骨髓纤维化的临床研究也进入II期阶段。
Ib/II期研究共纳入22例患者,分别接受TQ05105片 10mg(每日2次,n=7)、15mg(每日2次,n=15)。初步结果显示,10mg组的最佳总体疗效(BOR)为100%,15mg组的BOR为73.3%。
适应症:慢性移植物抗宿主病
SHR0302(艾玛昔替尼)是首个国内自主研发的新一代JAK1抑制剂,目前已开展了包括类风湿性关节炎、溃疡性结肠炎、特异性皮炎、斑秃、银屑病关节炎等多项适应症。今年11月,艾玛昔替尼片治疗特应性皮炎的III期临床研究也获得成功,成为首个在自免领域获得关键III期研究成功的国内自研JAK1抑制剂。
本次ASH大会公布的是艾玛昔替尼联合泼尼松一线治疗Allo-HSCT后慢性移植物抗宿主病的I期研究数据。该研究共纳入18例患者,首次给药后,第四周ORR已达到94.4%,4例患者(22.2%)达到完全缓解,13例患者(72.2%)部分缓解。
适应症:T细胞血液肿瘤
RD13-01是一款靶向CD7的通用型CAR-T细胞疗法,适应症为T细胞血液肿瘤。今年9月,北恒生物联合浙大一院在《Cell Research》上发表了最新的临床结果。
I期临床研究结果显示,在11例可评估患者中,ORR达到82%;其中8例白血病患者中,6例(75%)达到了微小残留病灶阴性的完全缓解/血细胞数量未完全恢复的完全缓解(MRD-CR/CRi)。
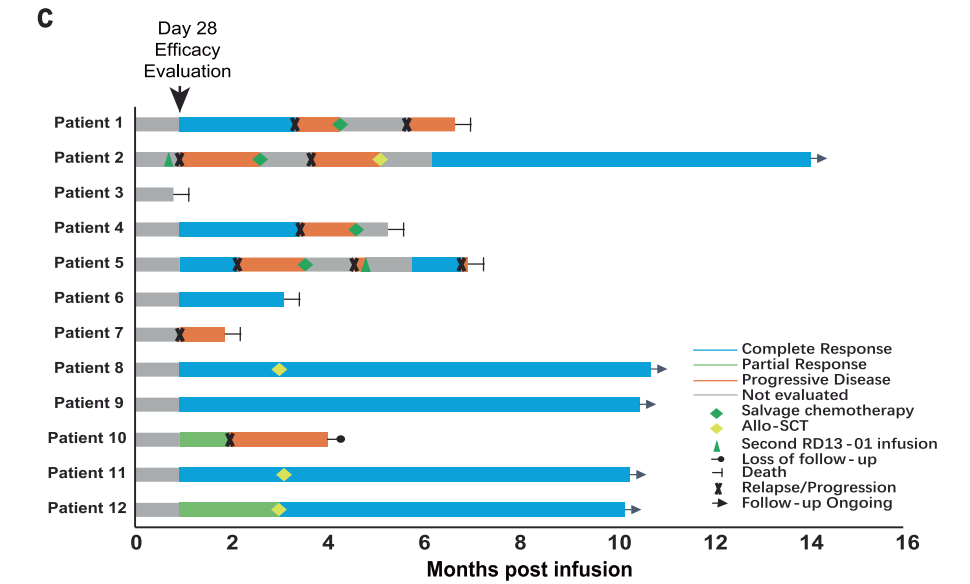
来源:Cell Research
此外,该产品安全性及耐受性良好,无剂量限制性毒性(DLT)、移植物抗宿主病(GvHD)及≥3级的CRS事件发生。
适应症:复发/难治性急性T细胞淋巴细胞白血病
NS7CAR是一款患者或供者来源的,无需额外进行CD7基因编辑或蛋白质表达阻断的“自然选择”CD7 CAR-T细胞疗法产品。
在首次人体I期试验中,20例患有复发/难治性急性T细胞淋巴细胞白血病(n=14)和T淋巴母细胞淋巴瘤(n=6)接受NS7CAR治疗。第28天时,19例患者骨髓微小残留病阴性完全缓解;9例有髓外病灶的患者中,5例实现髓外CR。
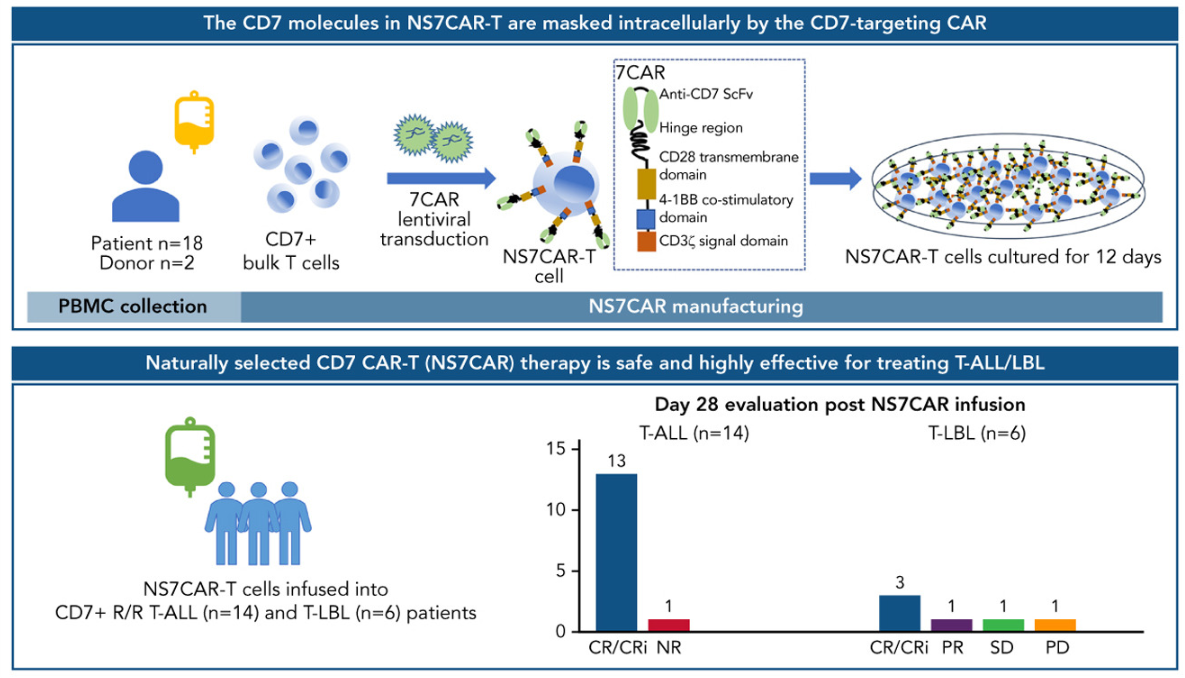
来源:Blood
NS7CAR回输后中位随访时间为142.5(32~311)天,14例患者在回输后接受异基因造血干细胞移植,至研究截止时未复发。在未接受移植的6例患者中,4例在54(32~180)天的中位时间保持CR。18例患者出现轻度细胞因子释放综合征(≤2级CRS),仅1名患者出现3级CRS,2例患者出现1级神经毒性。
适应症:高危MDS
Letaplimab是一款差异化的CD47单抗,目前已开展治疗骨髓增生异常综合征(1L MDS)和急性髓性白血病(AML)等多项临床试验。本次会议报告了IBI188联合AZA一线治疗新诊断的高危MDS患者的Ib期研究最新数据。
结果显示,在随访时间≥6个月的45例可评估患者中,37例患者(82.2%)实现客观缓解,其中14例患者(31.1%)达到完全缓解,16例患者(35.6%)获得骨髓CR。中位反应持续时间为12个月。
以上8款产品基本处于早期研发阶段,其中一半都是CAR-T细胞疗法,竞争激烈程度可见一斑,每款产品也都尽显差异化创新,结果也较为喜人,期待后续临床研究继续展现傲人成绩,尽快惠及更多患者。
[3] https://doi.org/10.1038/s41422-022-00721-y
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容