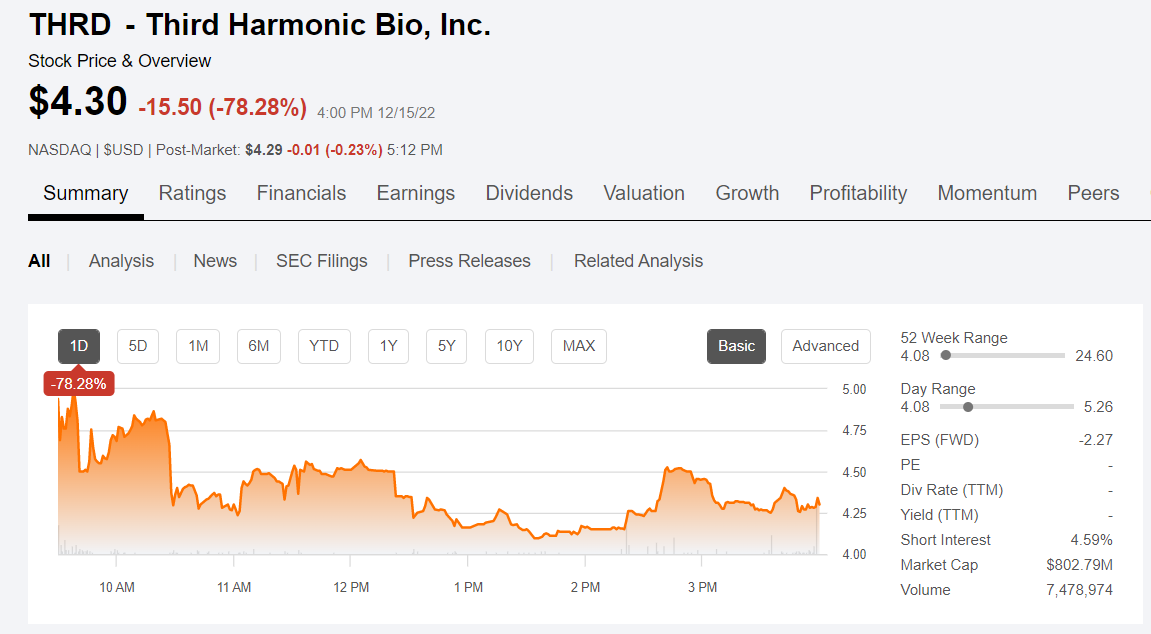
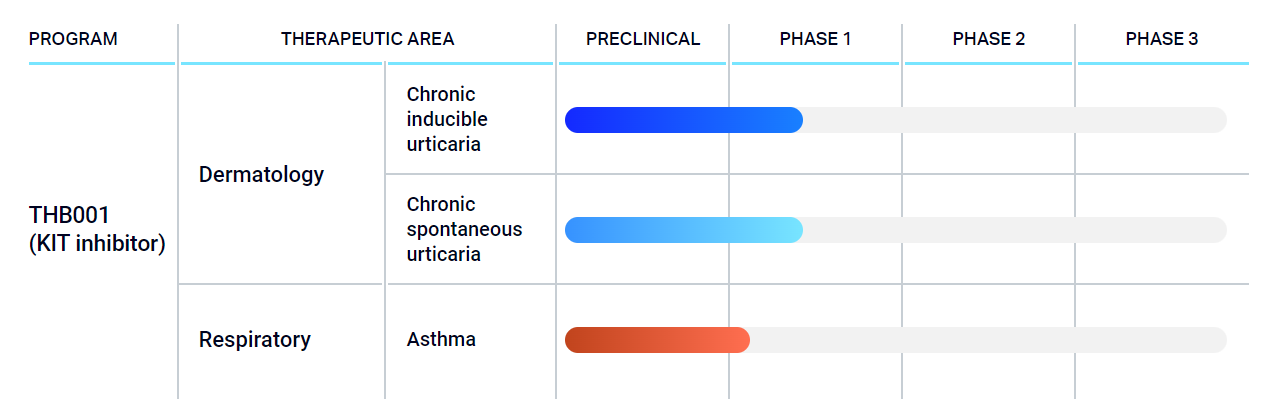
12月15日,Third Harmonic Bio宣布,决定终止其在研候选药物THB001的Ib期研究,原因为在剂量一队列(200mg,每日2次)中观察到两例患者在接受治疗后出现无症状的肝转氨酶炎。目前已入组的所有患者均已停药,且该研究不会再招募患者,但随访将按照方案继续进行。受此消息影响,Third Harmonic Bio股价大跌78%。THB001是Third Harmonic Bio自主研发的一款肥大细胞/干细胞生长因子受体(SCFR/c-Kit)抑制剂。早期临床研究表明,Kit抑制有可能变革各种肥大细胞介导的炎症性疾病的治疗手段,并且可滴定的口服细胞内小分子抑制剂可能是针对该靶点的最佳治疗方案。值得一提的是,THB001是该公司管线中的唯一一款产品。该Ib期研究是一项多中心、开放标签、非随机的临床试验,预计纳入30例患者,旨在评估3种剂量的THB001在慢性诱导性荨麻疹成年患者中的安全性、耐受性、疗效和药代动力学性质。5例患者被纳入剂量一队列(200mg,每日2次)。第1例患者完成了完整的12周给药期,没有出现肝毒性的体征或症状。第2例和第3例患者在随访第8周出现丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)升高,这两例患者现已停止用药。此外,实验室参数和诊断参数均表明,没有患者的肝功能受到影响,且上述两例患者均无临床症状。疗效方面,初步分析结果显示,200mg BID的THB001具备药效学和临床活性。Third Harmonic Bio表示,目前尚未确定转氨炎的其他病因,并将继续密切监测患者的状况。此外,Third Harmonic Bio正在启动非临床研究,以阐明观察到的转氨酶升高的机制。同时,该公司计划进行广泛的药物化学工作,以开发新的下一代口服野生型Kit抑制剂,并将多个候选分子推进到探索性毒理学研究中。公司计划在2023年从该计划中提名一款开发候选药物。Third Harmonic Bio首席执行官Natalie Holles说:“我们将患者安全作为我们进行临床研究的重中之重,因此决定终止THB001的Ib期研究。虽然这是一个非常令人失望的结果,但我们很高兴看到该起始剂量的临床活性的初步迹象,并对选择性口服野生型KIT抑制剂成为治疗肥大细胞驱动的炎症性疾病的重要疗法的潜力持乐观态度。我们早先决定投资下一代药物化学,这使我们能够保持我们在口服野生型KIT抑制方面的领导地位,预计明年将提名新的开发候选药物。”
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容