
2023-01-28 11:29:39来源:药智网浏览量:688
导读:从失败中寻求新希望。
新药研发九死一生,任何一个阶段都可能面临失败的风险。药物闯过临床试验进入监管审评审批阶段后若不能顺利获批上市,这将意味着巨额的资金投入和时间打水漂。
新药的获批固然会引发高度欣喜关注,但那些未能一次成功的药物也值得关注,它们虽然失败了,但却会给后继者带来新的启发。
据不完全统计,2022年FDA共批准37款新药,但至少也拒绝批准了19款药物,详见下表。拒批药物涉及5款罕见病药物(Somatrogon、bardoxolone、Oleogel-S10、NurOwn和帕罗伐汀),而这些药物拒批的原因无外乎生产制造问题、安全性和有效性需要更多的临床试验数据来验证。
2022年FDA拒绝批准的药物
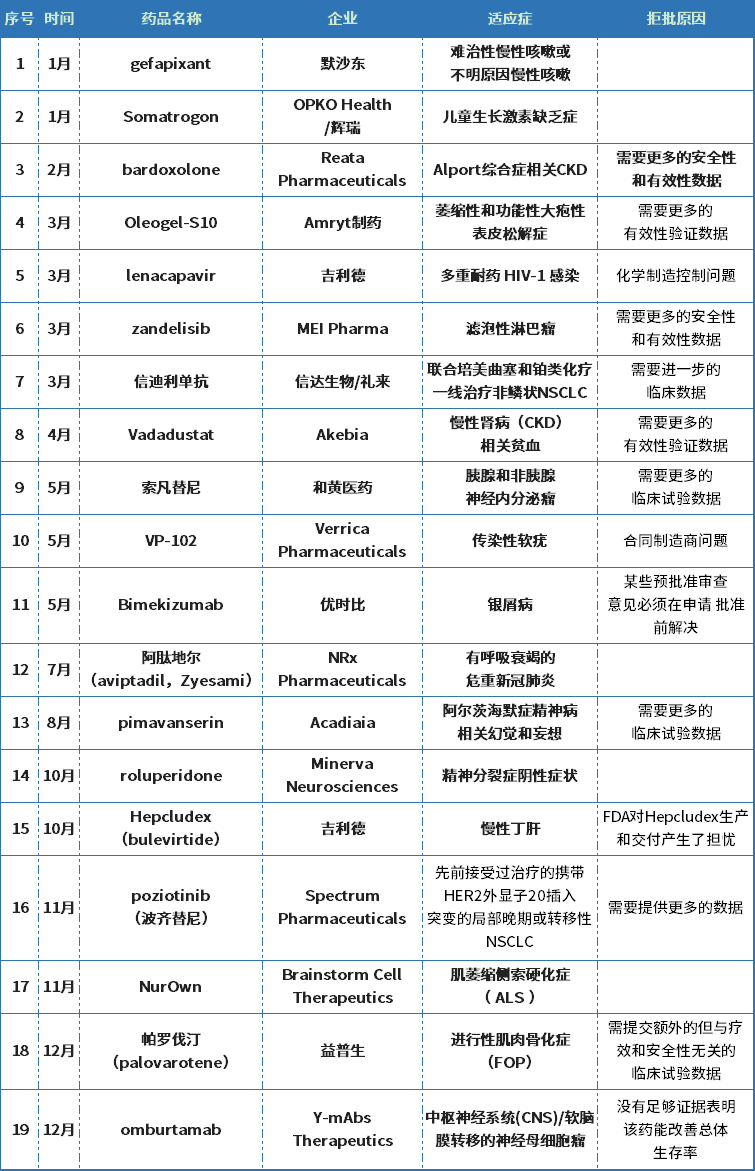
资料来源:公开资料(不完全统计)
值得一提的是,2022年拒批的zandelisib、Vadadustat对同靶点药物的开发影响深远。近年来PI3K抑制剂、HIF-PH抑制剂的开发并不顺利,这两类药物因安全性多款产品进展不顺。
2022年拒批的19款药物中有两款国产创新药,即信迪利单抗和索凡替尼,而这两款药物均已在国内获批上市。
此外,FDA拒批的部分药物却在欧洲或其他医药市场获批,如gefapixant在日本获批,Somatrogon在日本和欧洲获批,Oleogel-S10在欧洲获批......
1.Gefapixant
gefapixant是一种口服、选择性P2X3受体拮抗剂,通过作用于存在气道迷走神经C纤维上的P2X3受体抑制细胞外ATP信号,并减少感觉神经激活和咳嗽。
2022年1月在日本被批准用于治疗成人难治性慢性咳嗽(RCC)或不明原因慢性咳嗽(UCC)。然而,该药在美国的NDA却遭到FDA拒绝,FDA在CRL中表示拒绝gefapixant与药物的安全性风险无关。
2.somatrogon
somatrogon是一种每周给药一次的长效重组人生长激素,被开发用于治疗儿童生长激素缺乏症(GHD)。2022年1月,FDA针对somatrogon的BLA发布一封完整回应函(CRL)。
不过,somatrogon却在日本和欧盟被批准用于治疗因生长激素分泌不足而出现生长障碍的3岁及以上儿童和青少年GHD患者。
3.bardoxolone
bardoxolone是一款每日一次的口服Nrf2激活剂。Nrf2作为一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎信号等多个分子通路,促进炎症的消退。
2021年4月,FDA受理bardoxolone治疗Alport综合症相关CKD的NDA,2022年FDA拒绝批准该NDA,理由是与专家委员会的观点一致,不相信已有数据可以证明bardoxolone在Alport综合症相关CKD领域的安全性和有效性,并要求ReataPharmaceuticals提供更多数据来证明。
4.Oleogel-S10
Oleogel-S10用含有桦树树皮(桦木皮层)的干提取物,一种提供桦木脑和相关三萜化合物的天然物质,与葵花籽油一起制成油凝胶,用于局部给药。该药通过刺激角质形成细胞迁移和促进分化为成熟的上皮皮肤细胞来加速伤口愈合。
2022年2月,Amryt制药宣布收到FDA针对Oleogel-S10治疗萎缩性和功能性大疱性表皮松解症(EB)皮肤症状NDA发布的CRL。FDA要求Amryt提交更多的验证性证据,证明Oleogel-S10对EB治疗的有效性。
5.Lenacapavir
Lenacapavir是一种衣壳抑制剂,主要通过干扰病毒生命周期的多个重要步骤来抑制HIV-1复制,涉及衣壳介导的HIV-1前病毒DNA的摄取、病毒组装和释放以及衣壳核心的形成。
2022年3月,FDA针对lenacapavir上市申请发布了一封CRL。FDA在CRL中指出化学制造控制(CMC)问题,这些问题与lenacapavir注射液与拟用玻璃小瓶的相容性有关。
不过去年12月,FDA批准了该药,用于治疗目前抗逆转录病毒治疗方案失败的经过严重预处理的HIV-1患者,成为目前全球唯一一款获批上市的每年给药2次的HIV治疗药物。
6.zandelisib
zandelisib是一款口服磷脂酰肌醇3-激酶(PI3K)δ抑制剂。2022年3月,MEIPharma宣布FDA拒绝批准zandelisib上市,用于治疗复发或难治性滤泡性淋巴瘤。
FDA表示需要一项随机试验来充分评估PI3K抑制剂候选药物(包括zandelisib)的药物疗效和安全性。
基于这一观点,FDA不鼓励根据第2阶段TIDAL研究数据提交申请,并强调公司将继续按计划进行正在进行的、随机的第3阶段COASTAL研究。
7.信迪利单抗
信迪利单抗是信达生物开发的一款PD-1单抗,目前已在国内获批多项适应症。
2022年2月,FDA就信迪利单抗(Sintilimab)ORIENT-11试验是否适用于美国召开ODAC会议,最终委员会以14票赞成,1票反对的投票结果要求信达/礼来提供额外数据证明其PD-1单抗在美国人群中的实用性。
2022年3月,信达生物宣布FDA拒绝批准信迪利单抗联合培美曲塞和铂类化疗用于非鳞状NSCLC患者一线治疗。FDA在回复函中建议信迪例单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。
8.Vadadustat
vadadustat是一款口服低氧诱导因子氨酰羟化酶(HIF-PH)抑制剂,用于成人患者治疗慢性肾脏病(CKD)相关贫血。
2022年3月,Akebia宣布收到FDA关于vadadustat新药申请(NDA)的完整回复函(CRL)。FDA表示NDA中的数据不支持vadadustat对透析和非透析患者有利的获益-风险评估。且FDA还表达了安全性担忧,指出该药物在非透析患者人群中未达到MACE(主要心血管不良事件)的非劣效性,并增加了透析患者中血管通路血栓形成导致血栓栓塞事件风险,并且药物性肝损伤风险增加。
9.索凡替尼
索凡替尼是一款口服酪氨酸激酶抑制剂,2020年12月在国内被批准用于治疗晚期非胰腺神经内分泌瘤,2021年6月又被批准用于治疗晚期胰腺神经内分泌瘤。
2022年4月,和黄医药宣布收到FDA的完整回复函,FDA认为当前基于两项成功的中国III期研究以及一项美国桥接研究的数据包尚不足以支持药品现时于美国获批,需要纳入更多代表美国患者人群的国际多中心临床试验(MRCT)来支持该药在美国获批。
10.VP-102
VP-102是一种专有的药物-设备组合产品,通过外用涂抹给药,用于治疗传染性软疣,其活性药物成分斑蝥素是昆虫纲动物大斑蝥的有效成分,是一种天然存在的皮肤发泡剂,可导致桥粒斑的降解,桥粒为上皮细胞特有的一种细胞间粘着结构,发挥细胞与细胞间连接作用。
2022年5月,FDA拒绝批准VP-102,原因是生产该药品的合同制造商SterlingPharmaceuticalsServices在一次常规复查中发现了缺陷,这导致了官方行动指示(OAI)状态。
11.Bimekizumab
Bimekizumab是一款IL-17A/IL-17F抑制剂,2021年8月被欧盟批准用于治疗适合系统治疗的中度至重度斑块型银屑病成人患者。
2022年5月,FDA拒绝Bimekizumab。CRL中指出“某些预批准审查意见必须在申请批准前解决”。
12.阿肽地尔
阿肽地尔是一种具有生物活性且含量丰富的人体内源性肽,可以作为特定跨膜G蛋白偶联受体(VPAC1、VPAC2和PACAP-R1)的配体,是神经内分泌免疫网络的信号分子之一,具有抗增殖、抗炎和免疫调节的特性。在呼吸窘迫,急性肺损伤和炎症等多种动物模型中,阿肽地尔显示出强大的抗细胞因子的活性。
2022年7月,NRxPharmaceuticals宣布FDA拒绝授予阿肽地尔(aviptadil、Zyesami)治疗有呼吸衰竭直接死亡风险危重新冠肺炎患者的紧急使用授权(EUA)。
值得一提的是,这是阿肽地尔的第二次EUA被FDA拒绝,2021年11月FDA以缺乏有效性和安全性数据为由拒绝了该请求。
13.Pimavanserin
pimavanserin是一种选择性5-羟色胺(5-HT)反向激动剂和拮抗剂,优先靶向5-HT2A受体,2016年4月被FDA批准治疗与帕金森病精神病(PDP)相关的幻觉和妄想。
2022年8月,Acadiaia宣布FDA就pimavanserin治疗与阿尔茨海默症精神病相关幻觉和妄想的补充新药上市申请(sNDA)发出完整回复函(CRL)。
CRL内容表明,FDA认为当前基于Study019和Study045试验的数据不足以支持pimavanserin在美国获批,并建议Acadiaia增加针对ADP的额外试验。
FDA表示,Study019研究在主要终点达到了具有统计学意义的显著治疗效果,但他们认为该研究结果的可解释性存在局限性。
此外,FDA表示,在Study045试验中,pimavanserin对痴呆症相关精神病(DRP)的积极治疗效果同样不可信,因为50%的PDP患者都患有痴呆症,而该研究中的PDP痴呆症亚组的治疗效果也非常积极。
14.Roluperidone
Roluperidone是一款5-HT2A受体和σ2受体拮抗剂,最初由MitsubishiTanabe公司开发。
2007年8月,MinervaNeurosciences与MitsubishiTanabe达成许可协议,获得roluperidone在除中国、日本、印度和韩国等亚洲国家以外地区的独家开发和商业化权益。
2022年10月,MinervaNeurosciences宣布收到FDA就roluperidone治疗精神分裂症阴性症状的NDA发出的CRL。FDA表示Minerva可以进行typeA会议讨论CRL的内容。
15.Hepcludex
Hepcludex是HDV的同类首创疗法,通过结合NTCP受体来阻止病毒进入肝脏细胞,2020年7月被欧洲药品管理局(EMA)有条件批准用于治疗代偿期慢性HDV感染的成人患者。
2022年10月,吉利德在发布2022年第三季度财报中披露收到一封来自FDA的CRL,并透露是因为FDA对Hepcludex(bulevirtide)生产和交付产生了担忧。
16.Poziotinib
Poziotinib是一款HER2外显子20插入突变的酪氨酸激酶抑制剂(TKI),由韩国韩美药品研发。由于独特结构,Poziotinib在临床前实验中显示能够与携带外显子20插入突变的HER2受体不可逆结合,抑制它的功能和激酶活性,从而抑制癌细胞增殖,导致癌细胞死亡。
2022年9月,FDA肿瘤药物咨询委员会(ODAC)以9票对4票投票认为poziotinib目前的益处并未超过其风险。FDA表示,波齐替尼的问题在于第一、ORR低,DOR短;第二、推荐剂量的安全性较差;第三、剂量优化不足,确证性临床试验尚未招募患者。
2022年11月,SpectrumPharmaceuticals宣布收到FDA就poziotinib(波齐替尼)的新药申请(NDA)发出的完整回复函(CRL)。CRL要求,Spectrum需要提供更多的数据,包括随机对照临床研究,方能获得该适应症的批准。
17.NurOwn
NurOwn是Brainstorm开发的创新性自体细胞疗法,采用骨髓来源的间充质干细胞,在体外进行扩增和分化,并在专利条件下培养诱导这些细胞分泌高水平的神经营养因子,从而变成MSC-NTF细胞。
自体MSC-NTF细胞可以有效地将多种神经营养因子和免疫调节细胞因子直接递送到损伤部位,这些因子对减缓或稳定疾病进展有重要作用。2020年11月,BrainstormCellTherapeutics宣布FDA拒批NurOwn治疗肌ALS。
18.帕罗伐汀
帕罗伐汀是Clementia(罗氏子公司)开发的一种可口服的选择性视黄酸受体γ(RARγ)激动剂,通过作用于骨形态发生蛋白(BMP)I型受体ACVR1/ALK2(ACVR1/ALK2突变是FOP的致病机制),抑制其下游通路异常激活,从而起到抑制HO的作用。
2019年4月,益普生以13.1亿美元收购Clementia,获得了帕罗伐汀的全球权益。2022年12月,益普生宣布收到FDA就帕罗伐汀治疗进行性肌肉骨化症(FOP)的新药申请(NDA)发出的完整回复函(CRL)。FDA在CRL中要求益普生提交额外的但与疗效和安全性无关的临床试验数据。
19.Omburtamab
Omburtamab是一种放射性核素碘131标记的靶向B7-H3单克隆抗体,靶向神经母细胞瘤等多种实体肿瘤中表达B7-H3的细胞,并结合到B7-H3分子上的生物功能的关键区域——FG环依赖型构象。
2022年12月,Y-mAbsTherapeutics收到FDA就omburtamab治疗中枢神经系统/神经母细胞瘤的软脑膜转移BLA发布的CRL。
此前召开的ODAC会议,审评专家以16Vs0的投票结果表示,尚未有足够证据表明omburtamab能改善总体生存率。FDA建议Y-mAbs公司与FDA会面,充分探讨控制良好的试验设计,以提供有效性和风险获益的实质证据。
总结
FDA一次的拒批并不代表这些药物的研发不成功,其中部分药物还是有成为重磅药物的可能性,例如Evaluate预测bardoxolone销售额在2024年将达到11.2亿美元,优时比Bimekizumab2026年销售额有望达到16.3亿美元。期待未来这些药物可以最终获得FDA监管批准,带来更多可能。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容