
2020-08-13 22:43:04来源:药方舟浏览量:561
看点
7月药审中心受理总量为815个(不计复审)。
7月34个化药1类新药品种获CDE受理。
7月新增95个按仿制药质量和疗效一致性评价品种申报的受理号。
根据药智数据最新统计,2020年7月份CDE共承办新的药品注册申请以受理号计有815个(复审除外,下同)。
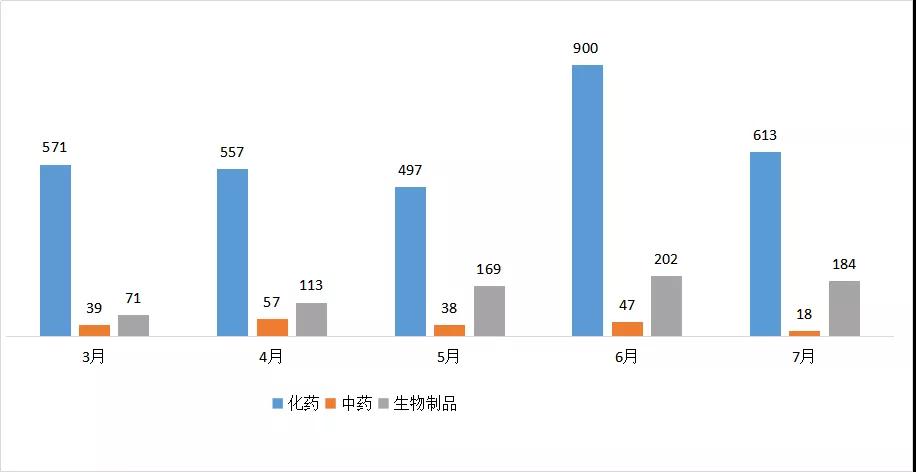
图一 2020年3-7月CDE药品受理情况
7月相比6月份减少334个受理号,其中化药减少287个受理号。以下且看化药、中药、生物制品的注册受理及审评情况分析。
一、化药审评情况
7月份CDE共承办新的化药注册申请以受理号计有613个。
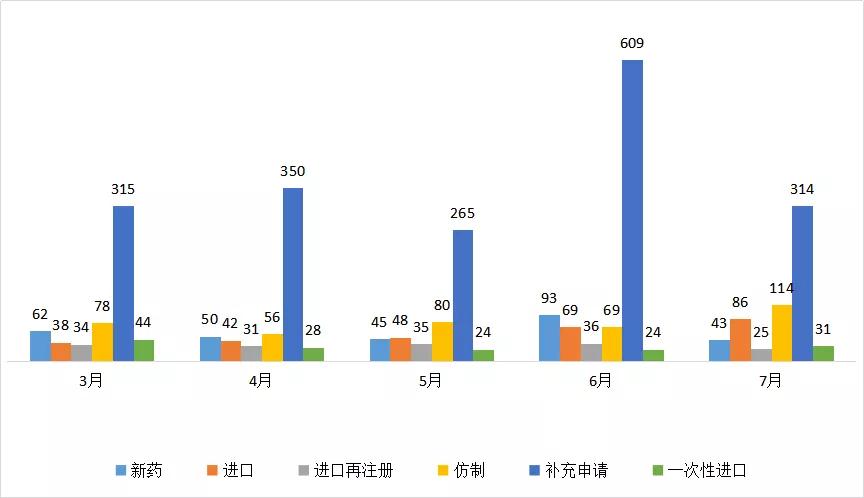
图二 2020年3-7月CDE化药各申请类型受理情况
从化药的申报来看,7月的承办数据相比6月,新药、仿制与补充申请都有明显下降,其中补充申请减少295个。
1.化药1类国产申报情况
7月CDE受理化药国产1类新药共计31个受理号,涉及15个品种11家企业。下表为7月新承办的1类国产新药。
表一 2020年7月新承办的化药1类国产新药
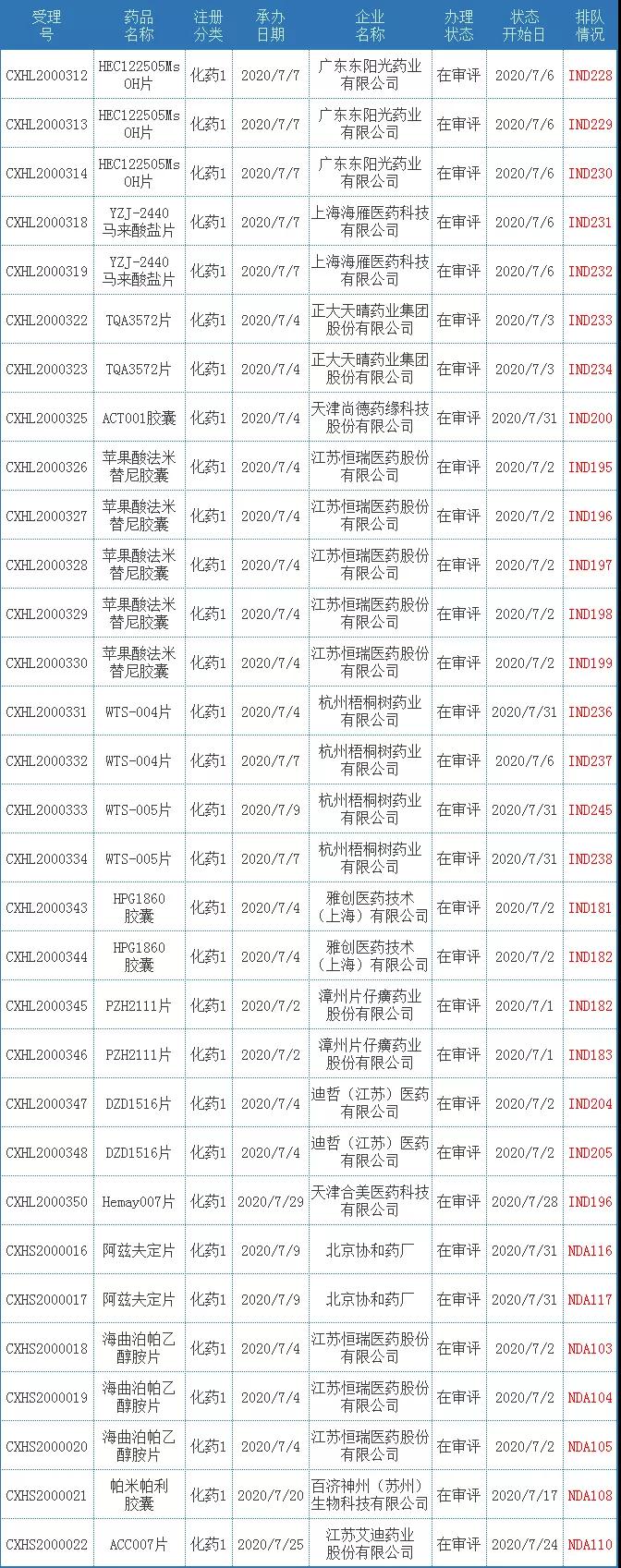
注:排队序号截止至2020年8月3日。
ACT001胶囊
ACT001是由天津尚德药缘科技和南开大学联合研发的一种靶向STAT3和NF-κB的乌心石内酯(micheliolide)衍生物,是一种抗肿瘤药物。
苹果酸法米替尼胶囊
苹果酸法米替尼胶囊是恒瑞医药自主研发的小分子多靶点酪氨酸激酶抑制剂,对多种受体酪氨酸激酶如c-Kit、KDR、PDGFR、VEGFR3、Flt1、Flt3、c-Src、FGFR2、FGFR3和PDGFRα等有很好的抑制活性。目前,该药品正在开展晚期实体肿瘤、鼻咽癌、胃肠道间质瘤、神经内分泌瘤、特发性纤维化、结直肠癌等多个适应症的不同阶段临床研究。
HPG1860胶囊
HPG1860是雅创医药原创NASH新药,它是非胆汁酸结构,高效,高度选择性的完全法尼醇X受体(FXR)激动剂,具有治疗非酒精性脂肪性肝炎(NASH),原发性胆汁性肝硬化(PBC)及原发性硬化性胆管炎(PSC)的潜力。
PZH2111片
PZH2111片是片仔癀具有自主知识产权的化学药品1类创新药,该药品主要用于治疗尿路上皮细胞癌、肝内胆管细胞癌等晚期实体肿瘤。
阿兹夫定片
阿兹夫定(FNC)是全球首个靶向艾滋病毒逆转录酶与辅助蛋白Vif的双靶点抑制剂,为国内第一个拥有自主知识产权的抗艾滋病毒口服药物,获得国家“重大新药创制”科技重大专项支持。该药品上市后,将为我国艾滋病的治疗和预防作出极大贡献。
海曲泊帕乙醇胺片
海曲泊帕乙醇胺是恒瑞医药对艾曲泊帕进行了一系列结构的修饰,研究出的具有自主知识产权的创新药,它是一种高选择性非肽类促血小板生成素受体(TPOR)激动剂,临床上主要用于治疗血小板减少症。
帕米帕利胶囊
帕米帕利(pamiparib,BGB-290)由百济神州自主研发,是一款在研PARP1和PARP2抑制剂。该药主要用于治疗既往接受过至少两线化疗、携有致病或疑似致病的胚系BRCA突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。
2.化药1类进口药申报情况
7月共40个进口化药1类受理号获得承办。
表二 2020年7月新承办的化药1类进口药
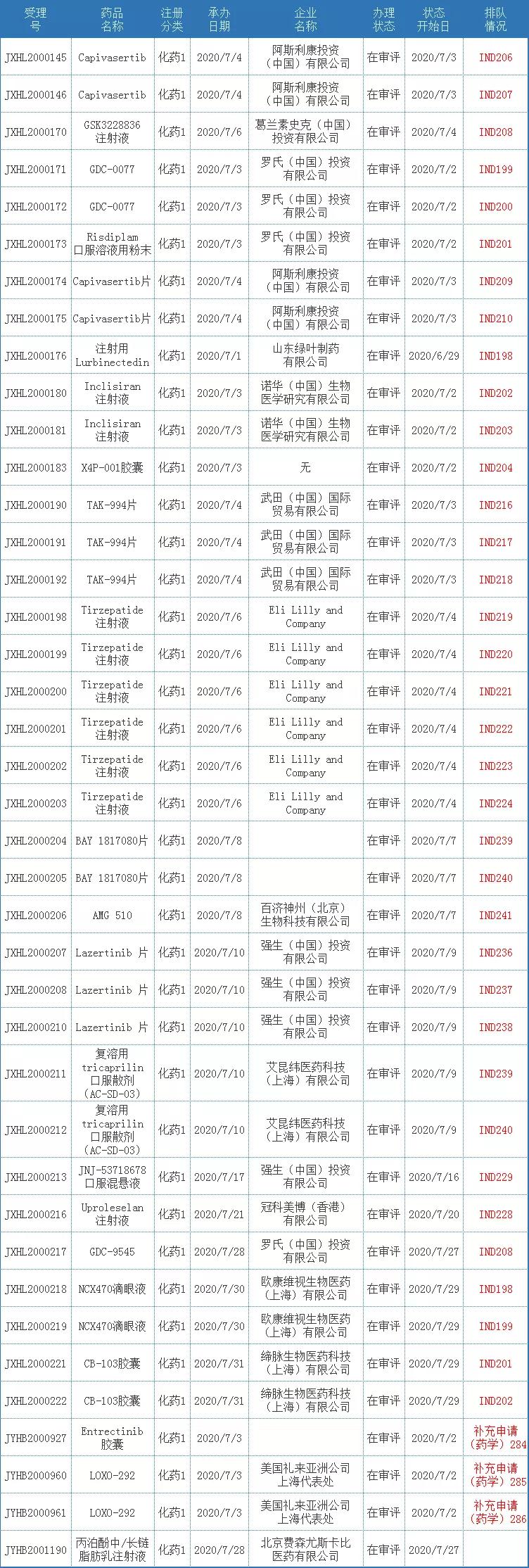
注:排队序号截止至2020年8月3日。
二、中药审评情况
7月份CDE承办新的中药注册申请受理号共计18个,其中新药1个,补充申请16个,一次性进口1个。
图三 2020年3-7月CDE中药受理情况
三、生物制品审评情况
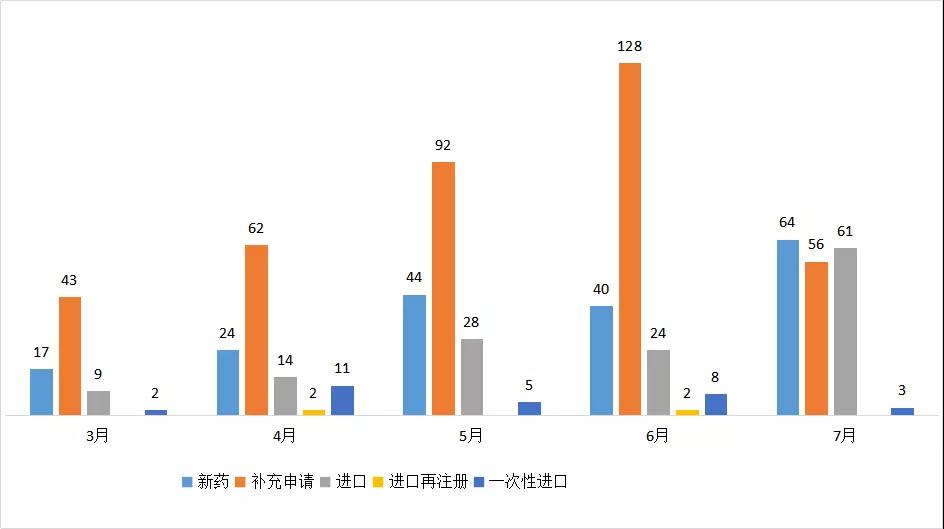
7月份CDE承办新的生物制品注册申请受理号共计184个,新药64个,补充申请56个,进口61个,3个一次性进口。

图四 2020年3-7月CDE生物制品受理情况
7月有50个1类治疗用生物制品受理号获得承办,目前均已经进入相应序列排队待审。
表三 2020年7月新承办的治疗用生物制品1类新药
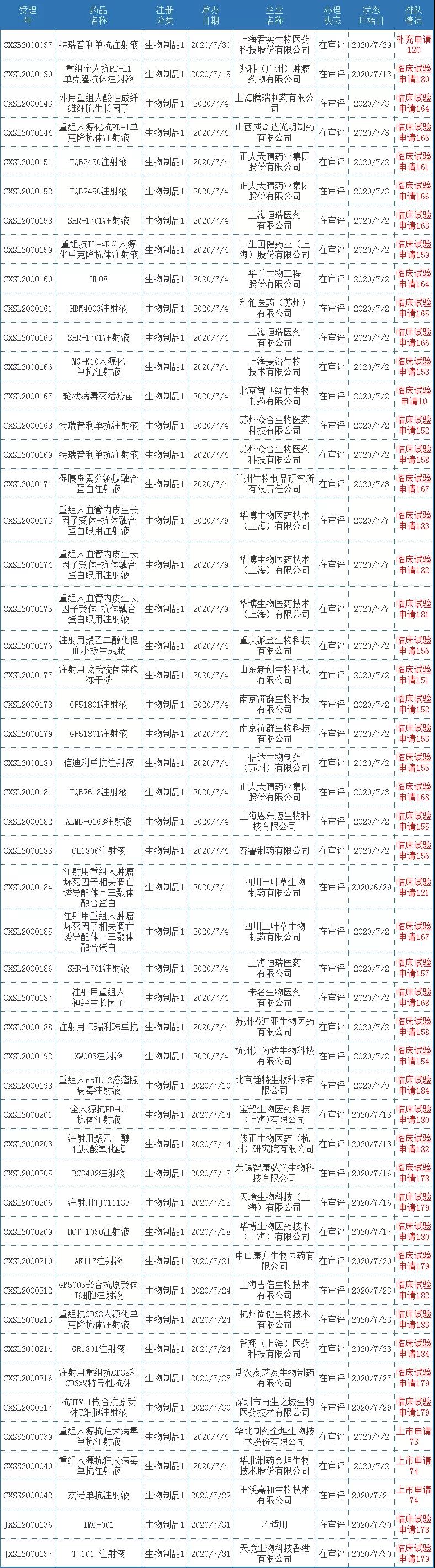
注:排队序号截止至2020年8月3日。
四、按一致性评价申报品种情况
7月新增95个按一致性评价要求进行申报的受理号。(篇幅限制仅展示一致性信息,视同及具体信息请关注药智企业版药品注册与受理数据库)
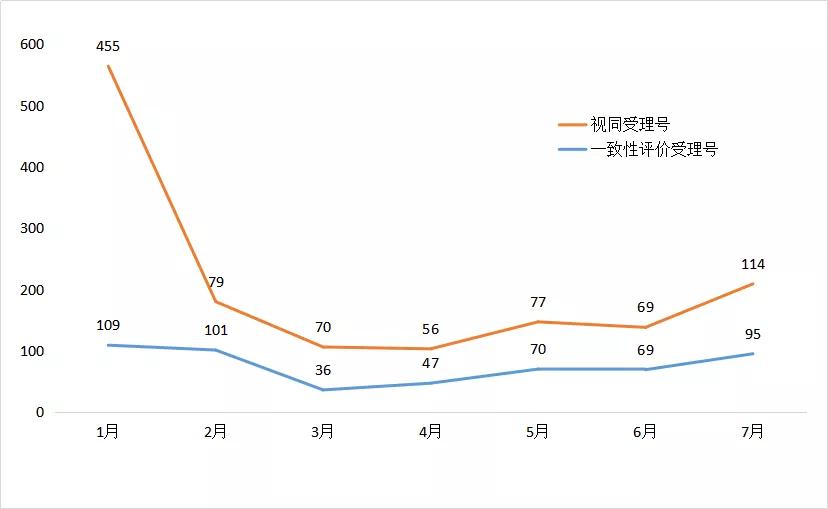
图五 2020年1-7月一致性评价受理数量
表四2020年7月新增一致性评价

注:排队序号截止至2020年8月3日。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!