
2020-08-13 22:48:48来源:药方舟浏览量:705
前言:7月8日中国国家药品监督管理局(NMPA)发布《突破性治疗药物审评工作程序(试行)》文件。文件明确,突破性治疗药物是指用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段,或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在1期、2期临床试验阶段,通常不晚于3期临床试验开展前申请适用突破性治疗药物程序。
5天!2款申请突破性治疗药物
在国家发布文件后不到2周的时间,接连两家申请NMPA突破性治疗药物。7月22日,再极医药宣布向NMPA提交申请,认定MAX-40279为治疗FLT3野生型急髓性白血病(AML)的突破性治疗药物。
7 月 17 日,李氏大药厂发布公告称:向国家药监局提交申请,以认定ZKAB001(PD-L1 单抗)为用于治疗复发及转移性宫颈癌的突破性治疗药物。该药企是首家宣布已提交突破性治疗药物申请的公司。

突破性疗法带来的优势
2012年7月,在《美国食品药品管理局安全与创新法案》(FDASIA)获得国会批准之后,突破性疗法认定(BTD)开始生效。新规旨在加速开发和审查治疗严重或威胁生命疾病的潜在新药。
不同于其他快速开发项目,BTD审批需要更多有效性证据,但作为回报,申请者在临床开发阶段会获得FDA更多实质性的参与和支持。
也就是说,一旦被认定为突破性疗法,在研药物将获得来自FDA的深入指导(高效药物开发项目)、一种加快FDA开发和审查的组织承诺,以及基于支持性临床数据获得滚动方式提交新药申请和上市申请优先审查的潜在资格。
在我国,目前明确申请人可以在1期、2期临床试验阶段,通常不晚于3期临床试验开展前申请适用突破性治疗药物程序。药审中心对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。申请人做好准备工作后提出与药审中心进行沟通交流的申请。药物临床试验期间的沟通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等,药审中心予以优先处理。也就是说,从Ⅰ期临床试验阶段开始,就将得到NMPA高效、强有力的指导,而且在提交药品上市申请时,可纳入优先审评审批程序。
另外,从美国BTD实行来看,2013~2014年,新分子实体(NME)药物批准的BTD产品(数量为11个)的总开发时间要比非BTD新分子实体(数量为53个)少2.5年。
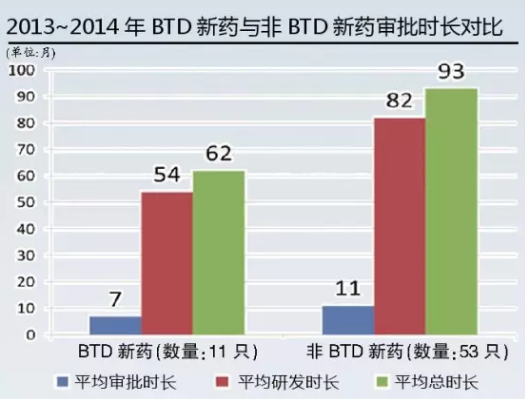
换句话说,BTD本身带来了近2-3.5年的时间优势(研发+审批)。新药对于一个企业的重要性不言而喻,而在新药更迭日新月异的今天,抢占市场先机就显得尤为重要,若靠拢成熟制度,突破性药物认定势必会给企业节省时间,争取市场先机,而我们的患者也能尽快受益。
另外,也有相关机构分析表示,在宣布BTD的第二天,那些没有任何上市产品的上市公司股票平均上涨了6% (超过市场收益)。
李氏大药厂—PD-L1 单抗
ZKAB001是中国肿瘤医疗有限公司开发的一种PD-L1抑制剂,目前正在中国开展针对宫颈癌的1期临床试验。截至目前,中国已上市2款进口PD-1单抗,4款国产PD-1单抗,2款进口PD-L1单抗,详情见下表:
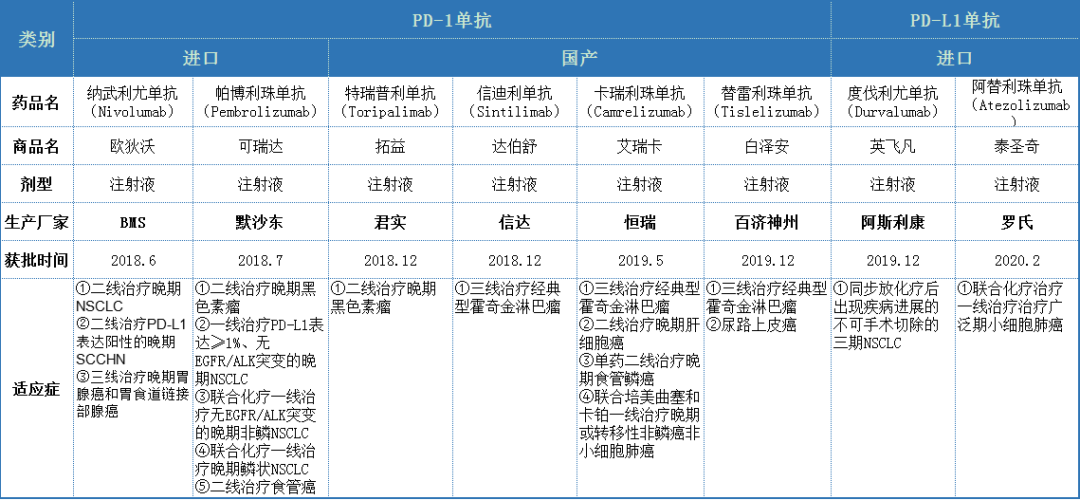
国内已上市的8家企业目前各有超过10项适应症临床在试验,本次李氏大药厂申请其PD-L1抗体ZKAB001为治疗复发及转移性宫颈癌的突破性治疗药物。就目前布局适应症而言,尚未PD-1/L1有宫颈癌适应症获批。
根据中国国际金融股份有限公司数据,预计到2025年,中国PD-L1单抗市场规模约约107亿美元,据药智数据企业版查询,目前与PD-1/L1靶点有关的药物,总共有267种,处于临床试验的有115个,布局药企颇多,李氏大药厂此次申请突破性治疗药物,将助力其成为中国大陆首个上市的抗PD-L1单抗药物,将加速其参与PD-1/L1的市场角逐。
再极医药—MAX-40279
MAX-40279是再极医药研发的一款FLT3/FGFR双靶点的抑制剂,在目前澳洲和中国同步进行的I期AML的临床试验中,对FLT3野生型AML末线治疗病人的应答率(ORR)达到36%(吉利替尼对FLT3野生型的AML病人的应答率是12%)。

FLT3又叫CD135,目前共有8个可作用于FLT3的药物获批上市,其中Quizartinib和Gilteritinib(吉利替尼)属于第二代抑制剂,选择性较高,主要用于治疗急性骨髓性白血病(AML)。吉利替尼由安斯泰来原研,最早于2018年获FDA批准上市,是全球首个获批单药治疗AML的FLT3抑制剂,目前在国内已提交上市申请,并被纳入优先审评。
目前,全球布局FLT3的企业超过40个,国内恒瑞、泽璟生物也有药物处于临床三期,但,像再极医药MAX-40279布局第二代FLT3抑制剂的极少数,且均处于临床早期研究阶段。
MAX-40279也是再极医药第一个进入临床试验的产品,其在2018年获得了美国FDA的孤儿药称号,若成功申请中国NMPA的突破性疗法, 将助力其明年年初全面开展II期多中心的临床试验,有望在国内第二代FLT3抑制剂研发中处于领先地位。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!