2月9日,FDA肿瘤药物咨询委员会(ODAC)就GSKPD-1单抗dostarlimab的两项临床试验能否支持其用于新辅助治疗dMMR/MSI-H局部晚期直肠癌(LARC)召开会议进行讨论。投票结果显示,ODAC以8:5的票数同意这两项临床试验的可用性。这意味着,dostarlimab有可能成为第一款用于新辅助治疗dMMR/MSI-H肿瘤的免疫疗法。本次会议主要围绕两个问题进行讨论:1)从试验设计、研究人群、临床终点和患者随访四方面来看,试验号为NCT04165772的II期研究是否足以评估dostarlimab在dMMR/MSI-H局部晚期直肠癌患者中的治疗益处和风险;2)建议提交的数据包是否足以评估dostarlimab用于治疗dMMR/MSI-H局部晚期直肠癌患者的治疗益处和风险。该II期研究是一项开放标签、非随机单臂临床试验,仅纳入了13例未接受过治疗的dMMR/MSI-H局部晚期直肠癌患者。在该研究中,患者首先接受dostarlimab(500mg,静脉注射,每3周1次)治疗6个月,随后进行放疗和手术。不过,是否进行手术取决于患者是否对dostarlimab产生完全的临床应答。研究的主要终点为第12个月实现病理完全缓解(pCR)或临床完全应答(cCR)的患者比例。GSK初次更新的结果显示,在可评估疗效的12例患者中,ORR为100%(12/12)。最新更新的结果显示,在可评估疗效的18例患者中,ORR为77.8%(14/18)。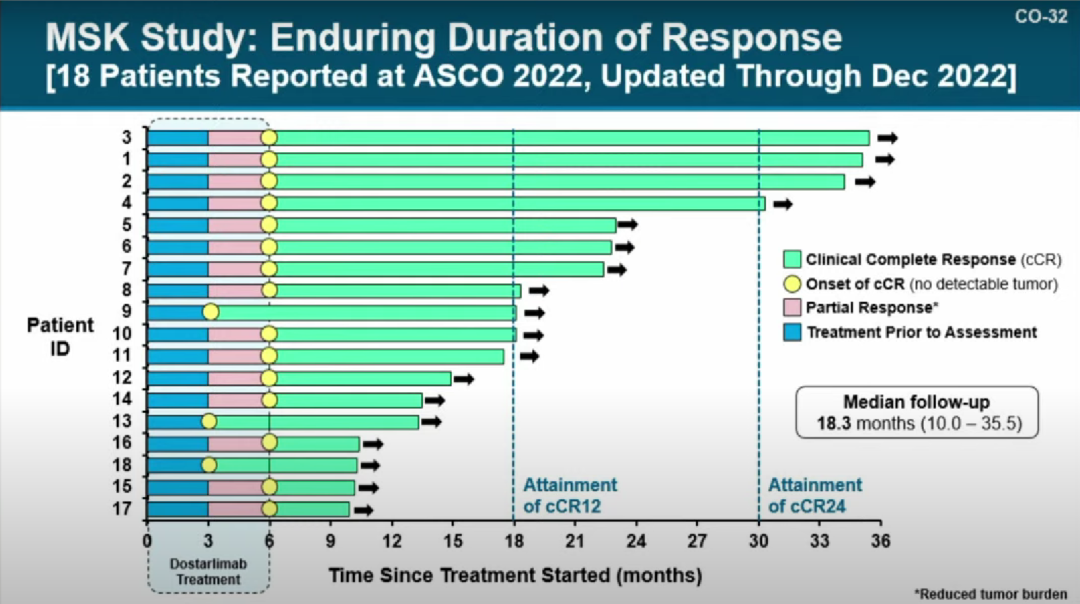
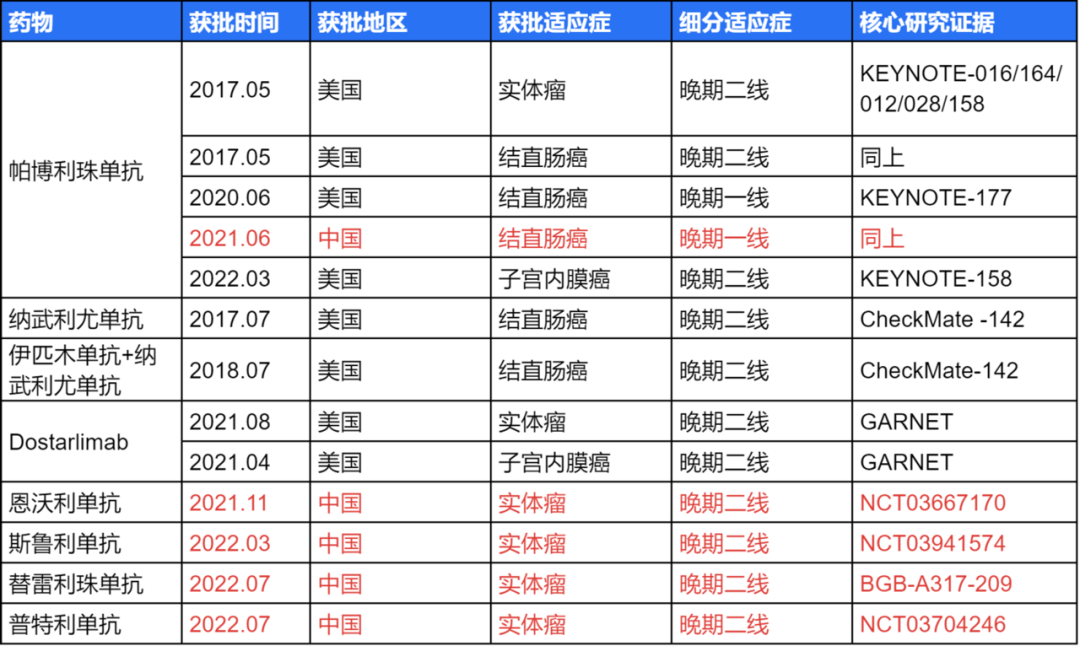
dostarlimab是AnaptysBio公司开发的一款靶向PD-1的单克隆抗体。2014年3月,TESARO(现为GSK子公司)与AnaptysBio达成合作,获得包括dostarlimab在内5款产品的全球权益。2021年4月,dostarlimab在美国获批上市,用于治疗接受铂类化疗中或之后进展的错配修复缺陷(dMMR)复发性或晚期子宫内膜癌成年患者。同年8月,其适应症扩大至接受治疗中或之后进展且无满意的替代疗法的复发性或晚期dMMR/MSI-H实体瘤。据医药魔方Nextpharma数据库统计,目前已获批治疗dMMR/MSI-H肿瘤的药物共8款,除dostarlimab外其余7款均已在中国获批。值得注意的是,除帕博利珠单抗外,剩余7款药物获批的适应症皆仅为二线治疗dMMR/MSI-H肿瘤。此外,若dostarlimab此次顺利获批,将成为第一款作为dMMR/MSI-H新辅助治疗的免疫疗法。获批用于dMMR/MSI-H肿瘤的药物
虽然dostarlimab可能会是最快获批用于dMMR/MSI-H肿瘤新辅助治疗的药物,但是信迪利单抗、替雷利珠单抗、纳武利尤单抗、度伐利尤单抗等已正在开展针对该适应症的临床试验,后来者很快就会迎头赶上。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容



