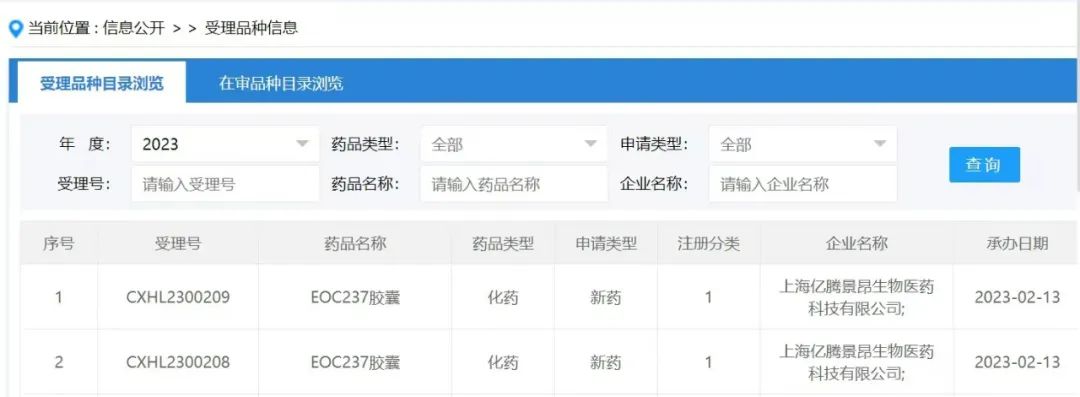
近日,专注于抗肿瘤创新药研发的生物科技公司亿腾景昂宣布,他们已经向国家药品监督管理局药品审评中心(CDE)正式递交了EOC237的临床试验申请。EOC237是一款口服、高选择性CDK7抑制剂。CDK7作为细胞周期调控和转录调节的关键靶点,被认为是极具潜力的抗肿瘤药物靶点。作为亿腾景昂首个自主研发的项目,EOC237在体内外研究中显示出比竞品更安全的选择性和更高的抗肿瘤活性。今年EOC237计划进入I期临床试验,适应症为晚期实体瘤。因目前国内尚未有同靶标分子递交临床试验申请,EOC237有望成为国内首个进入临床试验阶段的CDK7抑制剂。一、CDK7已成为癌症潜在热门靶点

近5年的时间,首个上市的CDK4/6抑制剂Ibrance,已取得全球销售额50亿美元的成绩,随之而来的除了同类药物的跟进,还有其周边靶点的研发崛起,CDK7就是其中之一。凭借其在细胞周期和转录两方面的作用,以及部分肿瘤细胞中的高表达,现已成为癌症潜在热门靶点之一。CDK7发现于20世纪90年代初,是CDK家族的成员之一。该靶点既可激活其他的CDKs参与调控细胞周期,同时又可以参与转录,使得CDK7与其他CDKs相比更为特殊。细胞周期过程中,CDK7具有活化激酶的作用,由CDK7、CyclinH和MAT1参与组成的CDK激活激酶 (CAK)复合物能够磷酸化参与细胞周期调控的多种CDK (1、2、4、6) 激酶。(Schachter and Fisher, 2013) 转录过程中,它能够磷酸化RNA聚合酶II大亚基的羧基末端结构域 (CTD)5位和7位的Ser残基,推动转录的起始;同时还可以磷酸化并激活CDK9,而CDK9具有促进CTD的S2磷酸化的活性。CDK7直接或间接参与调控细胞内转录起始及延伸过程,抑制CDK7会抑制CTD的磷酸化从而对转录进程产生极大的干扰。(Rimel and Taatjes, 2018)越来越多的研究表明,CDK7与乳腺癌、前列腺癌、小细胞肺癌、卵巢癌、胰腺癌、结直肠癌、胃癌、神经母细胞瘤及白血病等多种肿瘤的发生、进展及耐药密切相关。(Sava et al., 2020) 因此,CDK7被认为是治疗恶性肿瘤的一个潜在药物靶点。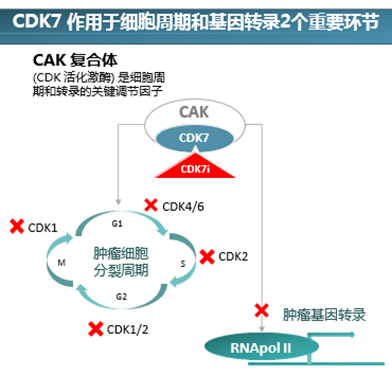
CDK7涉及的主要信号通路
随着CDK7抑制剂全球开发领先的肿瘤生物技术公司,Carrick Therapeutics在2021年ESMO和圣安东尼奥大会上发布CT7001用于乳腺癌患者令人鼓舞的数据,其后Carrick Therapeutics宣布完成2500万美元C轮融资,并获得辉瑞公司3500万美元投资,这也让我们看到了跨国制药巨头和资本对该靶点的关注和重视。二、全球及中国CDK7靶向药研发进展

CDK7抑制剂作为细胞周期、转录和内分泌受体信号转导的调节因子,已成为一种极具前景的抗肿瘤药物,且相比早期CDK抑制剂具有更广的治疗窗。目前已开发出至少十种CDK7选择性抑制剂,对多种癌症类型具有活性,在临床前研究中,作为单一疗法或与其他抗癌药物联合使用,这些抑制剂已显示出克服耐药性癌症的潜力。乳腺癌是CDK7抑制剂最具前景的适应症之一,无论在雌激素受体阳性(ER+)乳腺癌及三阴性乳腺癌(TNBC)均有强大的治疗潜力。此外,CDK7抑制剂在胰腺癌,上皮性卵巢癌,小细胞肺癌,非小细胞肺癌,去势耐药前列腺癌等癌种,均有明确的临床前数据证实其有效性。而在MYC扩增的癌细胞系,包括肝癌、胰腺癌、神经母细胞瘤、小细胞肺癌(SCLC)和TNBC等,对CDK7抑制剂高度敏感。此外,对于那些对其它药物先天性耐药或获得性耐药的癌症患者,特别是那些目前尚无治疗方法的癌症,CDK7抑制剂有望成为一种革命性的治疗策略。现今,全球共有4种CDK7抑制剂正处于临床试验阶段:Carrick Therapeutics的CT7001(Samuraciclib),Syros Pharmaceuticals的SY5609,Exelixis的XL102和Qurient的Q901。其中,CT7001和SY5609临床试验的积极结果均在2021年ESMO和/或SABCS大会上公布。CT7001已经获得两项FDA快速通道认定(FTD):在HR阳性HER2阴性的局部进展或转移性乳腺癌(HR+ HER2- mBC)对CDK4/6抑制剂耐药患者中与氟维司群联用;在三阴性乳腺癌(TNBC)患者中与化疗药物联用。在CT7001 II期临床试验中,该单臂队列研究评估了CT7001与标准剂量氟维司群联合给药在晚期HR+ HER2 - 乳腺癌患者中的耐受性和疗效;所有晚期患者既往均接受过芳香化酶抑制剂和CDK4/6抑制剂治疗。其临床获益率达到36%,且相对于基线肿瘤TP53突变型患者PFS显著延长(32周 vs 7.9周)。SY5609在化疗经治胰腺癌(PDAC)患者药效最佳,疾病控制率(DCR)为38.5%(5/13);在SY5609与吉西他滨联合给药的胰腺癌队列研究中,总疾病控制率(DCR)达到了50%(4/8)。在2022年9月,FDA授予CDK7抑制剂SY5609“孤儿药”资格,作为复发转移性胰腺癌患者的潜在治疗选择 (Syros Pharmaceuticals, Inc., 2022) 。此外,默沙东近期宣布与Qurient合作进行Q901联合肿瘤免疫疗法的探索;而 Exelixis在2022 SABCS大会上公布了XL102在晚期实体瘤患者中的I期研究结果,在HR+ 乳腺癌(12例),胰腺癌(3例)和肉瘤(3例)中,表现出良好的耐受性。目前看来,在研临床阶段CDK7抑制剂可谓全面开花,展现出不俗的转化前景。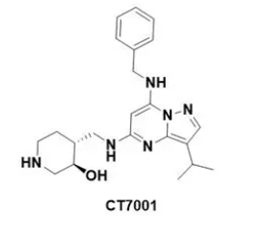
CT7001化学结构
三、亿腾景昂CDK7抑制剂的独特性和优势

国内对于CDK7的研究,尤其是抑制剂的开发,尚处于早期阶段。据悉,亿腾景昂的EOC237保持了对靶标CDK7的高抑制活性,对源于乳腺癌、卵巢癌、子宫内膜癌、前列腺癌、胰腺癌、肺癌和结直肠癌等多种人肿瘤细胞的显著抗增殖活性和对多种异种移植瘤生长的强效剂量依赖性抑制。EOC237在吸收、分布、代谢、排泄及药物代谢方面均表现出较为良好的成药性。相比同类化合物CT7001,EOC237最为突出的优点在其对包含CDK家族在内的绝大多数激酶不抑制或较弱抑制,体现出高度选择性,相应的脱靶风险低,体内药理毒理试验显示其安全有效,这为其将来应用于精准医疗和联合用药打下坚实基础。四、务实的差异化创新之路

EOC237是亿腾景昂早研管线中首个成功申请IND的自主研发产品。此前,亿腾景昂一款新型选择性HDAC抑制剂恩替诺特(拟商品名:景助达)联合芳香化酶抑制剂用于治疗激素受体(HR)阳性、人类表皮生长因子受体2(HER-2)阴性,经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者的新药上市申请(NDA)也已成功递交国家药品管理局(NMPA)。
公司管理团队很早就意识到,经历了研发的同质化竞争后,在产业升级的进程中,无论是国内市场还是海外市场,企业都需要从靶点、适应症等各方面去做有差异化、有临床价值的创新,具备真正创新实力的企业才能在行业中立足。因此,亿腾景昂在专注疾病领域以及新药开发项目上的决策很大程度是依托其长期积累的市场经验以及对于多个重要疾病领域的患者临床需求的了解所做出的。
基于核心技术团队对肿瘤生物学和临床医学的深刻理解,公司在管线布局中围绕靶向治疗、免疫治疗的抗肿瘤药物研发方向,聚焦于肿瘤发生和生长的关键信号通路,构建了具有全球首创和同类最佳、满足临床需求的产品组合。公司在研产品均针对肿瘤发生发展调控网络中的关键靶点,具备拓展多种适应症的潜力,为了充分挖掘产品组合的临床价值,公司布局了乳腺癌、头颈鳞癌、非小细胞肺癌、消化道肿瘤等多癌种领域。
亿腾景昂这种务实性的差异化创新模式,让他们得以多年来脚踏实地、稳步发展。
参考资料:
[1]Rimel, J.K., and D.J. Taatjes. 2018. The essential and multifunctional TFIIH complex. Protein Science. 27:1018–1037. doi:10.1002/pro.3424.[2]Sava, G.P., H. Fan, R.C. Coombes, L. Buluwela, and S. Ali. 2020. CDK7 inhibitors as anticancer drugs. Cancer and Metastasis Reviews. 39:805–823. doi:10.1007/s10555-020-09885-8.[3]Schachter, M.M., and R.P. Fisher. 2013. The CDK-activating kinase Cdk7. http://dx.doi.org/10.4161/cc.26355. 12:3239–3240. doi:10.4161/CC.26355.[4]Syros presents new data from phase 1 trial of SY-5609 and details three-pronged combination strategy to advance SY-5609 in solid tumors and blood cancer. News release. Syros Pharmaceuticals, Inc. September 20, 2021. Accessed September 15, 2022
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容