
2023-02-14 10:55:52来源:医药魔方浏览量:505
2月13日,G1 Therapeutics公布了CDK 4/6抑制剂(曲拉西利)+FOLFOXIRI+贝伐珠单抗三联疗法治疗转移性结直肠癌(CRC)的III期PRESERVE 1试验的关键结果,该试验实现了严重中性粒细胞减少症指标的共同主要终点,具有统计学意义;然而,早期的抗肿瘤疗效数据,包括总缓解率(ORR)和初步的生存期数据都倾向于安慰剂组。鉴于安慰剂的疗效优于trilaciclib,其决定终止该项试验。

PRESERVE 1达到了共同主要终点,与安慰剂相比,trilaciclib组患者诱导期间严重中性粒细胞减少症的发生率(安慰剂:20% vs. trilaciclib:1%;p<0.001)和第1个周期至第4个周期严重中性粒细胞减少症平均持续时间(安慰剂:1.3天 vs. trilaciclib:0.1天;p<0.001)均有临床意义和统计学意义降低。并且,接受trilaciclib治疗患者因化疗诱导的腹泻率较安慰剂显著较低,3/4级腹泻率降低了50%,任何级别腹泻率降低了30%。

此外,trilaciclib组患者经历更少的化疗剂量降低和用药延迟。其他骨髓保护相关的次要指标也有利于trilaciclib,包括发热性中性粒细胞减少(安慰剂:5% vs. trilaciclib:0%)和ESA给药(安慰剂:7% vs. trilaciclib:3%)。
不过早期抗肿瘤疗效数据,包括ORR显示安慰剂组更高,分别为61%和50%。考虑到这些抗肿瘤疗效指标的差异以及较难实现无进展生存期(PFS)和总生存期的(OS)的终点指标,G1已决定停止PRESERVE 1研究。
Trilaciclib是G1公司发现并开发的一款“First-in-Class”小分子短效CDK 4/6抑制剂,于2021年2月13日获美国FDA批准上市,用于预防扩散期小细胞肺癌(SCLC)成人患者因铂类/依托泊苷方案或拓扑替康方案化学治疗导致的骨髓抑制。先声药业于2020年8月与G1公司达成独家许可协议,获得了trilaciclib在大中华地区所有适应症的开发和商业化权益,并将参与其在全球的临床试验。2022年7月12日,trilaciclib在国内获批上市。
Trilaciclib是G1 Therapeutics最为倚重的产品,为其制定了非常多样的开发策略,trilaciclib一线治疗三阴性乳腺癌(TNBC)的III期研究、一线治疗膀胱癌的II期研究正在进行中。
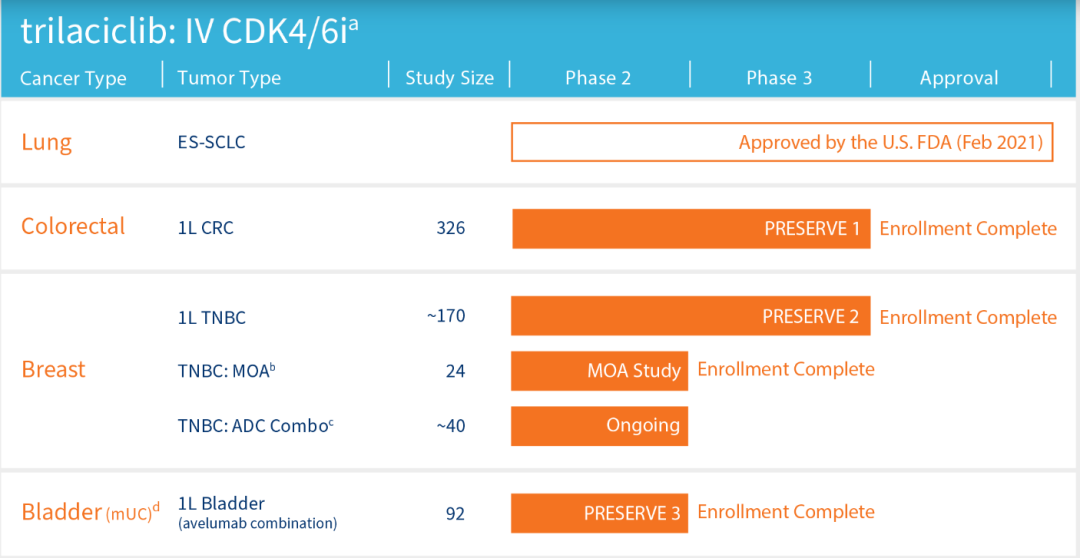
Trilaciclib开发策略(G1 Therapeutics官网)
不过,G1 Therapeutics表示,在广泛期小细胞肺癌和三阴性乳腺癌患者中,trilaciclib联合不同化疗方案的临床试验没有显示出这种不良生存信号。此次试验的失败和终止导致该公司股价下跌52%。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容