
2023-02-21 11:45:38来源:药智网浏览量:372
近日,宜明细胞自主驯化的悬浮293XSTM细胞库完成了向美国FDA的DMF备案,并已收到确认函,备案号为DMF 28844。
293XSTM细胞株适用于多种AAV血清型的大规模生产,已获得中国国家知识产权局颁发的发明专利证书。未来,宜明细胞客户的AAV项目在进行IND申报时,可直接引用相应的DMF备案号,极大地缩短产品审查和评估时间,简化IND申报资料包,从而加速相关药品的项目申报进程。

宜明细胞悬浮293XSTM细胞库DMF备案确认函
图片来源:宜明细胞官微
在基于“三质粒瞬转法”的AAV生产平台中,可放大的、稳定的细胞株是核心组分之一。宜明细胞的293XSTM细胞库:
高密度,培养密度可达1E7 cells/ml
可放大,可实现50L-200L-500L-2000L规模细胞培养
高产率,AAV产率可超过1E14VG/L
安全,无辅助病毒、 无动物来源组分
提供完善的文件证明,细胞库生产符合GMP标准,完全满足中美双报的要求
自主驯化可授权,已获得中国国家知识产权局颁发的发明专利证书
完成了向美国FDA的DMF备案,极大地缩短产品审查和评估时间
2022年,由宜明细胞生产且获批IND的三款AAV基因药物所使用的都是293XSTM细胞株*
图片来源:宜明细胞官微
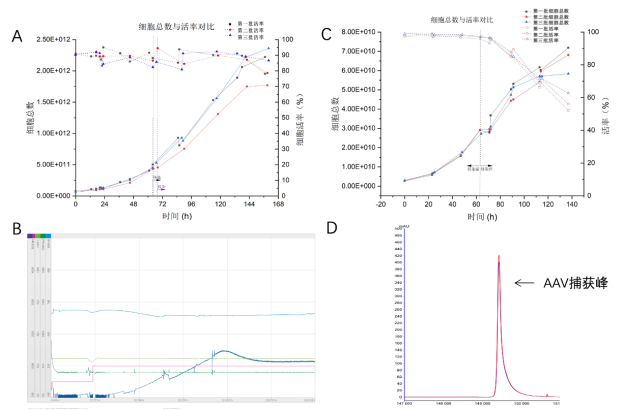
293XSTM的部分数据(数据源自宜明细胞)|A:200LAAV生产体系,3批细胞总数与活率对比数据 ;B:200L生物反应器发酵曲线;C:Wave 25LAAV生产体系,3批细胞总数与活率对比数据;D:200L AAV生产体系,经第一步亲和层析捕获后,空壳率仅为56%。
*:与宜明细胞合作的三款获批NMPA IND的AAV项目分别是天泽云泰的“VGR-R01”和“VGB-R04 ”以及朗昇生物的“LX101”。
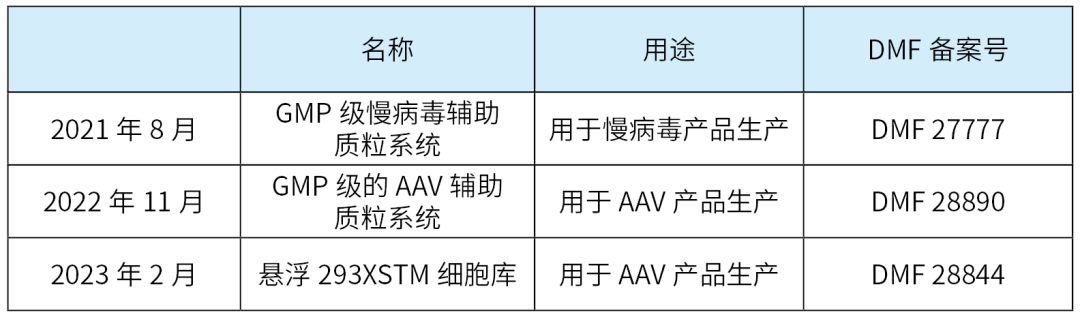
目前,宜明细胞已有三项自主研发品种完成在美国FDA的DMF备案,详见下表:
图片来源:宜明细胞官微
DMF是指原料供应商递交给FDA的药物存档文件,包含药物产品在生产、操作、包装和储存过程中用到的设施、操作流程、原料等保密细节信息。根据美国联邦食品、药品和化妆品法等规定,药品在上市之前必须向FDA提出相关的申请(如临床研究申请(IND)、新药注册(NDA)和生物制品许可证申请(BLA)等),并需要提供该药物在安全性、有效性和质量三方面的全部信息,其中还涉及到原料药以及辅料等相关技术内容。这些信息不仅繁冗复杂,而且涉及保密需求。DMF(Durg Master Files, 药品主文件)体系于是应需而生。
宜明细胞将以上信息以DMF文件的形式在FDA备案并获得相应产品的DMF备案号,为宜明细胞客户在基于慢病毒以及AAV载体项目的申报中节约了审批成本、提高了审批效率、并且缩短了注册周期。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容