年年岁岁花相似,岁岁年年人不同!一年一度的跨国药企财报总是在大抵相同的时间公布,却每每能给我们带来不同的冲击和思考。
制药巨头收入的排名变化彰显着企业成功商业战略的高瞻远瞩,新老“药王”权柄交接的大戏演绎着超级重磅炸弹药物的荣耀和黯然,热门赛道药物市场格局的变幻蕴含了每一家药企为了满足患者需求所付出的努力……精彩的故事一直在发生,需要我们用眼睛去发现。今天不妨就把目光放到CDK4/6抑制剂这个热门赛道上。
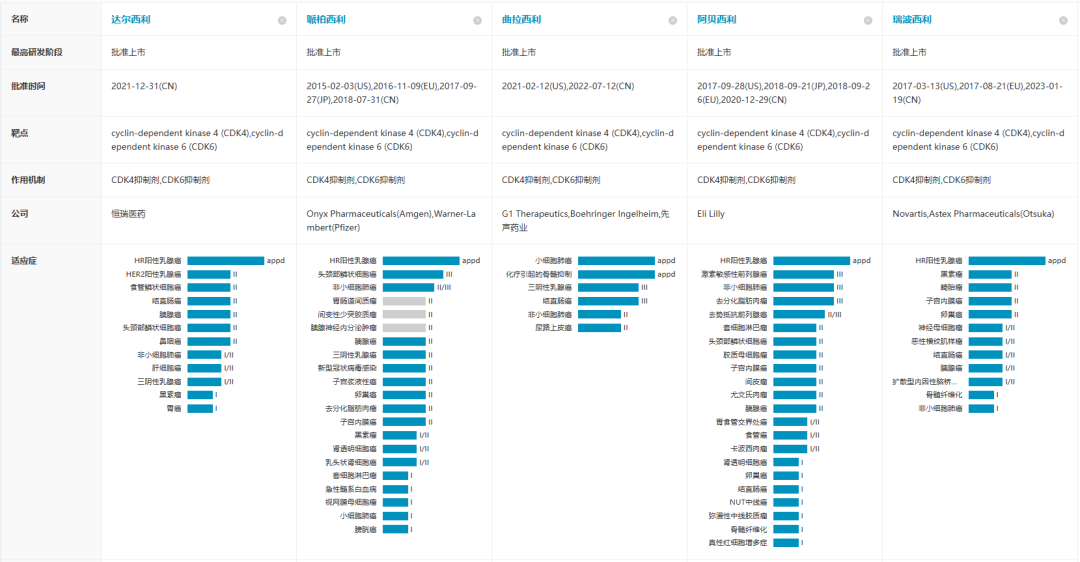
自2015年2月Ibrance(哌柏西利)首次获批以来,目前全球共有5款CDK4/6靶向新药上市,除了达尔西利仅在中国获批上市未披露销售数据外,其余4款的全球市场总规模基于最新财报数据已持续增长至近90亿美元。
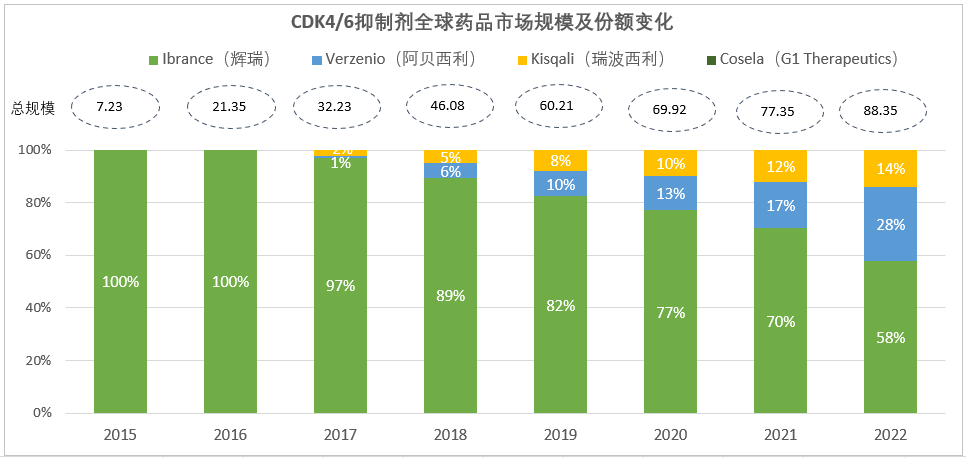
注:1)数据来源于公司财报,市场规模按亿美元计;2)Cosela在2021年销售收入0.11亿美元,2022年销售额尚未披露,占比预计低于1%
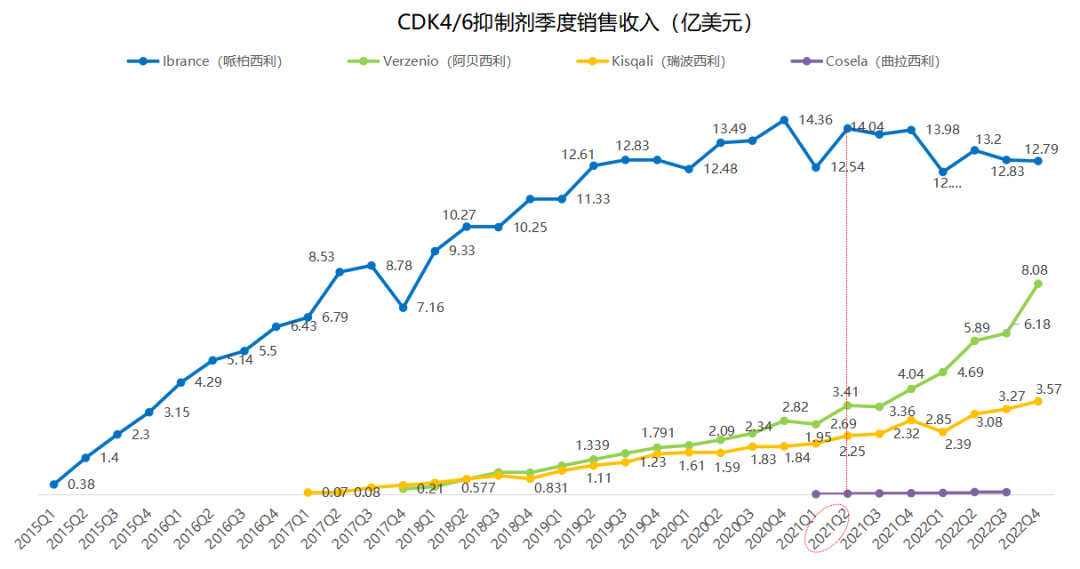
虽然从年度销售数据上看,哌柏西利凭借先发优势目前仍然占据最大的市场份额(58%),但是季度销售数据的变化却给我们呈现了另外一个剧本的故事,那就是2017年3月获批的Verzenio(阿贝西利)正以强劲的增长势头缩小与Ibrance的差距,季度业绩向上增长的拐点在2021Q2已经出现,目前看起来只落后Ibrance半个身位。此外,Kisqali(瑞波西利)也以小步慢跑的姿态成长为10亿美元+的重磅炸弹,在CDK4/6赛道牢牢占据了一席之地。
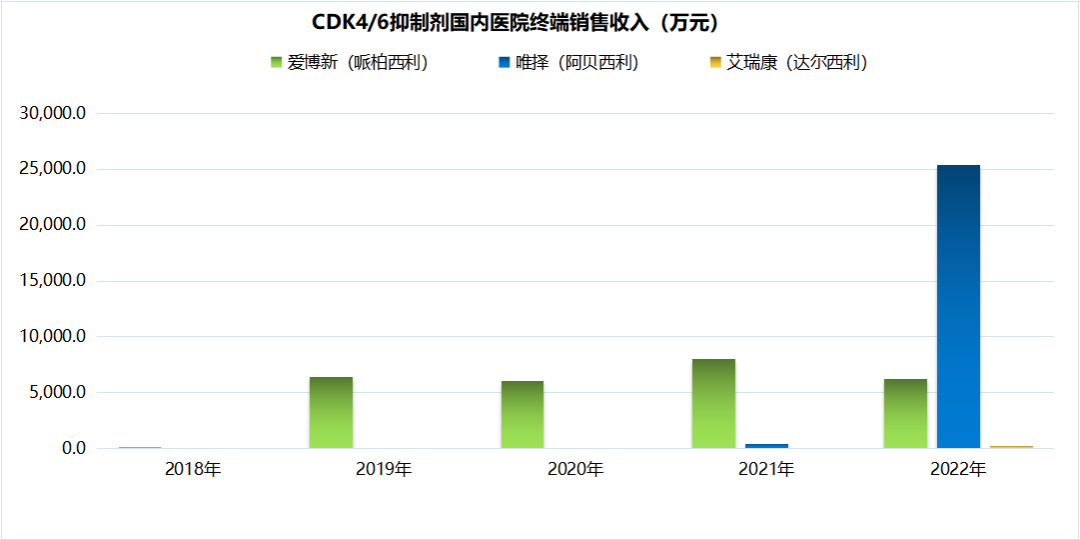
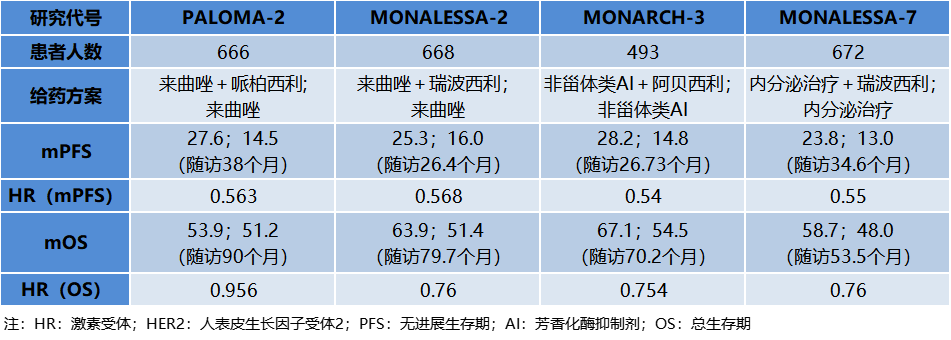
放眼国内市场,根据医药魔方医院终端市场数据可以发现,哌柏西利上市以来在国内的销售表现一直比较稳定,而阿贝西利则是在上市后的第2年就出现放量高速增长,销售额也达到了哌柏西利的近4倍。注:1)数据来源于医药魔方PharmaBI数据; 2)瑞波西利于2023年1月19日国内获批,尚无销售数据CDK4/6赛道上单个药品的增速快慢或者市场份额的变化都有各自的故事背景,折射出企业自身的开发策略和成败,CDK4/6靶向药物整体市场规模的持续增长也反映出背后巨大未满足的临床需求。百亿美元市场规模的CDK4/6抑制剂,满足了什么样的临床需求?CDK4/6抑制剂当前上市的适应症主要是乳腺癌,这也是人数最多的癌症患者群体。根据WHO国际癌症研究机构(IARC)发布的全球最新癌症数据,2020年全球乳腺癌新增人数达226万,首次超过肺癌(221万),成为全球第一大癌症。在乳腺癌患者中,激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)是最常见的亚型,约占70%。CDK4/6抑制剂上市之前,内分泌治疗是HR+/HER2-晚期乳腺癌的经典系统性治疗手段,但临床上一直存在诸如原发或继发耐药导致疗效大打折扣的需求痛点。CDK4/6抑制剂可以有效克服或延迟内分泌耐药的出现,为患者争取更长的生存时间,这类药物的上市和应用使得HR+/HER2-乳腺癌患者的治疗模式从单一内分泌治疗向逐步内分泌联合靶向治疗的模式转变,患者的生存获益也获得突破性改善。如今,CDK4/6抑制剂联合内分泌治疗已成为HR+/HER2-乳腺癌患者晚期一线、二线以及早期辅助治疗新标准,这也是这类药物自上市以来迅速获得医生患者认可并成长为重磅炸弹的主要原因。从临床数据来看,目前获批一线治疗HR+/HER2-晚期乳腺癌的3款CDK4/6抑制剂均显示出显著延长患者中位PFS(9.3-13.4个月)的获益,疾病进展风险降低均超40%(HR 0.54~0.58);总生存期(OS)方面,哌柏西利+来曲唑在PALOMA-2研究中证明相比安慰剂+来曲唑未实现统计学显著性获益;阿贝西利+来曲唑 vs. 来曲唑的MONARCH 3研究在ESMO 2022大会上更新了第二次OS中期分析结果,两组的中位OS分别为67.1和54.5个月,联合治疗组患者生存获益较内分泌治疗超过1年,数据尚未成熟(HR=0.754,95%CI 0.584-0.974,P=0.0301),将继续进行随访。CDK4/6抑制剂联合内分泌药物一线治疗HR+/HER2-晚期乳腺癌III期数据对于既往内分泌治疗失败的HR+/HER2-晚期乳腺癌患者,4款CDK4/6抑制剂联合氟维司群作为二线治疗方案凭借PFS的显著获益均赢得了监管机构的批准。在总生存获益方面,MONARCH-2研究中,阿贝西利+氟维司群相比对照组使中位OS改善了9.4个月(46.7 vs. 37.3个月,HR 0.76;95%CI 0.61-0.95;P=0.01),是唯一被证实联合氟维司群在绝经前和绝经后人群中显著延长总生存期的CDK4/6抑制剂;瑞波西利联合氟维司群在MONALEESA-3研究中证明了对绝经后乳腺癌患者的总生存获益。CDK4/6抑制剂联合氟维司群二线治疗HR+/HER2-晚期乳腺癌III期数据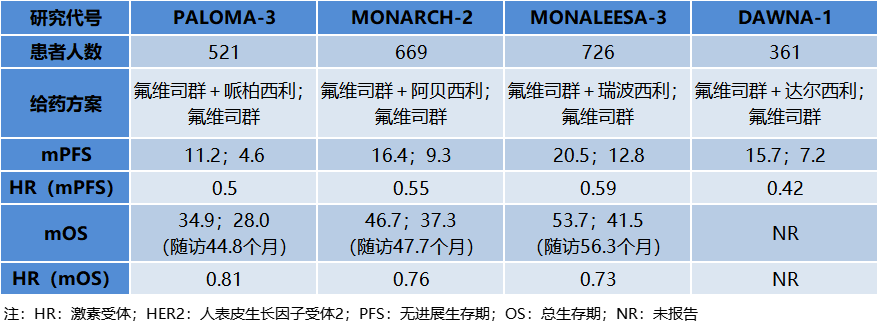
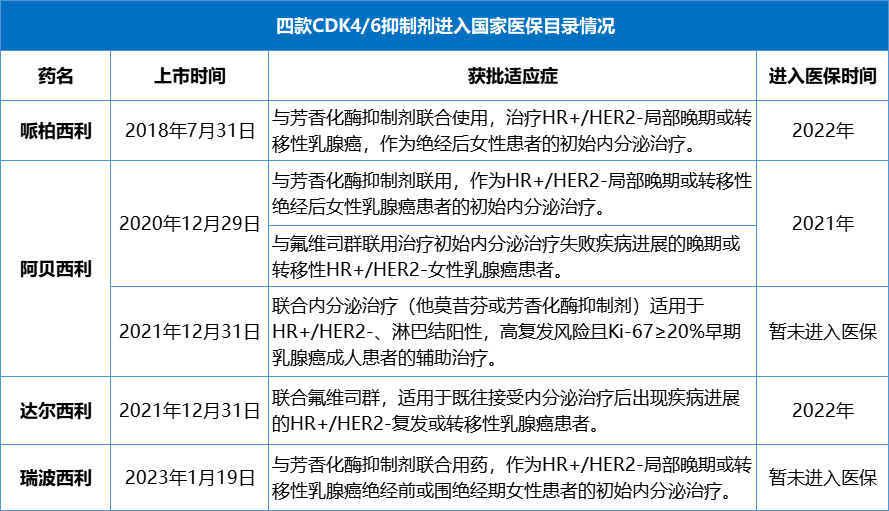
在满足了HR+/HER2-晚期乳腺癌患者的用药需求之后,早期乳腺癌患者也成为几家布局CDK4/6抑制剂企业不约而同的适应症开发选择。不过截至目前,阿贝西利是首个也是唯一一个取得积极III期结果的CDK4/6抑制剂。monarchE研究为期42个月随访数据显示,相较于单独使用标准辅助ET,阿贝西利联合ET可将HR+/HER2-高风险早期乳腺癌患者的复发风险减少34%(HR:0.664, 95% CI 0.578–0.762;P<0.0001)。这一具有统计学意义的显著改善体现为两个治疗组4年无浸润性疾病生存率(IDFS)的差异为6.4%(阿贝西利组为85.8%,对照组为79.4%)。基于monarchE研究积极结果,阿贝西利已获FDA和NMPA以及多国监管机构批准用于治疗高风险(淋巴结阳性、高复发风险且Ki-67≥20%)HR+/HER2-早期乳腺癌成人患者的辅助治疗,成为全球以及中国首款获批此适应症的CDK4/6抑制剂。总体而言,对于晚期HR+/HER2-乳腺癌患者,几款CDK4/6抑制剂都实现了PFS获益并获得了监管机构批准,但OS结局有所不同。而针对早期HR+/HER2-乳腺癌患者,阿贝西利是目前唯一拿到获益证据的药物。在更广泛乳腺癌人群和治疗场景中取得的胜利是助力阿贝西利销售额大幅增长的主要驱动因素。乳腺癌只是CDK4/6抑制剂类药物最早研发成功的适应症,这类药物同时也被开发用于治疗非小细胞肺癌、前列腺癌等其他大的癌种。随着更多适应症的扩展和对患者临床需求的满足,CDK4/6抑制剂未来的市场规模无疑也将超过百亿美元。CDK4/6抑制剂对于乳腺癌等肿瘤患者的临床价值毋庸多言,但在医保基金作为最大支付方的中国市场,患者临床需求的满足还非常依赖医保的支撑。2018年一部“我不是药神”的电影直击国内肿瘤诊疗痛点:医保覆盖远不能满足患者需求、抗癌新药临床及经济可及性差、新药准入流程繁冗困难.....近几年,国家通过一系列举措来满足患者需求,包括出台优先审评等快速审评审批途径使创新药获批速度大幅提升;通过每年一次的医保目录调整以及创新药医保谈判大幅提高了药物可及性,让更多患者用上了创新药。从企业的角度,进入医保后通过“以量换价”的方式获得更多销售收入,可以兑现产品的临床价值和商业价值,从而驱动下一轮研发。目前,国内共有哌柏西利(辉瑞)、阿贝西利(礼来)、瑞波西利(诺华)、达尔西利(恒瑞)4款CDK4/6抑制剂获批治疗乳腺癌。哌柏西利在国内上市最早,凭借先发优势占领了一定市场份额并维持稳定的销售表现,但从2022年开始,CDK4/6抑制剂市场的领军位置已经被阿贝西利反超并牢牢占据。这种与全球市场格局截然不同的结果,一方面是阿贝西利在适应症覆盖上的优势,另一方面就是医保的因素。从适应症上看,HR+/HER2-晚期乳腺癌一线/二线治疗、HR+/HER2-早期乳腺癌辅助治疗只有阿贝西利一个做到了同时覆盖。并且,虽然阿贝西利在国内的上市时间更晚,但是纳入国家医保目录的时间却比哌柏西利早了一年。由于中国市场上创新药的最大买家是国家医保基金,提前一年进入国家医保目录,也就意味着阿贝西利能够凭借可及性更高的优势吸引到更多的患者。来源:医药魔方PharmaGO、药品说明书、2022版医保目录随着医保谈判的常态化进行,哌帕西利和达尔西利也都成功进入了2022版医保目录,这为国内的乳腺癌患者提供了更多的用药选择。不过从医保目录报销适应症的覆盖情况来看,阿贝西利是唯一国家医保覆盖HR+/HER2-晚期乳腺癌双适应症的CDK4/6抑制剂,在未来较长时间内仍会占据较大的竞争优势。CDK4/6抑制剂能够有效克服或延迟内分泌耐药的出现,为占到乳腺癌患者大多数的HR+/HER2-群体带来生存获益,这种临床价值改变了乳腺癌临床治疗的模式,也推动CDK4/6靶向药物的市场规模达到百亿美元级别。就单个药物而言,市场先发优势十分重要,临床价值也是市场竞争的基础,谁更能通过临床试验获得让患者和医生信服的临床数据、更早地覆盖更广泛人群和治疗场景,谁就能在市场竞争中处于更有利的位置,这也是我们通过观察PD1/PD-L1、BTK、CDK4/6等赛道药物市场变化都可以得到的共同结论。其次,快速的市场准入,比如进入医保,提高患者用药可及性对于企业和患者也是双赢。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容