2月27日,SpringWorks Therapeutics宣布其γ-分泌酶抑制剂nirogacestat用于治疗成人硬纤维瘤的新药申请(NDA)已获FDA优先审评。处方药使用者费用法案(PDUFA)日期定为2023年8月27日。此外,SpringWorks表示FDA目前不打算召开咨询委员会会议来讨论该NDA。
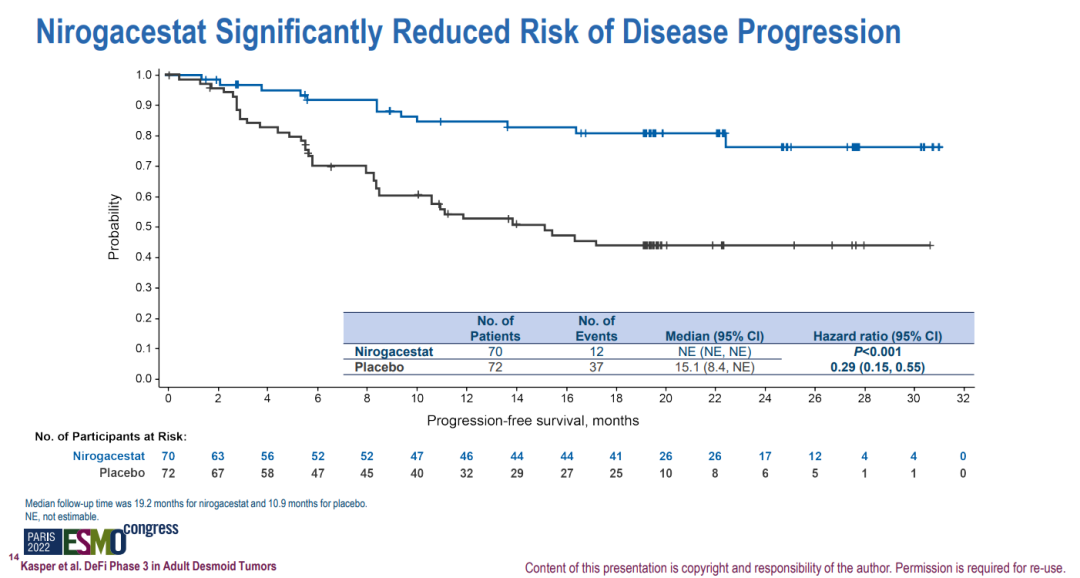
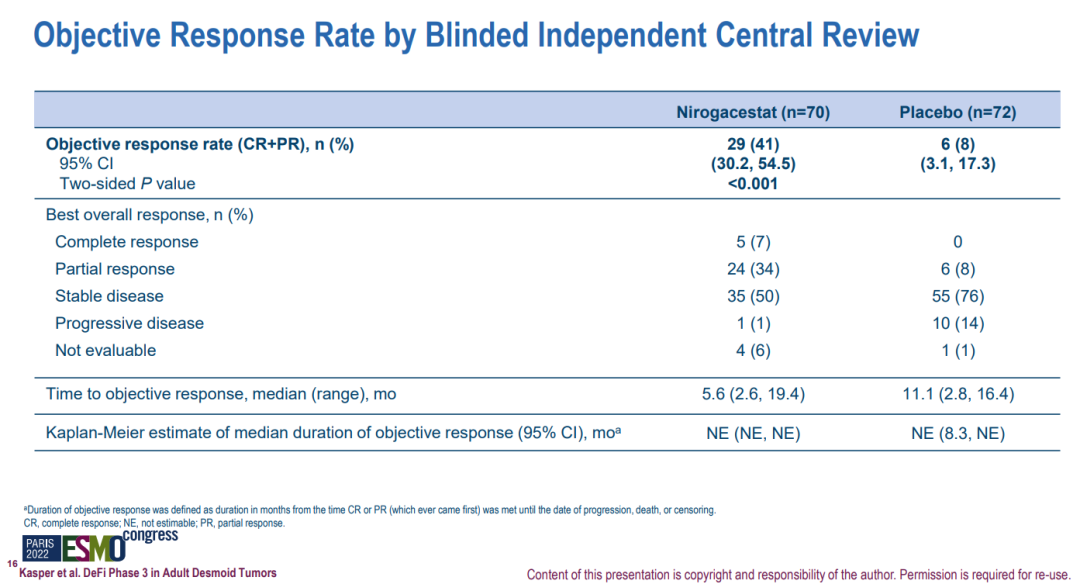
硬纤维瘤是一种罕见的侵袭性、局部浸润性、高复发性软组织肿瘤,最常见于20至44岁人群,尤其是女性。此前,硬纤维瘤主要通过手术切除治疗,但手术后复发率高。目前尚无相关疗法获批上市。nirogacestat是辉瑞开发的一种口服、选择性、小分子γ-分泌酶抑制剂。2017年9月,辉瑞孵化的SpringWorks完成A轮融资并从辉瑞手中获得4款临床在研产品(nirogacestat、mirdametinib、Senicapoc和PF-0445784)的权益。此次优先审评主要是基于III期DeFi研究的积极结果。DeFi是一项全球性、多中心、随机、双盲、安慰剂对照的临床试验,共纳入142例患者,旨在评估nirogacestat(150mg,每日2次)对比安慰剂治疗进展性硬纤维瘤或侵袭性纤维瘤成年患者的有效性和安全性。研究的主要终点为无进展生存期(PFS)。结果显示,nirogacestat组患者的PFS显著延长(无法估计 vs 15.1个月;HR=0.29;P<0.001)。此外,nirogacestat组患者的客观缓解率显著改善(41% vs 8%;P<0.001)。
SpringWorks首席执行官Saqib Islam说:“硬纤维瘤患者可能会经历严重的疼痛和其他使人衰弱的疾病,我们很高兴有机会改变这些患者的护理标准。此次nirogacestat的NDA获得优先审评代表了我们为硬纤维瘤患者提供第一个批准疗法的雄心壮志的一个重要里程碑。我们期待与FDA在审评过程中密切合作,并继续专注于确保我们能够在批准后迅速为硬纤维瘤患者和医生提供药品。”
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容



