3月7日,Ionis Pharmaceuticals宣布FDA已接受反义寡核苷酸(ASO)药物Eplontersen的新药申请(NDA),用于治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变多发性神经病变(ATTRv-PN),PDUFA日期定为2023年12月22日。ATTR心肌病和多发性神经病是由衰老或基因突变引起的进行性全身性疾病,因TTR蛋白错误折叠并在心肌和周围神经中积聚为淀粉样蛋白原纤维,TTR原纤维的存在会干扰这些组织的正常功能。ATTRv-PN可在确诊后五年内导致周围神经损伤并伴有运动障碍,如果不进行治疗,通常在十年内致命。在世界范围内,约有4万例ATTRv-PN患者。
Eplontersen(IONIS-TTR-LRx),是一种配体偶联反义 (LICA) 药物,旨在减少血清转甲状腺素蛋白(TTR)的产生,以治疗遗传性和非遗传性ATTR,该疗法曾于2022年1月获FDA授予的孤儿药资格。2021年12月,阿斯利康与Ionis签订合作协议,以共同开发和商业化反义寡核苷酸(ASO)药物Eplontersen,总交易金额为35.85亿美元。
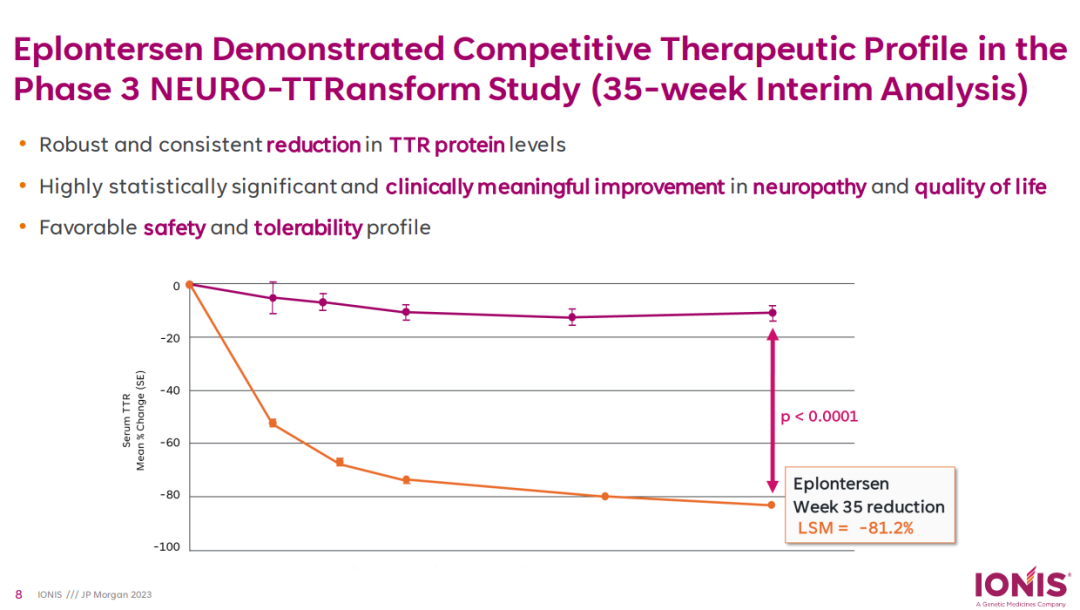
为期35周的III期NEURO-TTRansform研究中期分析结果显示,接受Eplontersen治疗后患者的血清转甲状腺素浓度较基线平均降低了81.2%(p<0.0001),Eplontersen治疗组改良的神经病变损伤评分+7(mNIS+7,一种衡量神经病变进展的指标)评分相较外部安慰剂组也具有显著统计学差异(p<0.0001),达到了共同主要终点。该研究还达到了次要终点:Norfolk生活质量问卷-糖尿病神经病变(Norfolk QoL-DN)较基线的变化,表明与外部安慰剂组相比,Eplontersen显著改善了患者报告的生活质量(p<0.0001)。在研究中,Eplontersen表现出良好的安全性和耐受性。新闻稿提到,FDA未发现任何审查问题,也没有提出任何额外的数据请求,并且不打算召开咨询委员会会议来讨论此次上市申请。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容