
2023-03-14 12:04:50来源:医药观澜浏览量:563

公开资料显示,来凯医药成立于2016年,致力于为全球癌症及肝纤维化患者带来突破性的疗法。该公司核心管理团队包括董事长兼首席执行官(CEO)吕向阳博士,首席医学官岳勇博士和首席科学官顾祥巨博士。成立以来,该公司已先后完成多轮融资,包括2022年5月完成的6100万美元D轮融资。
在开展自主研发的同时,来凯医药还先后与诺华(Novartis)达成多次合作,获得开发、制造及商业化LAE002、LAE001、LAE005及LAE003的全球独家权益。下面,我们将节选来凯医药部分在研创新药项目作介绍。
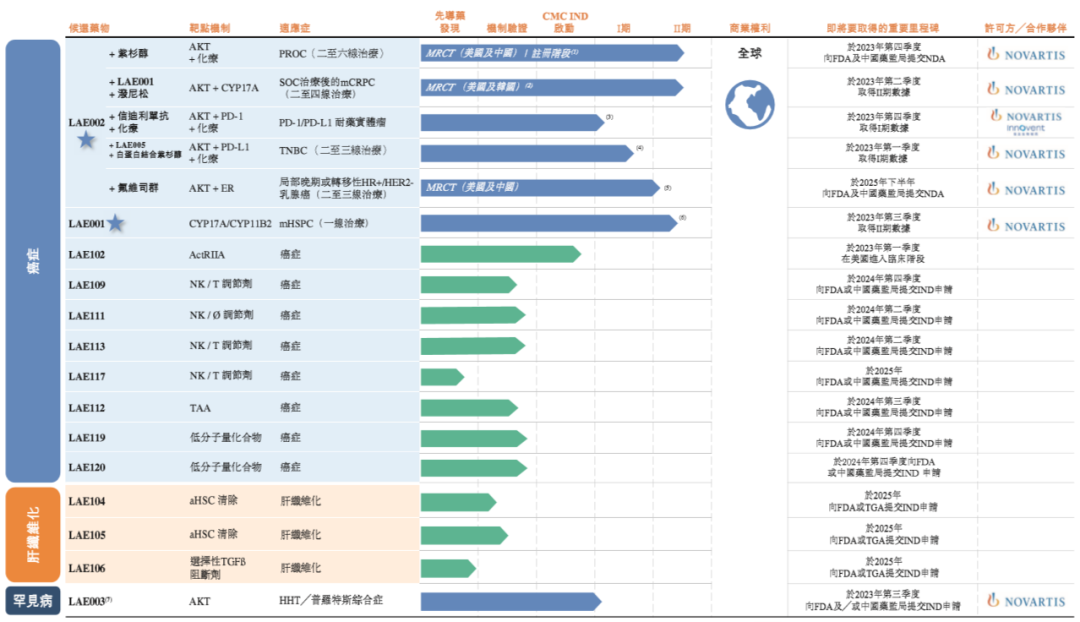
▲来凯医药部分产品管线(截图来源:参考资料[1])
LAE002(afuresertib)是一种三磷酸腺苷(ATP)竞争性AKT抑制剂,拟用于治疗卵巢癌、前列腺癌、乳腺癌及PD-1/PD-L1抑制剂耐药实体瘤。AKT通路活性的上调与许多癌症中的标准疗法(SOC)耐药性有关,AKT抑制剂已在众多临床研究中证实其改善耐药性的能力。来凯医药已在美国及中国启动了针对LAE002联合紫杉醇治疗铂耐药卵巢癌(PROC)的全球国际多中心2期注册试验。该公司的目标是于2023年第四季度向美国FDA及中国国家药监局(NMPA)提交NDA。
此外,来凯医药还在开展LAE002的多项临床试验。其中包括针对转移性去势抵抗型前列腺癌(mCRPC)的2期国际多中心临床试验、针对三阴性乳腺癌(TNBC)的1/2期临床试验、针对HR+/HER2-局部晚期或转移性乳腺癌的1b/3期临床试验、针对PD-1/PD-L1抑制剂耐药性实体瘤的1/2期临床试验等。
LAE001是一款雄激素合成抑制剂,可同时抑制细胞色素P450家族17亚族A成员1(CYP17A1)及细胞色素P450家族11亚族B成员2(CYP11B2),拟用于治疗前列腺癌。已完成的1期研究显示出在不使用泼尼松下,LAE001单药疗法的安全性、初步抗肿瘤功效及对转移性去势抵抗型前列腺癌(mCRPC)患者的潜在临床益处。目前,来凯医药正进行LAE001单药疗法用于治疗mCRPC的2期临床试验。该公司还计划于2023年第四季度在中国及美国开始转移性激素敏感型前列腺癌(mHSPC)的3期国际多中心注册试验。
LAE005是一种高亲和力、阻断配体的人源化抗PD-L1 IgG4抗体。在临床前研究及临床研究中,该产品证实了其对PD-L1的结合亲和力并具有抗肿瘤活性。目前,来凯医药正评估LAE002与LAE005联合疗法对三阴性乳腺癌患者的治疗潜力。该公司计划于2024年第一季度在中国启动该产品的2期研究。
LAE003是一种ATP竞争性AKT强效抑制剂。在临床前研究中,该产品对AKT1、AKT2和AKT3表现出有效性及选择性。目前,LAE003肿瘤适应症已处于临床阶段,来凯医药正在将其重新用于治疗罕见病——遗传性出血性毛细血管扩张症(HHT)和普罗特斯综合症。
LAE102是来凯医药自主研发的一款治疗癌症的候选药物。这是一种强效及选择性的activin受体IIA型(ActRIIA)单克隆抗体,在临床前动物模型中显示出抗肿瘤活性及增加荷瘤动物体重的能力。
LAE105是来凯医药自主研发的一款治疗肝纤维化的候选药物,针对活化肝星状细胞(aHSC),并已进入机制验证临床前研究。
此外,来凯医药在研管线还有多款自主研发的针对肿瘤和肝纤维化的在研管线。限于篇幅,此处不再一一介绍。
[1]来凯医药招股书. Retrieved Mar 13 , 2023. From https://www1.hkexnews.hk/app/sehk/2023/105223/documents/sehk23031301153_c.pdf
[2]来凯医药官网. From https://www.laekna.com/about#aboutlaekna
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容