
2023-03-20 13:43:33来源:医药魔方浏览量:522
创响生物2023年3月20日宣布,与合作伙伴瑞典Affibody公司及美国ACELYRIN公司共同开发的IL-17A融合蛋白拮抗剂izokibep (IMG-020) 在治疗中重度化脓性汗腺炎 (hidradenitis suppurativa, HS) 的临床IIb/III期研究数据在美国皮肤病学会(AAD)年会发表。
HS是一种自身免疫性疾病,以外分泌腺的炎症化脓为特征,该疾病会导致皮肤脓肿、疼痛、瘢痕、恶臭等,严重影响患者的生活质量。根据公开文献,HS患病率报告差异较大,欧美人群报告患病率为0.05%~4.1%,男女比例约为1∶3,30%~ 40%患者有家族史;亚洲人群的患病率为0.04%~0.06%,男女比例为(1.6~2.5)∶1。
该临床试验是一项评价izokibep有效性和安全性的关键性IIb/III期研究,包括A部分(开放标签试验)和B部分(随机、双盲、安慰剂对照研究)。在A部分中,izokibep治疗12周后HS临床反应(HiSCR)显著增高,其中脓肿和炎性结节总数量100%减少(HiSCR100)的受试者高达33%,超越了既往其他产品的治疗效果。B部分正在进行。
该研究在美国9个中心共纳入30例受试者,接受每周160毫克的izokibep皮下注射。在治疗12周后,脓肿和炎性结节减少至少50%(HiSCR50),75%(HiSCR75),90%(HiSCR90)和100%(HiSCR100)的患者比例分别为71%,57%,38%和33%,目前尚未有其他药物在这个治疗时间段内达到如此高的疗效。
此研究的临床安全数据与之前的izokibep研究和整个IL-17A拮抗剂类药物的安全性特征一致,最常见的不良事件为局部轻度至中度注射部位反应(ISRs)。本研究中没有发生念珠菌感染,也没有证据显示治疗后感染风险增加。基于此积极结果,HS的第二个全球多中心III期关键性临床试验将加速启动。
创响生物首席医学官陆雨芳博士表示:“我们很高兴看到izokibep在治疗中重度HS患者中展现了非常好的临床有效性。12周治疗HiSCR100反应率达到了33%,是至今报道的最佳临床效果。结合目前获得的在治疗HS和银屑病关节炎等各类适应症的临床数据,我们认为izokibep具有同类最优的潜力,我们期待izokibep为患者带来福音。”
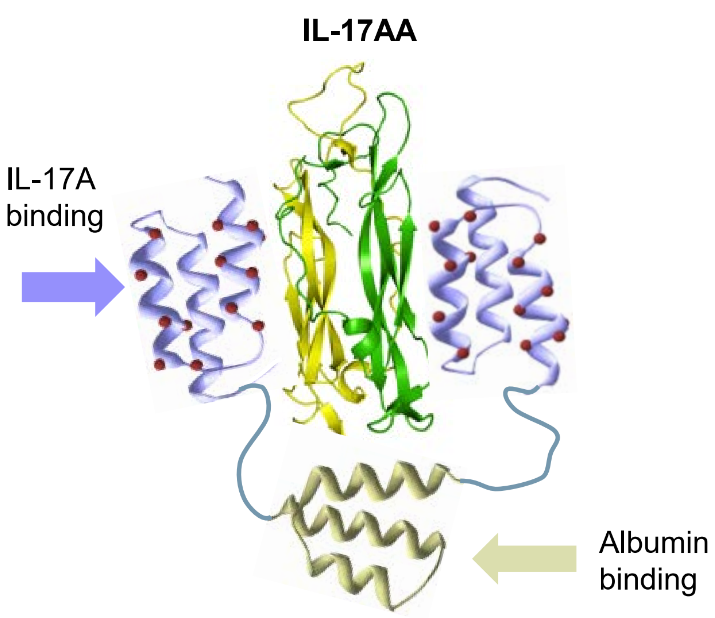
Izokibep作用机制(来源:创响生物官网)
Izokibep是一种创新的双特异性融合蛋白,可有效靶向IL-17A和血清白蛋白。迄今为止,izokibep已在众多临床试验中被用于多种免疫学适应症,包括HS、银屑病关节炎(PsA)、中轴型脊柱关节炎(axSpA)和葡萄膜炎(Uveitis),已有近500例患者接受了izokibep的治疗,其中大多数患者用药已愈三年多。在临床试验中,izokibep耐受性良好,其安全性与整个抗IL-17A类药物一致。
Izokibep的设计旨在克服抗体类药物的局限性,其分子量是普通抗体的约1/8,对IL-17A的表观亲和力是典型IL-17A抗体的大约1000倍。Izokibep皮下注射能达到一般抗体药物需要静脉注射才能达到的药物暴露水平,更小的分子量使其更可能到达抗体无法到达的目标组织。另外,izokibep在人体内与白蛋白特异性结合,因此有类似抗体的半衰期,并可能随白蛋白在病灶富集。Izokibep在大肠杆菌系统中生产,据估算,在量产阶段,其单位剂量的生产成本或显著小于典型抗体药物(一般在哺乳动物细胞系中生产)。
创响从Affibody引进了izokibep的大中华区及韩国的商业化权益,并有权获得在全球其他地域中的里程碑付款和销售分成。创响正与合作伙伴Affibody及ACELYRIN积极配合,在全球共同推进五个适应症的临床开发。
参考资料:
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容