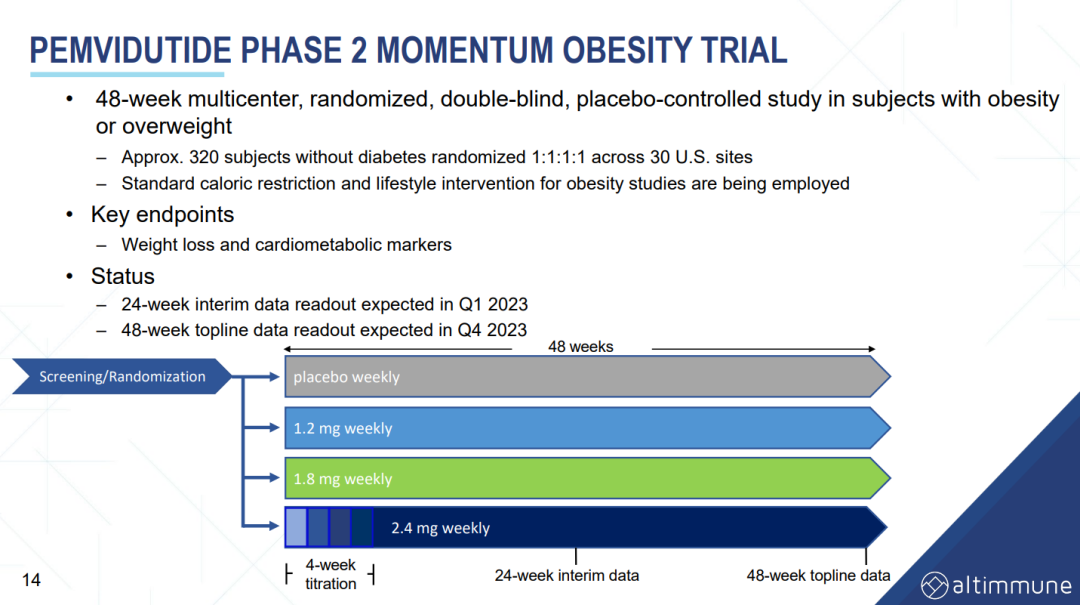
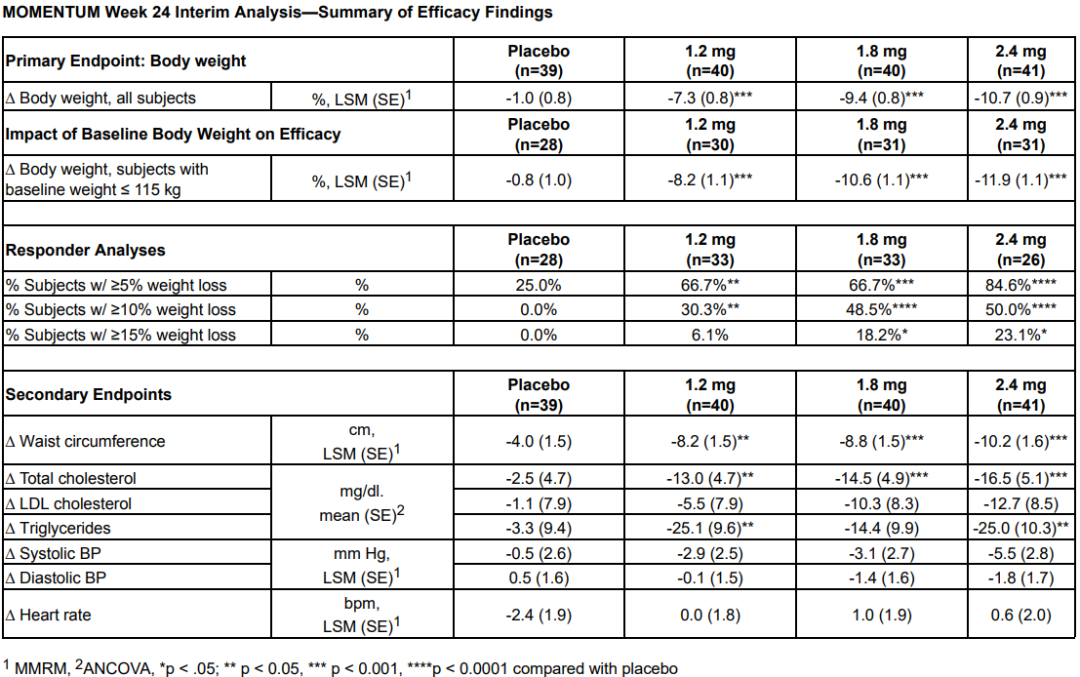
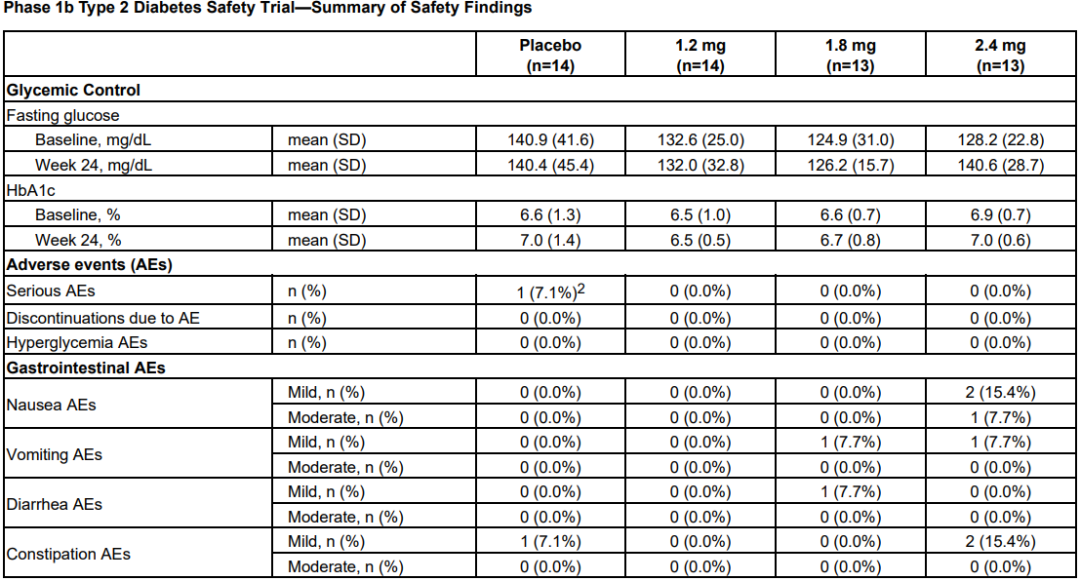
3月21日,Altimmune宣布了GLP-1R/胰高血糖素受体双激动剂pemvidutide用于治疗肥胖的为期48周II期MOMENTUM研究的第24周中期分析结果,以及用于治疗肥胖或超重合并2型糖尿病的为期12周的Ib期安全性试验结果。II期MOMENTUM研究旨在招募约320名患有肥胖或超重,至少有一种共病且无糖尿病的受试者。受试者被随机分配,分别接受pemvidutide 1.2mg、1.8mg、2.4mg或安慰剂治疗,每周用药1次,共48周,同时辅以饮食和运动。在160名受试者完成24周的治疗后,进行了预先指定的中期分析。在第24周,接受pemvidutide治疗的受试者在1.2mg、1.8mg和2.4mg剂量组分别实现了7.3%、9.4%和10.7%的平均体重减轻,而安慰剂组平均体重减轻了1.0%(三种剂量组与安慰剂相比p<0.001)。基线体重≤115公斤受试者(75%的研究人群)在1.2mg、1.8mg、2.4mg和安慰剂组分别实现8.2%、10.6%、11.9%和0.8%的平均体重减轻。接受pemvidutide 1.8mg和2.4mg剂量治疗的第24周,约50%的受试者体重减轻了10%或更多,约20%的受试者体重减轻了15%或更多。受试者腰围(内脏脂肪的一种测量方法)和血脂也有明显的下降,在没有显著增加心率的情况下实现了临床意义上的血压降低。受试者血糖维持稳态,空腹血糖或糖化血红蛋白无明显变化。安全性方面,上消化道(GI)事件恶心和呕吐占不良事件的大多数。严重程度为轻度和中度,与剂量相关,频率与先前试验中观察到相似。下消化道不良反应腹泻和便秘在内的发生率明显较低。一名受试者(2.4%)在2.4mg剂量下出现严重的恶心和呕吐不良反应,需要补液。安慰剂组停药率为28.2%,pemvidutide组停药率为24.0%。Ib期试验旨在评估pemvidutide在超重或肥胖和2型糖尿病患者中的安全性,共纳入了54名受试者,按1:1:1:1随机分组,每周给予pemvidutide 1.2mg、1.8mg、2.4mg或安慰剂,持续12周,无热量限制或生活方式干预。受试者年龄要求为18-65岁,BMI≥28 kg/m2, 2型糖尿病,饮食和运动稳定,服用二甲双胍,无或有轻度GI症状,或接受SGLT-2治疗至少3个月。在为期12周的治疗中,接受pemvidutide 1.2mg、1.8mg和2.4mg治疗的受试者分别实现了4.4%、6.1%和7.7%的平均体重减轻,安慰剂组平均体重增加0.8%。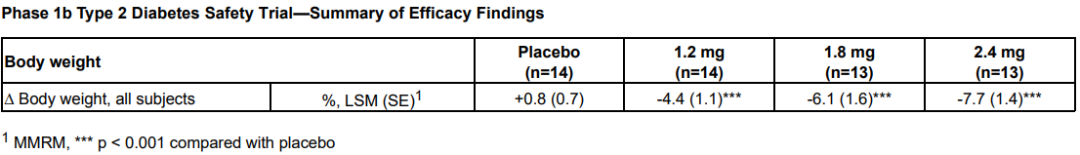
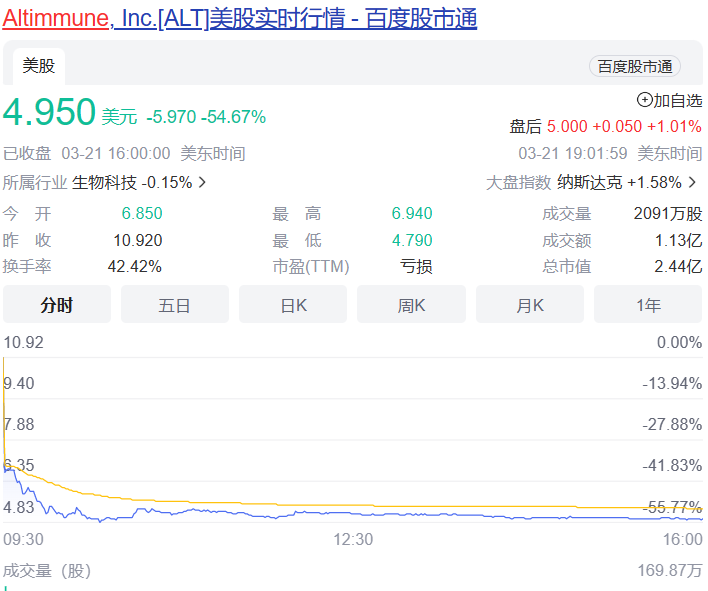
受试者在整个12周的治疗期间葡萄糖维持稳态,空腹血糖或糖化血红蛋白无明显变化,无高血糖不良事件发生。pemvidutide组患者中未观察到任何SAE。胃肠道不良事件发生率较低,没有导致研究中止的不良事件。Pemvidutide(每周1次)1.2mg、1.8mg和2.4mg剂量组虽然在24周分别实现了7.3%、9.4%和10.7%的平均体重减轻,显示出优于安慰剂的效果。不过,与安进每月仅需用药1次,第85天(约12周),低剂量组体重平均减少7.19%,高剂量组平均减重14.52%的first-in-class抗体多肽偶联药物AMG 133相比略显逊色。再加上市场上已有礼来Tirzepatide和诺和诺德司美格鲁肽的竞争,Pemvidutide的表现显然没有让投资人满意,导致该公司股价在消息公布后大跌54%。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容