3月21日, Selecta Biosciences和Sobi公布了两项III期研究(DISSOLVE I 和DISSOLVE II)的积极关键结果。这两项安慰剂对照、随机临床试验旨在评估两个不同剂量水平的SEL-212在成人慢性难治性痛风患者中的安全性和有效性。
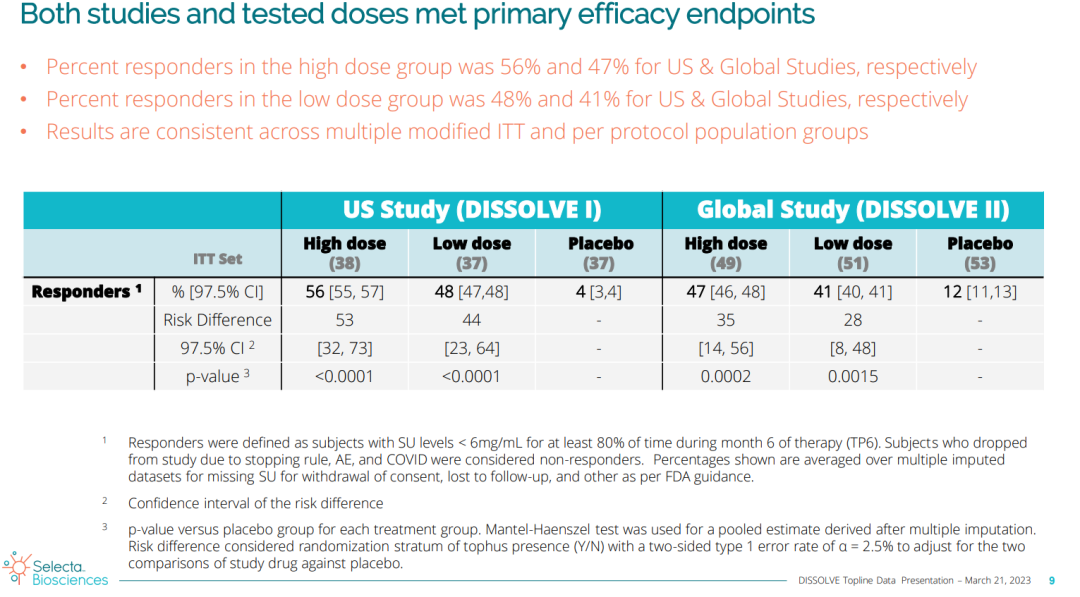
痛风属于自身炎症性疾病,患者因为促炎性尿酸钠(MSU)晶体沉积引发剧烈疼痛和衰弱性炎症性关节炎。慢性难治性痛风患者往往存在高组织MSU负担,可导致痛风频繁发作和慢性关节炎。痛风是美国最常见的炎症性关节炎疾病。Pegsiticase(又名pegadricase,一种可代谢尿酸的重组酶),由三生制药开发,2014年三生制药授权Selecta利用该公司的ImmTOR®免疫耐受平台将其开发成SEL-212。2020年7月29日,Sobi和Selecta宣布,两家公司已就Selecta研发产品SEL -212达成了战略许可协议。根据合作协议,Sobi负责大中华区(包括中国大陆、香港、澳门、台湾)以外所有市场的开发、注册和商业活动,而Selecta则代表Sobi开展III期研究。SEL-212具有降低慢性难治性痛风患者血清尿酸和MSU沉积的潜力。重组尿酸酶在人体内具有高度免疫原性,通过Selecta专有的ImmTOR平台,SEL-212具备了减轻抗药物抗体形成的潜力,从而可以方便的每月给药一次,提高尿酸酶的疗效和耐受性。DISSOLVE I(美国研究)达到了主要终点,接受每月0.15mg/kg剂量和0.1 mg/kg剂量SEL-212治疗的患者中,分别有56%和48%达到缓解标准(定义为在第6个月,至少有80%的时间实现并维持血清尿酸(SU)<6mg/dL),而安慰剂组仅4%患者实现缓解。
DISSOLVE II(全球研究)同样达到了主要终点,接受每月0.15 mg/kg剂量和0.1 mg/kg剂量SEL-212治疗的患者中,分别有47%和41%达到缓解,而安慰剂组这一比例为12%。在50岁及以上的患者中,两项试验中SEL-212高剂量组均实现统计学意义的高应答率;另外,与安慰剂相比,随机接受SEL-212(0.15mg/kg)治疗的患者平均SU水平总体降低69%,具有显著临床意义。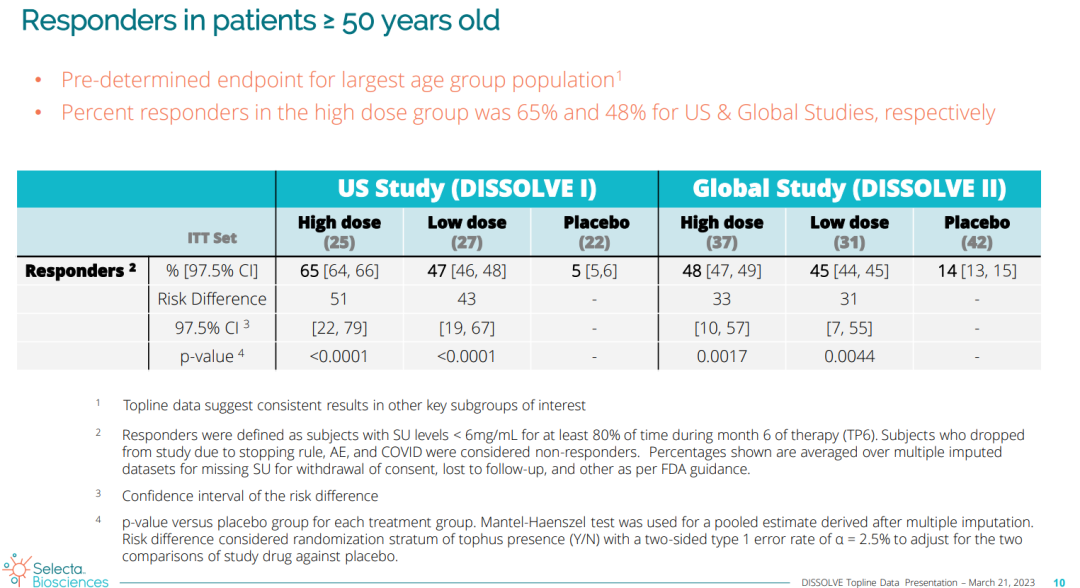
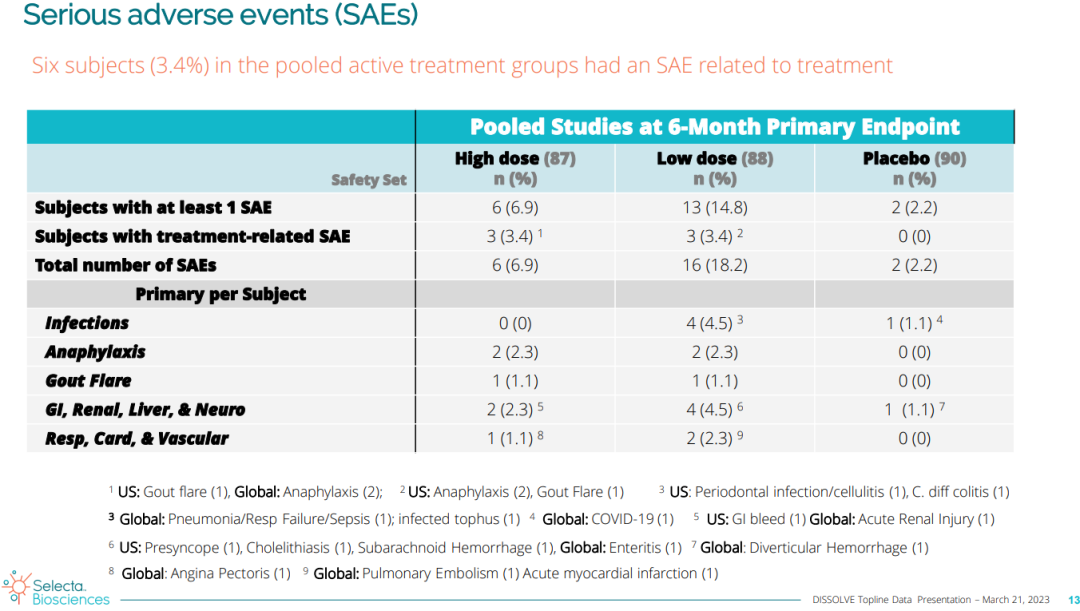
两个剂量的SEL-212均具有良好的安全性和耐受性,试验中出现的不良事件(AEs)是预期内的。在6例患者中观察到与治疗相关的严重不良事件。
该项目获得积极结果意味着SEL-212有可能成为一种新的难治性痛风治疗方案,每月仅需给药一次,Sobi计划于2024年上半年在美国提交上市许可申请。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容