美国生物技术公司Iovance Biotherapeutics近日宣布,已向FDA完成lifileucel生物制品许可申请(BLA)的滚动式递交过程。Lifileucel是一种肿瘤浸润淋巴细胞(TIL)治疗方案,用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。如果顺利获批,lifileucel将成为全球首款TIL细胞疗法。

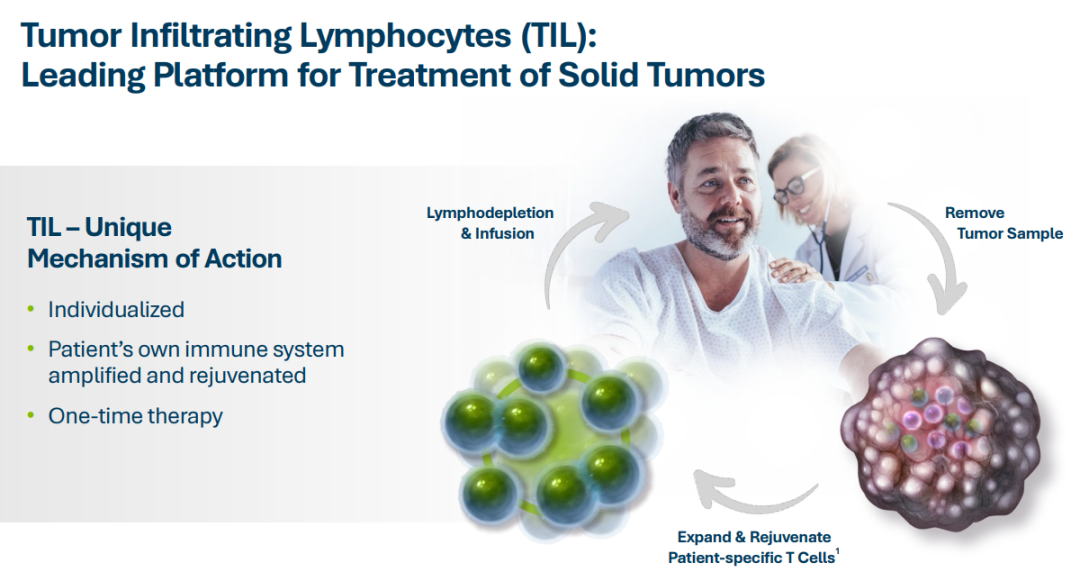
TIL(Tumor Infiltrating Lymphocytes)是肿瘤间质中的异质性淋巴细胞,包括T细胞及NK细胞等。机体在发现体内的癌细胞后,调动免疫细胞深入到肿瘤组织内部,对肿瘤进行识别、抵抗和攻击。TIL细胞到达肿瘤内部后,通过释放细胞毒素直接杀伤肿瘤细胞。此外,TIL还能调节机体免疫功能,提高机体对肿瘤细胞的杀伤能力。
与CAR-T细胞疗法类似,TIL细胞疗法属于过继性免疫治疗的一种。TIL疗法从肿瘤中分离浸润的淋巴细胞,体外扩增后回输给患者,由于存在大量患者抗原特异性的TIL细胞,可以特异性识别患者的癌细胞进行杀伤。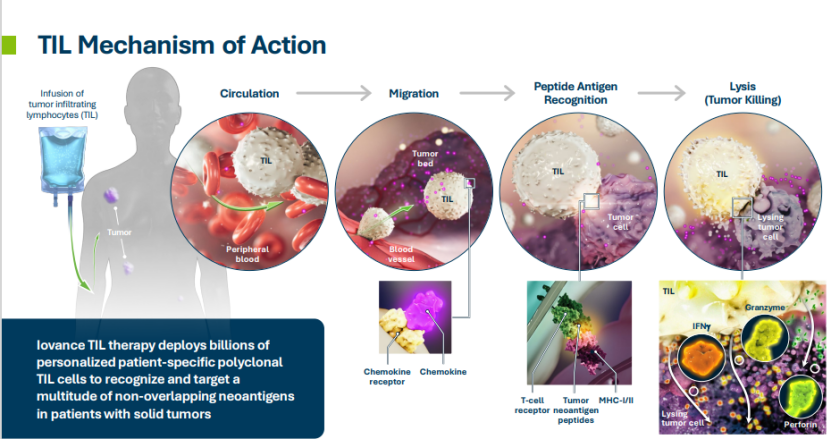
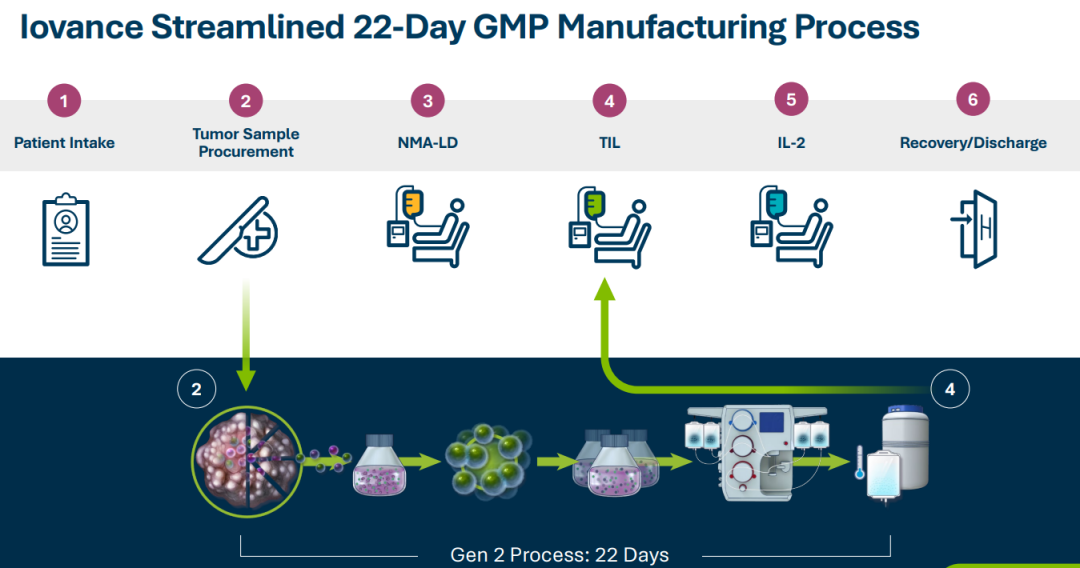
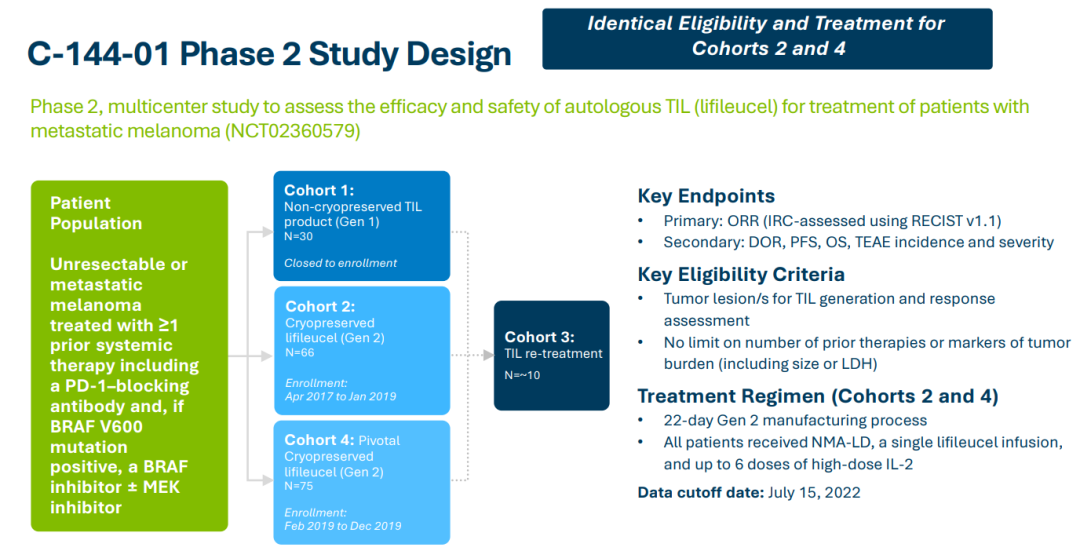
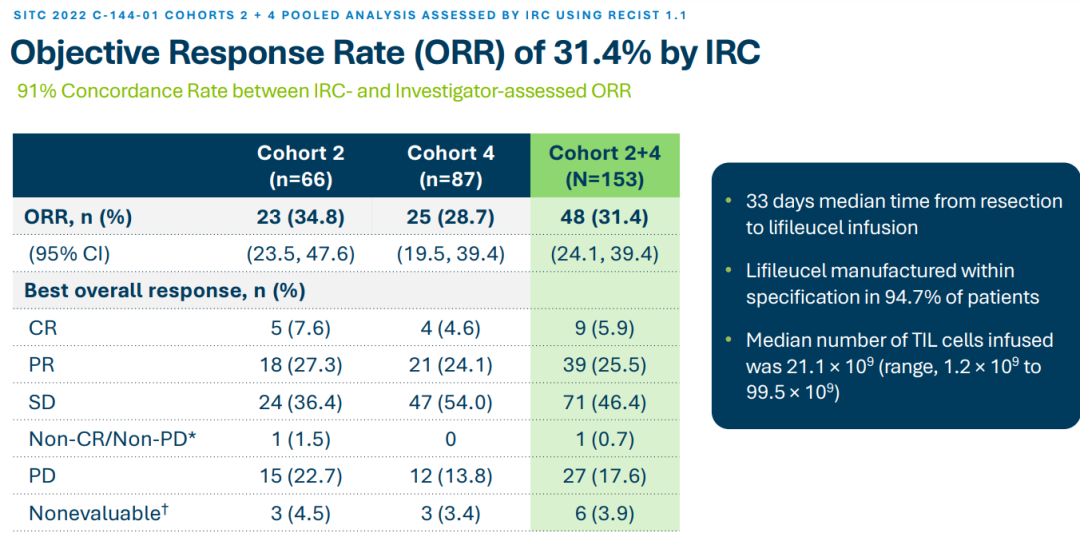
Iovance公司第二代(Gen2)的生产工艺需要22天的制备周期。与此同时,该公司还在探索第3代工艺,有望将制造时间缩短到16天以减少初始肿瘤样本和患者输注之间的等待时间。此次滚动上市申请基于lifileucel治疗晚期黑色素瘤患者的II临床试验C-144-01的阳性结果。C-144-01研究入组患者为既往接受过包括PD-1抗体在内≥1次全身治疗的不可切除或转移性黑色素瘤;如果患者BRAF V600突变阳性,则采用BRAF抑制剂±MEK抑制剂联合治疗。该研究共分为4个队列,其中队列1(n=30)患者接受非冷冻保存的TIL产品治疗;队列2(n=66)和队列4(n=75)患者皆接受经冷冻保存的TIL治疗;队列3(n=~10)为重复接受TIL治疗患者。非冷冻保存的TIL产品(Gen1)是一种不通过冷冻保存的肿瘤浸润淋巴细胞(TIL)疗法。Gen1产品通常用于TIL疗法开发的早期阶段,其中TIL在体外扩增后立即注入患者,因此不需要被冷冻。这与冷冻保存的TIL产品(Gen2)工艺有所不同,后者会被冷冻以备后续使用,以实现长期储存和运输。研究结果显示,经过独立影像学委员会(IRC)评估,队列2的客观缓解率(ORR)为34.8%;队列4的ORR为28.7%;队列2+4的总ORR为31.4%。Iovance还就lifileucel的III期注册试验(研究代号TILVANCE-301)设计方案与FDA达成一致,该试验是将lifileucel与K药联合用于一线晚期黑色素瘤的试验,不仅旨在全面支持lifileucel获批用于治疗PD-1单抗进展后的黑色素瘤患者,同时也是为了支持lifileucel与K药联合用于一线晚期黑色素瘤治疗方案的注册申请。据报道,全球每年约有32.5万新发黑色素瘤患者,其中每年约有5.7万患者因该病死亡;美国每年约有10万人被诊断出患有黑色素瘤,约有7700人死于该疾病。如果获得FDA的批准,lifileucel将成为一种在晚期黑色素瘤治疗中的全新选择。参考资料:
https://ir.iovance.com/node/13541/pdfhttps://ir.iovance.com/static-files/72c94ddb-a9d7-431a-b1c9-66313a213586
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容