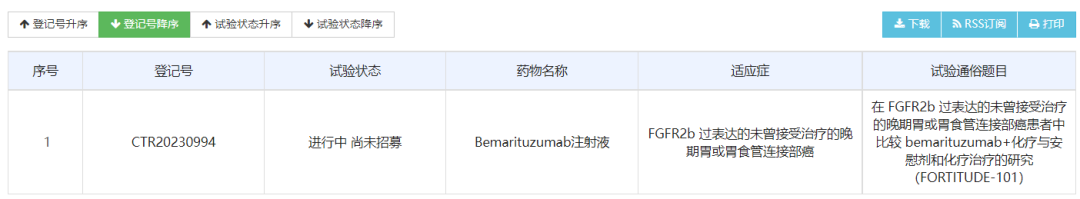
4月3日,药物临床试验登记与信息公示平台官网显示,再鼎医药登记了一项在FGFR2b过表达的未曾接受治疗的晚期胃或胃食管连接部癌患者中比较bemarituzumab+化疗与安慰剂和化疗疗效和安全性的III期研究(FORTITUDE-101)。FORTITUDE-101是一项随机双盲、安慰剂对照的国际多中心III期临床,计划在国内入组48名受试者,国际入组516名受试者。具体给药方案如下图所示,研究的主要终点是总生存期(OS),次要终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DOR)等。Bemarituzumab是一款同类首创的靶向抗体,可阻断成纤维细胞生长因子(FGFs)结合以及激活FGFR2b,从而抑制若干下游致癌信号通路。研究表明,阻断FGFR2b的激活会延缓癌症的进展。FGF/FGFR通路与癌细胞的生长发育有关,FGFR2b是在胃和皮肤等部位上皮细胞中发现的FGFR的一种形式。Bemarituzumab最初由Five Prime Therapeutics开发。2017年12月,再鼎医药引入了在大中华区独家开发和商业化该产品的权益。2021年3月,安进以19亿美元收购Five Prime,囊获了bemarituzumab。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容