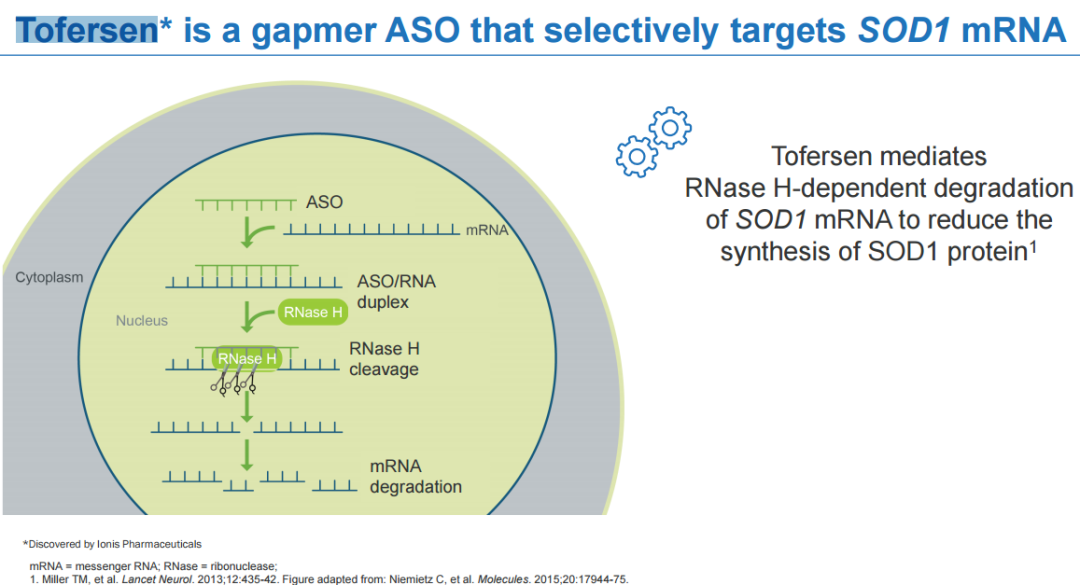
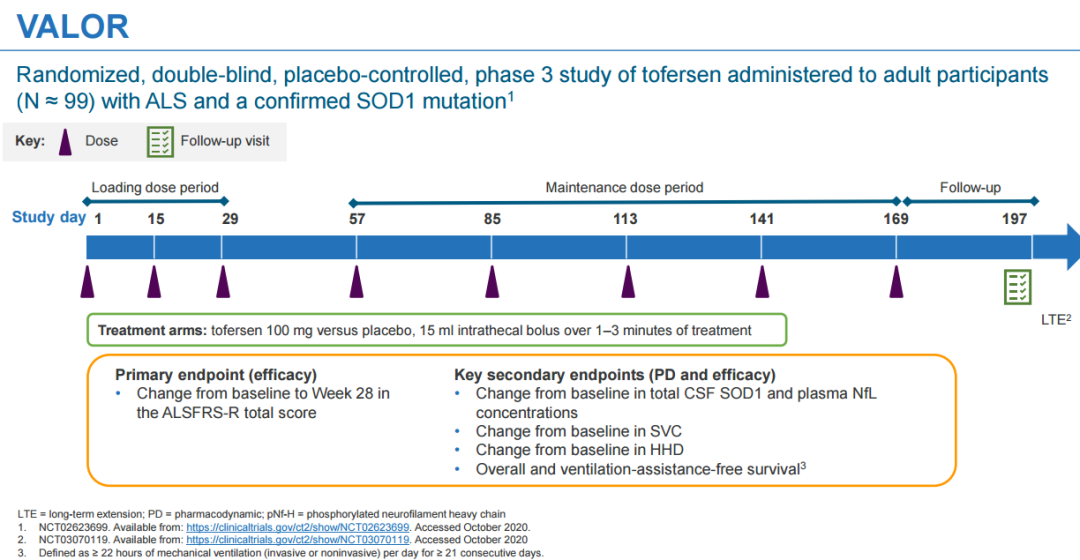
4月25日,渤健/lonis联合宣布FDA已同意加速批准反义寡核苷酸疗法tofersen上市,用于治疗超氧化物歧化酶1 (SOD1)突变所致的肌萎缩侧索硬化(ALS)患者。这是首款针对ALS的基因靶向疗法。该适应症完全批准将取决于目前正在进行的tofersen在症状前SOD1-ALS患者中的III期ATLAS研究。ALS,俗称渐冻症,是一种进行性神经退行性疾病,临床主要表现为进行性发展的骨骼肌萎缩、无力、肌束颤动,患者生存时间平均为3~5年,最常见的死因是呼吸衰竭。SOD1-ALS是ALS的一种罕见遗传性形式,仅占全球约16.8万ALS病例的2%,大多患者疾病进展迅速,发病后生存期不超过3年。Tofersen由渤健与lonis共同开发,是一种用于治疗SOD1-ALS的反义寡核苷酸药物。Tofersen可与编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。2022年7月,FDA受理该产品的上市申请并授予优先审评资格,将PDUFA日期定为2023年1月15日;同年10月,渤健宣布FDA推迟了审批时间,PDUFA延期3个月至2023年4月25日。本次获批上市主要是基于健康志愿者中的I期临床试验、I/II期多剂量爬坡(MAD)临床试验、III期临床试验VALOR以及开放标签扩展 (OLE)的研究结果,同时也包含了近12个月VALOR和OLE研究的整合结果。此前所公布的关键III期VALOR研究并未达到主要终点,进展较快人群中修订版肌萎缩侧索硬化功能评定量表 (ALSFRS-R)评分从基线到第28周变化不具有显著统计学差异(p=0.97)。然而,该研究生物活性和临床功能的多项次要和探索性终点分析显示,疾病进展有减缓的趋势。此外,近期公布的12个月整合性数据显示,早期使用tofersen不仅能持续减少神经丝轻链(NfL,神经元退行性变的一个潜在标志)数目,还能减缓许多疗效终点的下降。在此12个月的数据当中,接受tofersen治疗的患者最常见的不良反应为头痛、操作性疼痛、跌倒、背痛与肢体疼痛等。VALOR和OLE中的大多数AE严重程度为轻度至中度。约有6.7%的患者出现严重的神经性相关事件,包含脊髓炎、神经根炎、无菌性脑膜炎与视神经乳头水肿。神经丝轻链蛋白(NfL)是一种存在于健康神经元中,当神经元或其轴突受损时,大量NfL会释放到血浆和脑脊液中。大量研究表明,NfL是一种神经退行性标志物,可作为神经退行性疾病的替代终点。因此,渤健利用NfL替代终点以寻求FDA加速批准。此前3月,FDA曾在专家咨询委员会上提出几点顾虑,认为NfL水平降低与ALFRS-R评分之间存在相关性,但变化幅度很小;同时,III期VALOR研究没有提供临床结果有利的证据,无法评估是否可以通过生物标志物预测ALS患者的疾病缓解情况。渤健表示,确证性研究正在招募患者,预计2027年获得具体数据。截至目前,FDA已批准4款治疗ALS的药物,除了刚刚获批的tofersen,另外3款分别是上世纪90年代、2017年以及2022年批准的利鲁唑、依达拉奉和Relyvrio(苯丁酸钠和牛磺酸二醇口服固定剂量配方,AMX0035),其中利鲁唑和依达拉奉的效果比较差,对患者生存和症状管理的影响不大。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容