
2023-06-12 09:23:56来源:医药观澜浏览量:824
6月6日,中国国家药监局药品审评中心(CDE)官网公示,安进(Amgen)和百济神州联合申报的1类新药AMG 509获得临床试验默示许可,拟开发用于治疗转移性去势抵抗性前列腺癌。公开资料显示,这是一款可同时靶向STEAP1和CD3的双特异性T细胞结合器,目前正在海外开展治疗去势抵抗性前列腺癌的1期临床试验。

STEAP1(前列腺跨膜上皮抗原1)是一种由雄激素诱导并在前列腺癌中高表达的细胞表面抗原。STEAP1在尤因肉瘤(EWS)中也高度表达,并且受到EWS-FLI1融合蛋白的调控,EWS-FLI1融合是该恶性肿瘤的主要致癌驱动因素。CD3是效应T细胞上的受体,也是T细胞表面的重要标志。通过CD3介导T细胞特异性攻击肿瘤细胞,是T细胞导向的双特异性抗体的主要作用机制。
公开资料显示,AMG 509是一种新型人源化双特异性T细胞募集抗体,能与人、灵长类动物的STEAP1抗原和T细胞表面的CD3受体结合。在结构设计上,安进利用了Xencor公司的Xmab 2+1非对称技术,并且延长了这一蛋白的半衰期。此前,AMG 509已经在研究中表现出显著降低患者前列腺特异性抗原(PSA)水平的活性,它还曾获得美国FDA授予治疗尤因肉瘤的孤儿药资格。根据百济神州官网资料介绍,AMG 509是其与安进合作研发的管线之一,百济神州拥有中国商业化权益。
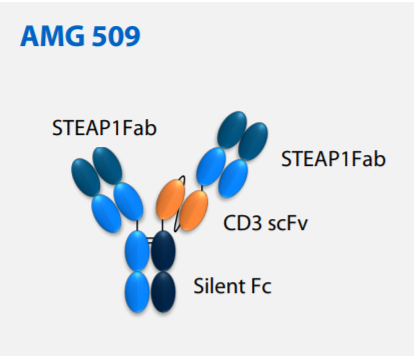
▲AMG 509分子模型(截图来源:参考资料[2])
根据ClinicalTrials网站,目前AMG 509正在开展一项治疗转移性去势抵抗性前列腺癌患者的1期临床试验,目的是评估候选药在成年受试者中的安全性和耐受性,并确定最大耐受剂量(MTD)和2期推荐剂量(RP2D)。
前列腺癌是全球男性常确诊的恶性肿瘤之一。大多数男性在确诊时患有局部前列腺癌,可通过手术或放疗进行治疗。前列腺癌细胞的生长具有雄激素依赖性,故患者最初对雄激素剥夺治疗(ADT)敏感,而经持续ADT后仍然发生疾病进展的患者会发展为转移性去势抵抗性前列腺癌(mCRPC)。据预估,有10%~20%的前列腺癌患者会于确诊后5~7年内发展成为mCRPC。靶向STEAP1和CD3的双特异性T细胞结合器有望为这类患者带来一种新的治疗选择。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容