
2023-08-08 10:31:45来源:药明康德浏览量:531

根据PDUFA的预期目标日期,预计8月,美国FDA将对7款创新药物或疫苗的批准做出监管决定,本文将对这些疗法或疫苗进行相关介绍。
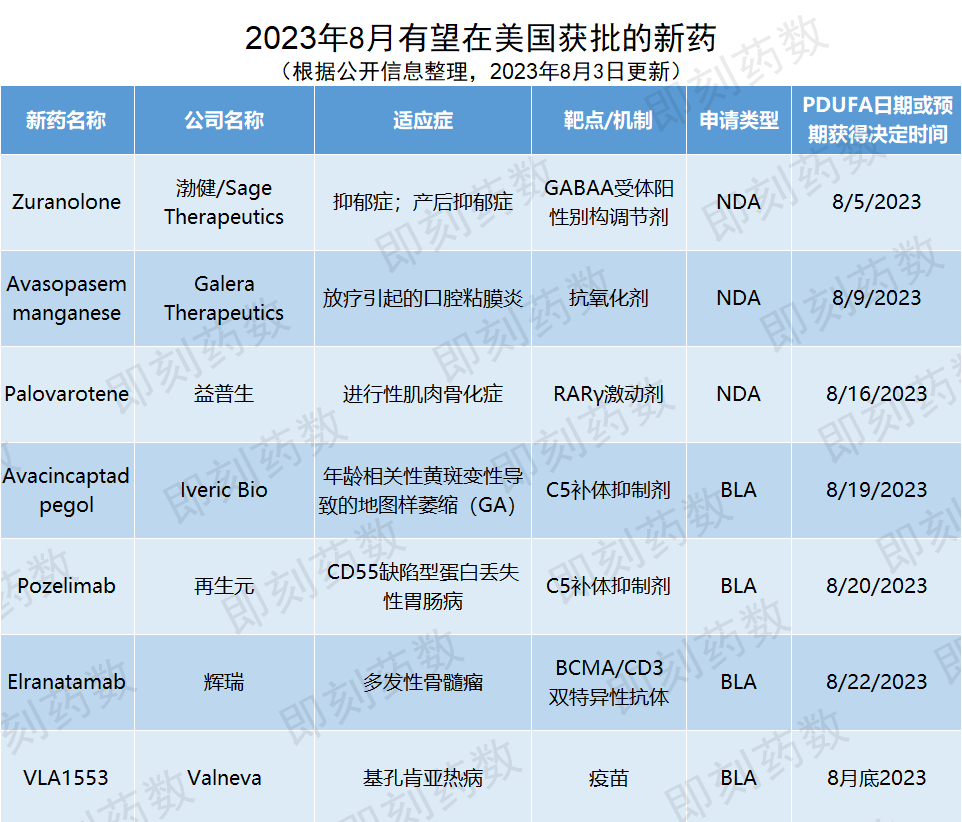
8月有望在美国获批的新药
(数据来源:公开资料,药明康德内容团队制图)
01
Zuranolone

研发机构:渤健,Sage Therapeutics
适应症:抑郁症,产后抑郁症
Zuranolone是一种每日一次、为期两周的在研疗法。它是一种口服神经活性类固醇γ-氨基丁酸A型(GABAA)受体阳性别构调节剂。GABA系统是大脑和中枢神经系统(CNS)的主要抑制性信号通路,对调节CNS功能有重要作用。Zuranolone具在14天快速缓解抑郁症状的潜力,与市面上大部分抑郁药物需要约6-8周才能见效相比,具有差异性。
今年2月,渤健和Sage Therapeutics宣布zuranolone的新药申请(NDA)已获FDA接受并授予优先审评资格,用以治疗抑郁症(MDD)及产后抑郁症(PPD)。在针对MDD的研究中,此前公布的关键性3期临床试验WATERFALL的结果显示,在第15天时,通过17项汉密尔顿抑郁量表(HAMD-17)评估,与安慰剂相比,zuranolone使患者抑郁症状获得统计显著且具有临床意义的减轻(p=0.0141)。在针对PPD患者的SKYLARK试验中,zuranolone达成主要终点以及所有的关键次要终点。试验参与者在第3天开始便有快速与显著的抑郁症状改善,并一直持续至第45天。
02
Avasopasem manganese

公司名称:Galera Therapeutics
适应症:放疗引起的口腔粘膜炎
Avasopasem(GC4419)是一种选择性的小分子歧化酶模拟物,用于治疗局部晚期头颈癌患者因放疗诱发的口腔粘膜炎(SOM)和肺癌患者因放疗诱发的食管炎。FDA已授予avasopasem快速通道资格和突破疗法认定。
今年2月,Galera Therapeutics宣布,FDA已经接受了avasopasem的新药申请并予以优先审评资格,以治疗接受标准治疗的头颈癌患者因放疗引起的严重口腔粘膜炎。此次新药申请的递交是基于两项随机、双盲、安慰剂对照试验(3期试验ROMAN和2b期试验GT-201)的支持,共纳入678名患者。两项试验都证明了患者的SOM疾病负担关键性指标在治疗后出现了具有临床意义的降低,包括SOM发生率和天数、SOM严重程度(4级口腔黏膜炎发病率、不能进食或饮水)的降低,以及SOM发病时间的延迟。
03
Palovarotene

公司名称:益普生
适应症:进行性肌肉骨化症
Palovarotene是一种口服的在研、选择性视黄酸受体γ(RARγ)激动剂。视黄酸受体γ是视黄素信号通路中骨骼发育和异位骨化的重要调节因子。Palovarotene旨在介导视黄素信号传导途径中的受体、生长因子和蛋白质之间的相互作用,以减少新的异常骨骼的形成。
今年7月,益普生(Ipsen)宣布美国FDA的内分泌和代谢药物咨询委员会(EMDAC)投票赞成将palovarotene作为进行性肌肉骨化症(FOP)的有效治疗方法。新闻稿指出,如果获得批准,palovarotene将成为FDA批准的首个治疗FOP的药物。
04
Avacincaptad pegol

公司名称:Iveric Bio
适应症:年龄相关性黄斑变性导致的地图样萎缩
Avacincaptad pegol是一款补体C5蛋白抑制剂在研药物。借由靶向C5蛋白,它具潜力抑制补体系统活化,进而避免视网膜细胞萎缩与地图样萎缩病程的进展。
Avacincaptad pegol已经获得美国FDA授予的突破性疗法认定和优先审评资格。在两项为期12个月的关键性3期临床试验GATHER1与GATHER2中,分别有286与448位患者入组,两试验皆达成预定主要终点。与假性注射相比,药物治疗所引起的主要终点指标差异在GATHER1与GATHER2试验中,分别为35%(p=0.0050)与18%(p=0.0039)。
05
Pozelimab

公司名称:再生元
适应症:CD55缺陷型蛋白丢失性肠病
Pozelimab是一种全人源单克隆抗体,旨在阻断补体因子C5的活性,预防由补体途径介导的疾病。从结构上看,pozelimab是一种IgG4抗体,具有针对野生型和变异型人类补体C5蛋白的高度结合亲和力。
今年2月,再生元公司宣布,FDA已经接受了pozelimab的生物制品许可申请(BLA)并予以优先审评资格,用于治疗成人和1岁以下的CD55缺陷型蛋白丢失性肠病患者。新闻稿指出,如果获得批准,pozelimab将成为这些患者的首个获批疗法。这一申请得到了一项2/3期开放标签临床试验结果的支持。在24周时,所有患者都达到了共同主要终点,患者的血清白蛋白(一种疾病生物标志物)被快速、持续地恢复正常,并且临床症状得到了改善或没有出现恶化。该研究评估的临床症状包括腹痛、每天的排便次数,以及研究者评估的面部和外周性水肿。对次要终点的分析结果显示,患者的住院天数和白蛋白输注总数明显减少,基于年龄段的体重和身高也出现了具临床意义的增加。
06
Elranatamab

公司名称:辉瑞(Pfizer)
适应症:多发性骨髓瘤
Elranatamab是一款靶向B细胞成熟抗原(BCMA)的双特异性抗体。它的一端与BCMA相结合,另一端与T细胞表面的CD3受体结合,从而激活T细胞杀伤表达BCMA的癌细胞。Elranatamab通过皮下注射治疗患者,与静脉注射相较,皮下注射较为方便,并可能减缓如细胞因子释放综合征(CRS)等潜在副作用的发生。
Elranatamab已经获得美国FDA授予的突破性疗法认定和优先审评资格,用于治疗复发/难治性多发性骨髓瘤。在名为MagnetisMM-3的临床2期试验中,队列A(n=123)的数据分析显示,在中位追踪期为10.4个月时,接受每周76 mg elranatamab皮下注射治疗患者的总缓解率(ORR)为61.0%。在出现应答的患者中,有84%的机率可以在第9个月时维持应答。
07
VLA1553

公司名称:Valneva
适应症:基孔肯雅热
VLA1553是一种针对基孔肯雅病毒(CHIKV)的在研、单次注射的活体病毒减毒候选疫苗。它是通过删除CHIKV基因组的一部分而设计的。VLA1553在2018年、2021年和2023年分别获得了FDA授予的快速通道资格、突破性疗法认定和优先审评资格。
今年6月发布在《柳叶刀》杂志上的关键性3期临床试验结果显示,受试者在单次接种VLA1553疫苗28天后表现出非常高的血清反应率,达到98.9%。这种免疫原性在年轻人和老年人中都相似,96%的参与者在接种疫苗后6个月时仍保持血清反应。VLA1553总体上是安全的,在年轻人和老年人中的耐受性均良好。
文章来源:药明康德
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容