随着原研生物药专利到期及生物技术的不断发展,以原研生物药为基础开发的生物类似药进入发展快车道。2016-2020年迎来了单抗生物药的专利到期高峰,全球范围内生物类似药的大市场来临。面对市场机遇的到来,国内企业也积极参与生物类似药的市场研发。
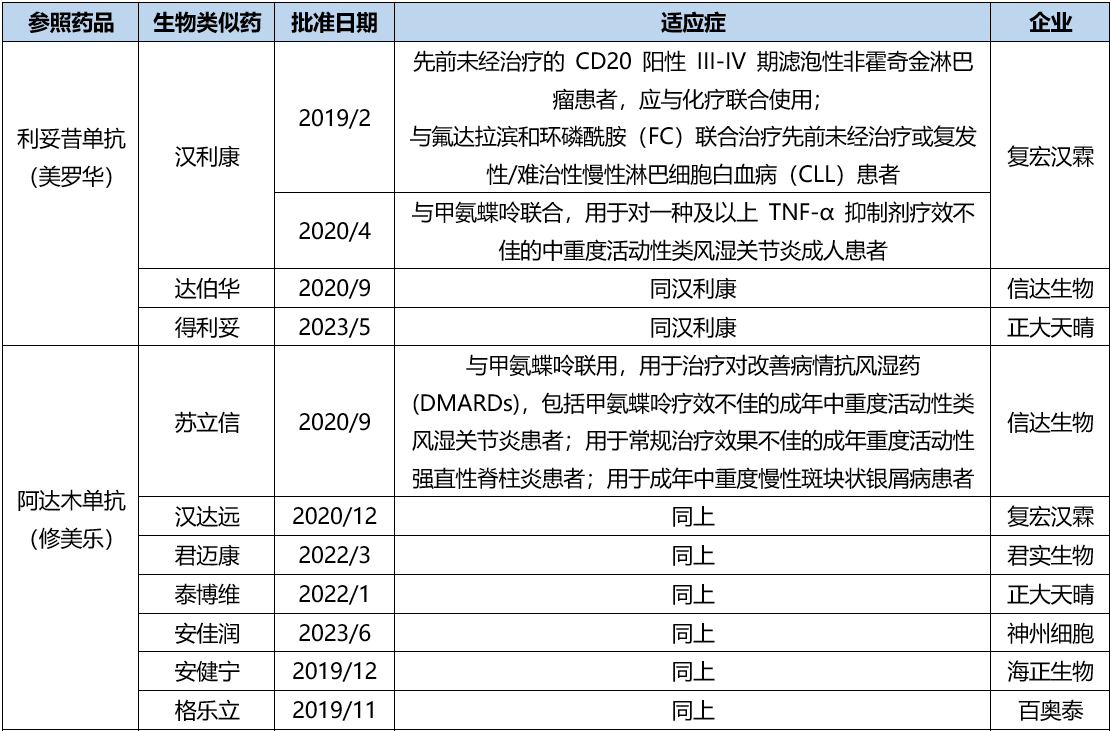
本文将聚焦单抗生物类似药类药物的评审。2019年2月,NMPA批准复宏汉霖的汉利康生物类似药上市,为国内首个批准上市的生物类似药,至今已有29个生物类似药获得批准上市。本文将基于已上市品种的角度,通过案例分析总结生物类似药审评的要点。表1. 单抗类生物类似药上市品种汇总,来源:NMPA,截至2023年6月30日
关于生物类似药的开发可以有两种路径,一是基于适应症外推(适应证外推是指在生物类似药研发中,批准一个没有与原研药进行直接临床比对研究的适应症)的路径进行开发申报,基于原研参照药已在国内获批的适应症;第二是按照2.2类申报,新增适应症。利妥昔单抗由Genentech公司原研,1997年获得美国FDA批准上市,通用名为利妥昔单抗(Rituximab)。2000年在中国上市,商品名为美罗华®,批准的适应症包括:(1)非霍奇金淋巴瘤:先前未经治疗的CD20阳性IV期滤泡性非霍奇金淋巴瘤患者,应与化疗联合使用;初治滤泡性淋巴瘤患者经美罗华联合化疗后,达完全或部分缓解后的单药维持治疗;复发或化疗耐药的滤泡性淋巴瘤;CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。(2)慢性淋巴细胞白血病:与氟达拉滨和环磷酰胺(FC)联合治疗先前未经治疗或复发性/难治性慢性淋巴细胞白血病(CLL)患者。
复宏汉霖、信达、正大天晴的临床开发均进行了I期PK、III期PK、III期有效性和安全性评价,均以利妥昔原研参照药做对比。信达I期PK研究入组的是CD20阳性B细胞淋巴瘤受试者;III期PK研究及有效性和安全性评价中,入组的是弥漫性大B细胞淋巴瘤患者。复宏汉霖I期PK研究入组的是中重度活动性类风湿关节炎受试者;III期入组人群为弥漫大B细胞淋巴瘤(DLBCL)患者。只需证明弥漫大B细胞淋巴瘤(DLBCL)患者人群中,生物类似药与原研参照药具有等效,生物类似药即可批准原研在国内批准的其他适应症。在PK评价和有效性与安全性评价过程中,同时评价免疫原性,免疫原性主要通过检测抗药抗体和中和抗体发生率来评价。另外,复宏汉霖于2020年4月获批新增适应症,基于I期PK(RA患者)与原研对比,以及III期确证性临床(随机、双盲、安慰剂对照)。原研药阿达木单抗注射液最早由美国雅培公司开发,2002年12月获准在美国上市,规格:40mg/0.8ml,商品名:HUMIRA®。目前HUMIRA®已在90多个国家和地区上市。阿达木单抗注射液于2010年首次在中国上市,规格:40mg/0.8ml,商品名:修美乐®。目前已获批适应症包括:类风湿性关节炎、强直性脊柱炎、银屑病、葡萄膜炎、儿童斑块状银屑病、克罗恩病和多关节型幼年特发性关节炎。
国内阿达木单抗生物类似药最先上市的是百奥泰的格乐立,于2019年12月获得NMPA的批准,其后多家生物类似药上市,现已达7家。国内已上市的生物类似药均进行了I期PK、III期PK研究,以及III期有效性与安全性评价。并与原研参照药做对比,考察PK以及临床终点指标是否具有相似性。PK主要指标考察AUC0-t(0-t的药时曲线面积)、Cmax(最大血药浓度),次要评价指标为AUC0-∞(总药时曲线面积)。已上市阿达木单抗生物类似药的I期PK研究均为健康受试者入组,III期PK与有效性和安全性,信达入组人群为活动性强直性脊柱炎患者;正大天晴为活动性强直性脊柱炎患者;君实为RA患者;复宏汉霖为中重度斑块状银屑病患者。贝伐珠单抗(bevacizumab)是由Roche Pharma(Schweiz)Ltd.研发、由中国仓鼠卵巢细胞表达的特异性靶向游离血管内皮生长因子(VEGF)的重组人源化IgG1 单克隆抗体,通过阻断游离VEGF与其受体(Flt-1和KDR)结合,抑制肿瘤新生血管生成,发挥抗肿瘤作用。
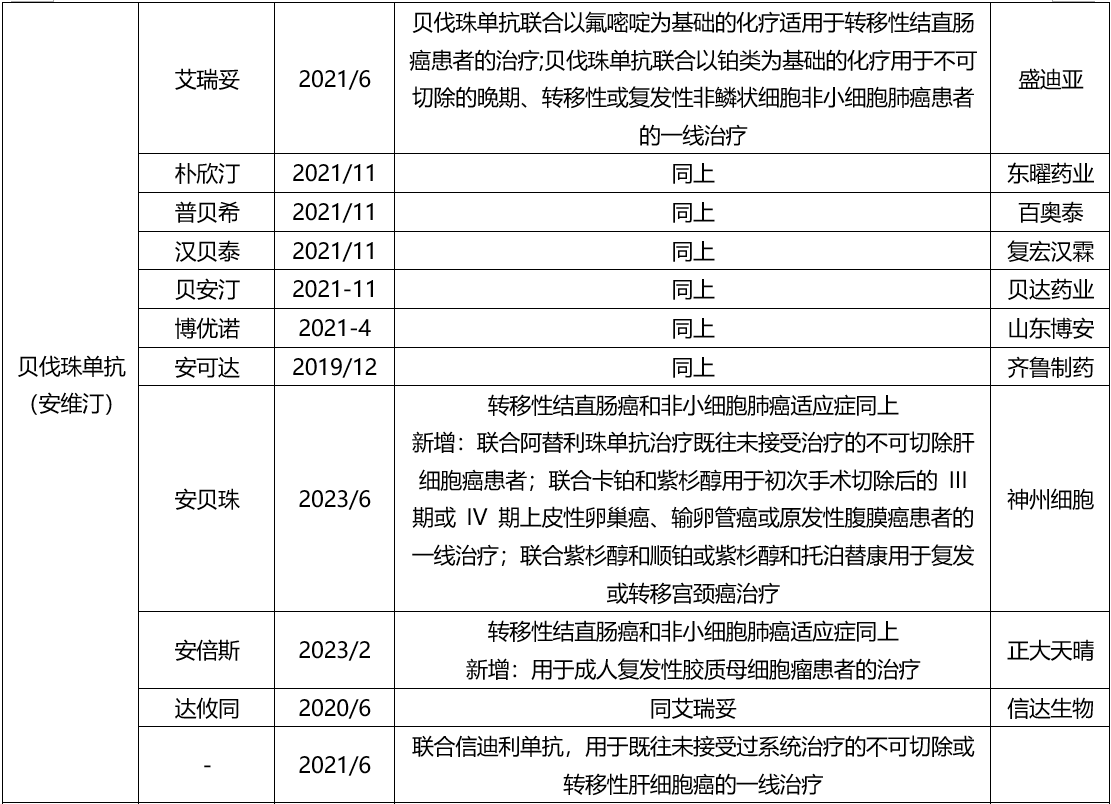
贝伐珠单抗最早于2004年2月获得美国FDA批准,联合以氟尿嘧啶为基础的化疗方案,用于初治转移性结直肠癌(metastatic colorectal cancer, mCRC)的治疗,商品名为Avastin®。截至目前,Avastin®已获美国FDA批准用于晚期非鳞状非小细胞肺癌(non-small cell lung cancer, NSCLC)、mCRC、复发性胶质母细胞瘤、转移性肾癌、宫颈癌和卵巢癌等肿瘤适应症。Avastin®(中国商品名为安维汀®)于2010年2月获中国食品药品监督管理局批准进口注册,适应症为mCRC,后增加非鳞 NSCLC适应症,2020年批准胶质瘤,2021年批准宫颈癌适应症。
国内第一家贝伐珠单抗生物类似药为齐鲁的安可达,现国内已有10家生物类似药批准上市。
已上市的贝伐珠生物类似药的临床开发路径,均是I期PK、III期PK、III期有效性与安全性同原研参照药物的对比评价研究。
I期PK为健康成年人志愿者,III期入组受试者分别为正大天晴:非鳞状非小细胞肺癌,主要终点为18周ORR;信达:晚期或复发性非鳞状细胞非小细胞肺癌;盛迪亚:晚期或复发性非鳞状细胞非小细胞肺癌;山东博安:转移性或复发性非鳞状细胞非小细胞肺癌;海正:非鳞状细胞NSCLC;百奥泰:非鳞状细胞NSCLC;东曜:晚期或复发性非鳞状细胞非小细胞肺癌;复宏汉霖:结直肠癌。
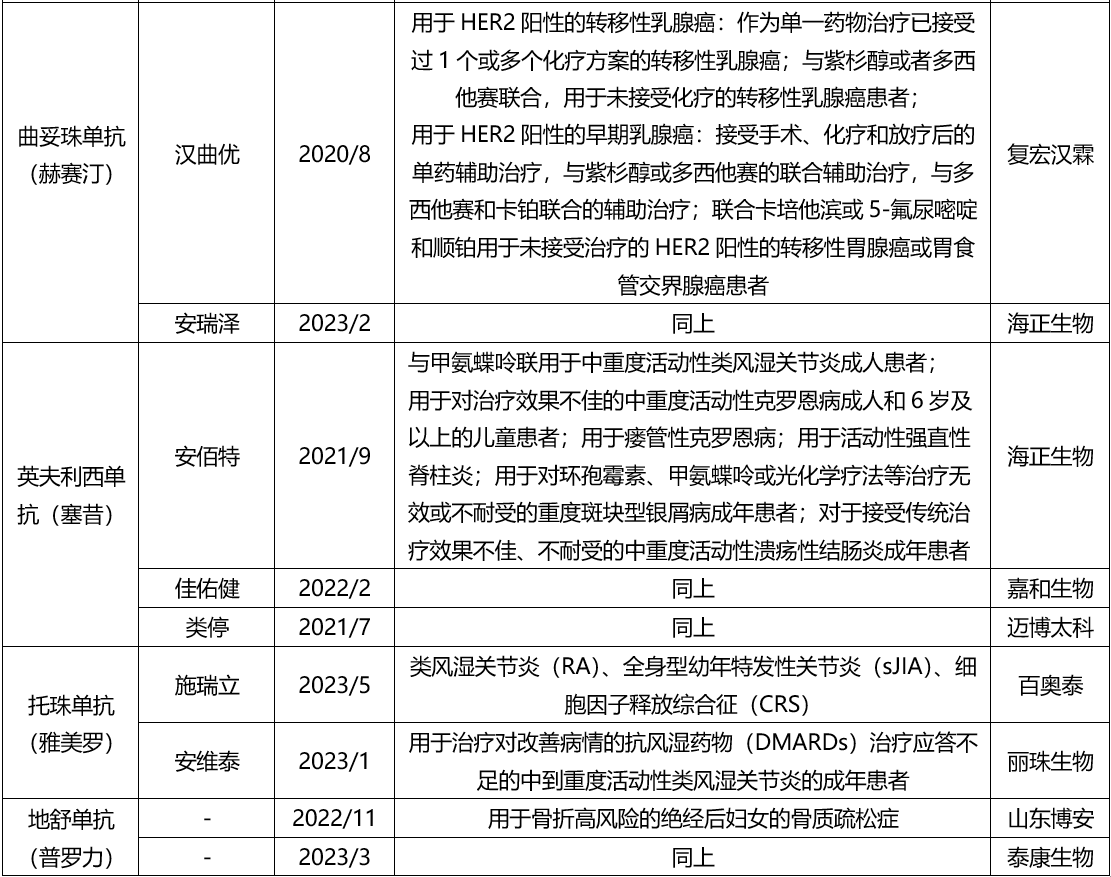
注射用曲妥珠单抗是罗氏公司原研的产品,于2002年9月在我国获得批准应用于单药治疗人表皮生长因子受体-2(HER2)过度表达的转移性乳腺癌,此后于2006年5月获得批准,将适应症延展至联合紫杉醇或者多西他赛,用于HER2过度表达转移性乳腺癌的治疗,在2008年12月获得批准用于HER2阳性的可手术乳腺癌患者的辅助治疗。在2012年8月获得批准用于治疗HER2过度表达的转移性胃癌的治疗。于2018年7月获批乳腺癌辅助治疗适应症下同期联合化疗治疗方案的批准。于2019年1月获批与化疗联合新辅助治疗,继以辅助治疗,用于局部晚期(包括炎性)或者肿瘤直径>2cm的乳腺癌。目前,曲妥珠单抗生物类似药国内批准2家,分别是复宏汉霖和海正。复宏汉霖开展了I期PK研究以及III期有效性与安全性评价,I期入组为健康成年志愿者,III期入组受试者为HER2-过度表达转移性乳腺癌患者。在PK以及有效性与安全性评价的同时,进行免疫原性评价。注射用英夫利西单抗由Janssen Biologics B.V.原研,1998年获得美国FDA批准上市,1999年在欧盟上市,2006年获批进口中国,商品名:类克,规格为100mg/瓶。批准的适应症包括:类风湿关节炎、强直性脊柱炎、成人及6岁以上儿童克罗恩病、瘘管性克罗恩病、银屑病、成人溃疡性结肠炎。
目前,NMPA共批准3家生物类似药上市,分别是海正、迈博太科和嘉和生物。
临床开发路径,I期PK对比研究:迈博太科、海正和嘉和生物均入组健康成年志愿者,III期PK对比研究:迈博太科入组成人中重度活动性类风湿关节炎(RA)患者;海正生物入组中重度斑块型银屑病患者;嘉和生物入组中重度活动性类风湿关节炎患者。PK评价指标均为AUC0-t、Cmax和AUC0-∞,其中AUC0-t为主要评价指标。
III期有效性与安全性对比研究,均以临床终点为指标,与参照药进行对比研究。在PK及有效性与安全性评价过程中,进行免疫原性对比研究。
托珠单抗是一种重组人源化抗人白介素6(IL-6)受体单克隆抗体,可特异性地结合可溶性和膜结合性IL-6受体,并抑制由IL-6受体介导的信号转导。托珠单抗(中国商品名:雅美罗®)自2005年以来,先后在日本、美国、欧洲和中国多个国家和地区上市。目前,在我国已获批用于类风湿关节炎(RA)、全身型幼年特发性关节炎(sJLA)、细胞因子释放综合征(CRS)等适应症。
目前,国内批准2家生物类似药上市,分别是百奥泰和丽珠。临床开发路径均是I期PK、III期PK和III期有效性与安全性对比研究,I期入组为健康成年志愿者,III期入组患者为MTX反应不佳的RA受试者。地舒单抗由安进公司原研开发,2010年在美国和欧盟上市,2020年6月获批在中国上市,商品名:普罗力/Prolia,规格:60mg(1.0ml)/支(预充式注射器),用于骨折高风险的绝经后妇女的骨质疏松症,推荐剂量为60 mg,单次皮下注射,每6个月给药一次。
目前国内有2家生物类似药批准上市,分别是山东博安和泰康生物。
从以上的案例分析总结:生物类似药临床开发路径需进行I期PK、III期PK对比研究,已上市的品种中只有利妥昔单抗I期入组受试者为患者,其余I期入组受试者均为健康志愿者,PK研究的指标为AUC0-t、Cmax和AUC0-∞,其中AUC0-t为主要评价指标,90%CI的范围为80%-125%。III期为基于终点的对比研究,入组患者通常选择一个适应症即可,然后适用适应症外推。
在进行PK研究及有效性与安全性研究过程中,进行免疫原性对比研究,免疫原性主要通过检测抗药抗体和中和抗体发生率来评价。新增适应症则不能基于与原研参照药的对比研究,需进行III期确证性临床。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容