
2023-12-06 10:59:22来源:贝达药业浏览量:695
12月4日,中国国家药监局药品审评中心官网公示,贝达药业从C4 Therapeutics(C4T)引进的1类新药CFT8919片已获得临床试验默示许可,拟开发用于治疗携带EGFR突变的局晚期或晚期非小细胞肺癌(NSCLC)患者。

今年5月,贝达药业达成一项近4亿美元的合作,获得了CFT8919在大中华区开发、制造和商业化的权益。
今年7月,C4T收到了美国食品药品监督管理局签发的《药物临床试验批准通知书》,允许CFT8919片在美国开展Ⅰ/Ⅱ期临床试验。CFT8919片是一种具有口服生物利用度的变构 BiDAC™ 降解剂,对携带EGFR外显子21(L858R)突变具有良好的活性和选择性,同时对T790M或C797S突变的EGFR继发耐药突变有效。
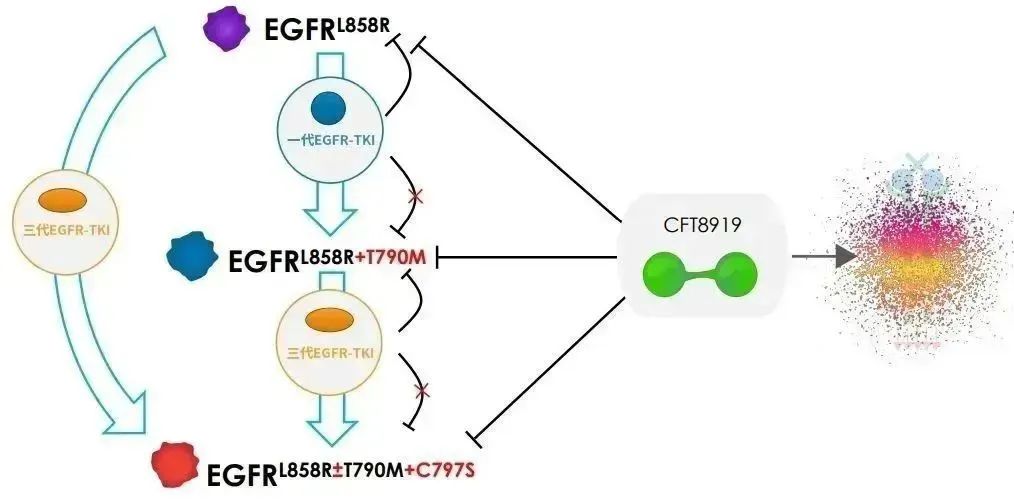
△CFT8919作用机理图(来源:C4T)
今年9月,贝达药业收到国家药品监督管理局签发的《受理通知书》(受理号:JXHL2300237、JXHL2300238),公司从C4 Therapeutics(C4T)引进的CFT8919片携带EGFR突变的非小细胞肺癌患者适应症临床试验申请获国家药品监督管理局受理。
多个大型随机对照试验亚组分析结果显示,一代、二代和三代EGFR-TKI治疗19del和21L858R突变患者显示出了不同的疗效,总体来看,19del突变患者的获益要明显高于21L858R突变的患者。对于携带21L858R突变NSCLC患者,临床上仍存在较大的未满足需求,期待更好的治疗方案。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容