
2023-12-12 14:01:51来源:药方舟浏览量:1137
科笛非那雄胺喷雾剂Ⅲ期临床积极。科笛集团从Polichem公司引进的外用非那雄胺喷雾剂CU-40102在治疗中国男性雄激素性脱发的Ⅲ期临床达到主要和关键次要终点。与安慰剂相比,CU-40102治疗组24周时患者的顶部秃发目标区域内的总毛发计数及终毛计数的统计具有显著性改善,且药物耐受性良好。同日,科笛集团还公布外用4%米诺环素泡沫剂CU-10201治疗非结节性中重度寻常痤疮的Ⅲ期临床积极结果。
1.舒泰神C5a抗体拟纳入突破性品种。舒泰神1类生物药BDB-001注射液获CDE拟纳入突破性治疗品种,用于治疗抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)。BDB-001是一款C5a靶向抗体,能特异性结合C5a,使C5a丧失结合受体的能力,从而阻断其诱导的生物学功能,抑制炎症级联反应,从而控制炎症进一步发展。
2.迪哲JAK1抑制剂淋巴瘤I期临床积极。迪哲医药JAK1抑制剂戈利昔替尼在ASH年会上公布用于治疗复发或难治的外周T细胞淋巴瘤(r/r PTCL)的国际I期临床(JACKPOT8的B部分)积极结果。经独立影像评估委员会(IRC)评估,戈利昔替尼单药治疗达到44.3%的客观缓解率(ORR);中位DoR长达20.7个月;中位PFS为5.6个月;药物安全可控。该项试验研究成果同时刊登在《柳叶刀·肿瘤学》。
3.来凯AKT抑制剂乳腺癌早期临床积极。来凯医药AKT抑制剂afuresertib在SABCS2023年会上公布用于治疗标准治疗失败的局部晚期或转移性HR+/HER2-乳腺癌患者的Ⅰb期研究积极结果。中位随访为11个月时,afuresertib联合氟维司群的总体缓解率(ORR)为30%,疾病控制率(DCR)为80%,中位无进展生存期(PFS)为7.3个月;在中国队列中,确认的ORR为29.4%,DCR为82.4%,中位PFS为7.3个月。此外,药物整体安全性可控。
4.康宁杰瑞HER2双抗ADC获批临床。康宁杰瑞皮下注射HER2双特异性抗体偶联药物JSKN033获得澳大利亚Bellberry临床研究伦理委员会批准开展Ⅰ/Ⅱ期临床试验(JSKN033-101),拟评估JSKN033在HER2表达晚期或转移性实体瘤患者中安全性、耐受性、药代动力学(PK)和初步有效性,并确定最大耐受剂量(MTD),以及Ⅱ期推荐剂量(RP2D)。Ⅱ期剂量扩展阶段将评估JSKN033治疗HER2表达消化道肿瘤的潜力。
5.普方PTK7靶向ADC药物报IND。普方生物1类生物制品注射用PRO1107的临床申请获CDE受理。PRO1107是一款靶向蛋白酪氨酸激酶7(PTK7)的ADC药物,由PTK7抗体与ProfoundBio的新型亲水性MMAE连接物LD343偶联,DAR值为8。在临床前研究中,PRO1107已显示出广泛的抗肿瘤活性和良好的安全性。普方生物计划明年初在美国开展PRO1107的Ⅰ/Ⅱ期临床试验。
6.联拓拒绝Concentra公司收购提案。12月7日,联拓生物董事会一致拒绝Concentra以每股4.30美元加或有价值权利的主动收购报价,该公司认为“该提案低估了联拓的价值,不符合联拓生物和其股东的最佳利益”。Concentra的收购提案包括以每股4.30美元现金加上一项或有价值权利(CRV),获得联拓生物任何项目净收益的80%,并要求在交割时,联拓生物保证账上有不少于5.15亿美元现金及现金等价物。
1.PPARα/δ双重激动剂获优先审评资格。Ipsen与GENFIT公司开发的PPARα/δ激动剂Elafibranor的上市申请获FDA受理,用于二线治疗罕见胆汁淤积性肝病原发性胆汁性肝硬化(PBC)。FDA同时授予其优先审评资格,PDUFA日期为明年6月。在Ⅲ期ELATIVE试验中,与安慰剂相比,elafibranor(80mg)组第52周时达到生化应答的患者比例显著更高(51%vs4%,P<0.001)。该新药也正接受欧洲EMA和英国MHRA的监管审查。
2.诺华CDK4/6抑制剂早期乳癌Ⅲ期临床积极。诺华CDK4/6抑制剂ribociclib联合内分泌治疗(ET)用于HR+/HER2-早期乳腺癌辅助治疗的III期NATALEE研究最新结果积极。与ET方案相比,ribociclib联合治疗降低患者的疾病复发风险25.1% (HR=0.749; 95%CI:0.628, 0.892; p=0.0006) ;药物安全性与之前报告一致。诺华已向欧洲药品管理局提交NATALEE研究数据,并计划在年底前完成向FDA的提交。
3.O药联合治疗结直肠癌III期研究积极。百时美施贵宝PD-1抑制剂Opdivo(纳武利尤单抗)联合CTLA-4抑制剂Yervoy(依匹木单抗)一线治疗MSI-H/dMMR转移性结直肠癌(mCRC)的III期CheckMate -8HW研究达到主要终点。与化疗相比,Opdivo+Yervoy联合治疗显著改善患者的无进展生存期(PFS);药物的安全性与之前报道一致,没有发现新的安全信号。目前,该项试验正在进行,以评估Opdivo+Yervoy组合对比单独Opdivo的PFS差异(另一个主要终点)。
4.FGF21类似物启动NASH 的III期研究。Akero公司启动FGF21类似物Efruxifermin治疗非酒精性脂肪性肝炎(NASH)/代谢功能障碍相关脂肪性肝炎(MASH)和非酒精性脂肪性肝病(NAFLD)/代谢功能障碍相关脂肪性肝病(MASLD)的III期研究试验。在IIb期HARMONY试验中,与安慰剂相比,Efruxifermin(28mg或50mg)治疗组第24周时,分别有39%和41%的患者实现至少一个阶段的肝纤维化改善且NASH没有恶化(vs20%)。
5.G1公司CDK4/6抑制剂乳腺癌II期最新数据积极。G1 Therapeutics公司在SABCS研讨会上公布其CDK4/6抑制剂Trilaciclib(曲拉西利)治疗转移性三阴性乳腺癌(mTNBC)的国际II期试验(G1T28-04)积极结果。中位随访为12.7个月时,Trilaciclib联合化疗与单纯化疗方案相比,患者中位总生存期(OS)显著延长(32.7个月vs12.8个月,P=0.001)。该项研究显示在细胞毒性药物化疗前接受曲拉西利治疗延长mTNBC患者的生存期。
6.RNA编辑寡核苷酸疗法上Ⅰ期临床。Wave Life Sciences公司RNA编辑候选疗法WVE-006在治疗α-1抗胰蛋白酶缺乏症(AATD)的Ⅰ期临床RestorAATion完成首例受试者给药。WVE-006是一款经PN化学修饰、GalNAc偶联、潜在“first-in-class”的RNA编辑寡核苷酸疗法,旨在修正突变的SERPINA1基因的转录物,恢复AAT正常功能,以治疗AATD相关的肝病与肺病。AATD是一种由突变型AAT蛋白积累导致的遗传疾病。
1.预防呼吸道传染病公众佩戴口罩指引印发。12月9日,国家疾控局印发《预防呼吸道传染病公众佩戴口罩指引(2023年版)》,明确应佩戴口罩的五种情形或场景为:新冠病毒感染、流感、肺炎支原体感染等呼吸道传染病感染者前往室内公共场所或与他人近距离接触时;出现发热、咳嗽、流涕、咽痛等呼吸道传染病症状者前往室内公共场所或与他人近距离接触时;呼吸道传染病高发期间,外来人员进入养老机构、社会福利机构、托幼机构等脆弱人群集中场所时;呼吸道传染病高发期间,养老机构、社会福利机构、 托幼机构、学校等重点机构的医护、餐饮、保洁、保安等公共服务人员工作期间。
2.上海市公共卫生科普联盟成立。上海市公共卫生科普联盟近日成立。该联盟由上海市卫健委和上海市疾控局指导,以推动、协调全市公共卫生科学技术普及为主要任务,以提升市民健康素养和助力超大城市公共卫生治理为目标。联盟成员现有16个区疾控中心、高校、公共卫生学院、医疗卫生机构代表、学协会、媒体和其他公益组织等40家单位。
3.河南省人民医院北院区开诊。12月10日,河南省人民医院北院区正式开诊。河南省人民医院北院区位于新乡市平原一体化示范区,医院规划面积约269亩,其中一期建设用地面积165亩,总建筑面积20多万平方米,主要包括门诊楼、医技楼、病房楼、急诊楼、中西医旗舰医院楼等以及相关配套设施,规划床位1300张。北院区按照服务和融入省委科技创新“三足鼎立”战略、立足中原农谷、打造豫北医疗高地的发展定位,纳入河南省人民医院统一管理。
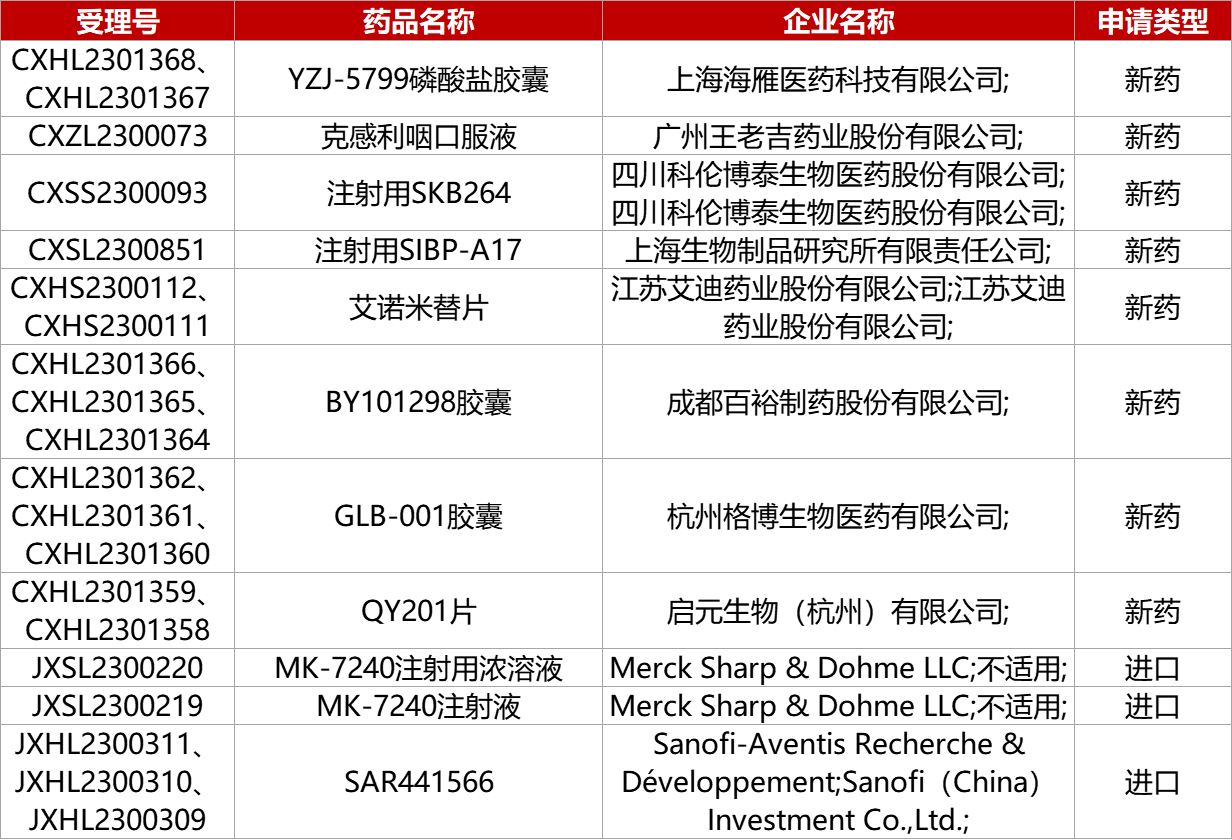
1. CDE新药受理情况(12月11日)
上个交易日 A 股医药板块 +0.97%
[甘李药业]GZR101中国II期临床试验完成首例受试者给药。
【通化东宝]GLP-1/GIP双靶点受体激动剂(注射用 THDBH120)用于2型糖尿病(T2DM)的申报临床获得批准。
[舒泰神](1)取得关于注射用STSP-0601在“不伴抑制物的血友病A或B患者出血按需治疗”适应症的II期临床研究总结报告。(2)全资子公司终止STSG-0002注射液临床试验。(3)STSA-1002注射液(急性呼吸窘迫综合征适应症)IbI期临床试验完成首例受试者给药。
[科伦药业]子公司科伦博泰核心产品SKB264(MK-2870)新药申请获NMPA受理。
- The End -
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容