据悉,这是首款获批的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法。Amtagvi 是一种肿瘤衍生的自体 T 细胞免疫疗法。在治疗前的外科手术中切除患者的一部分肿瘤组织,将患者的T细胞从肿瘤组织中分离出来,进一步制造,然后以单剂量输注的形式返回给同一患者。单剂量的Amtagvi包含7.5亿到72亿个活细胞,从收到肿瘤组织到完成Amtagvi制备大约34天。Amtagvi 2期临床试验显示:在中位随访时间为27.6个月时,患者客观缓解率(ORR)为31.4%,包含8位患者达完全缓解(CR)与40位患者达部分缓解(PR)。后来,Iovance4年随访数据显示,最长缓解持续时间为55.8个月。
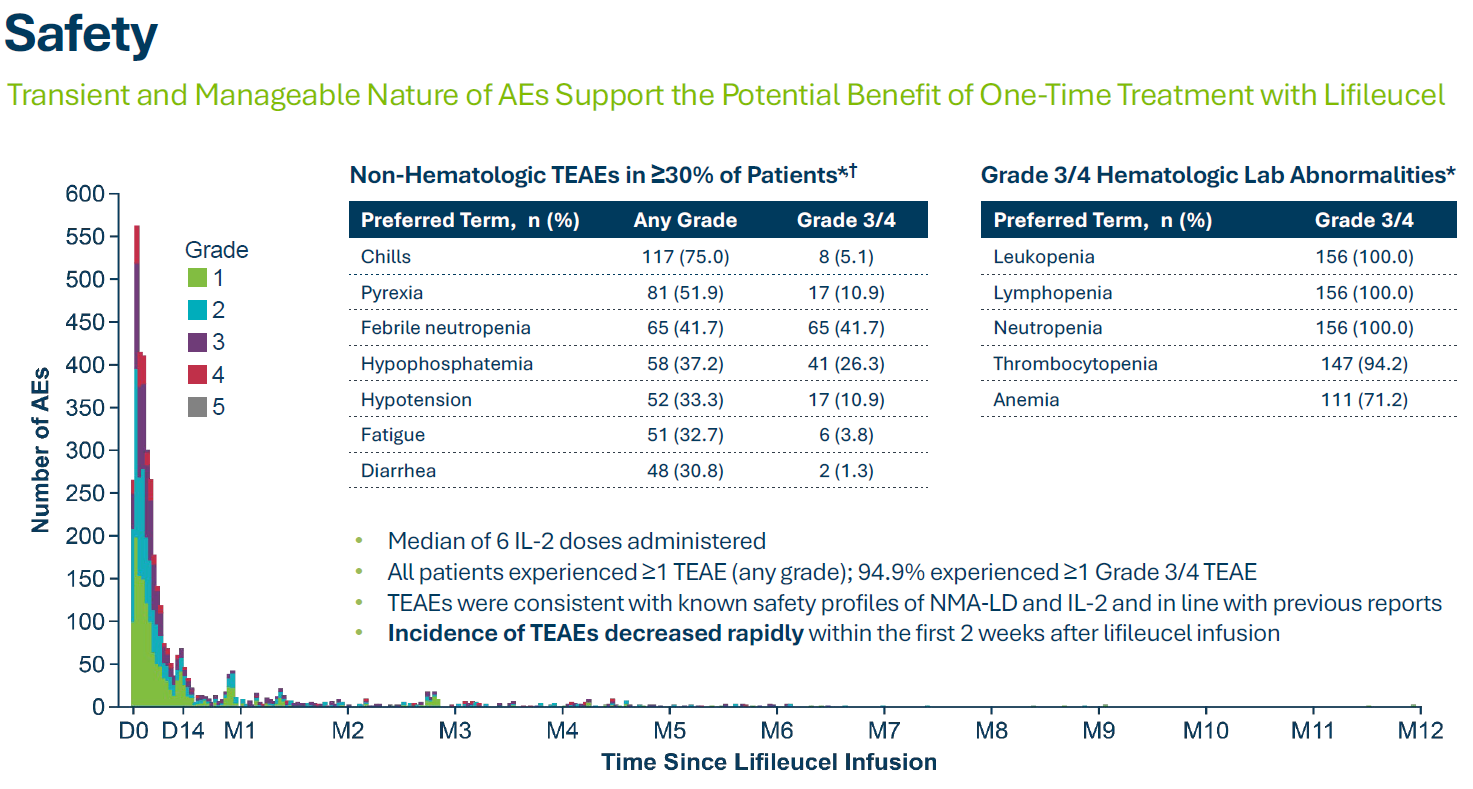
临床试验安全性数据:
在美国,每年约有 8,000 人死于黑色素瘤。到目前为止,对于晚期黑色素瘤,尚无 FDA 批准的治疗方案,这些患者只能接受免疫检查点抑制剂治疗和适当的靶向治疗。由此可见,晚期黑色素瘤存在巨大的未满足的临床需求,Amtagvi的加速批准为这类患者带来突破疗法,同时引领下一代细胞疗法。放眼国内,砂砾生物、循生生物、君赛生物、蓝马医疗、智瓴生物等多家公司布局TIL 疗法,其中砂砾生物进展最快。
关于Iovance BiotherapeuticsIovance Biotherapeutics于2007年9月17日在内华达州成立,是一家新兴的生物技术公司,专注于培养细胞,使用自体肿瘤浸润淋巴细胞(TIL)治疗转移性黑色素瘤等实体瘤的细胞治疗方法的发展和商业化。
研发管线
参考资料:
https://www.iovance.com/clinical-pipeline/





