前两期文章中,鼎泰集团先后对第1款和第2款已上市 siRNA 药物 —— Patisiran(Onpattro®,点击查看原文) 和 Givosiran(Givlaari®,点击查看原文) 的上市历程及临床开发路径进行了复盘分析,并尝试对与临床转化有关的内容进行了总结,为 siRNA 药物运用临床前研究结果指导临床开发,以及制定有助于产品快速上市的研发和药政策略提供了参考和启发。
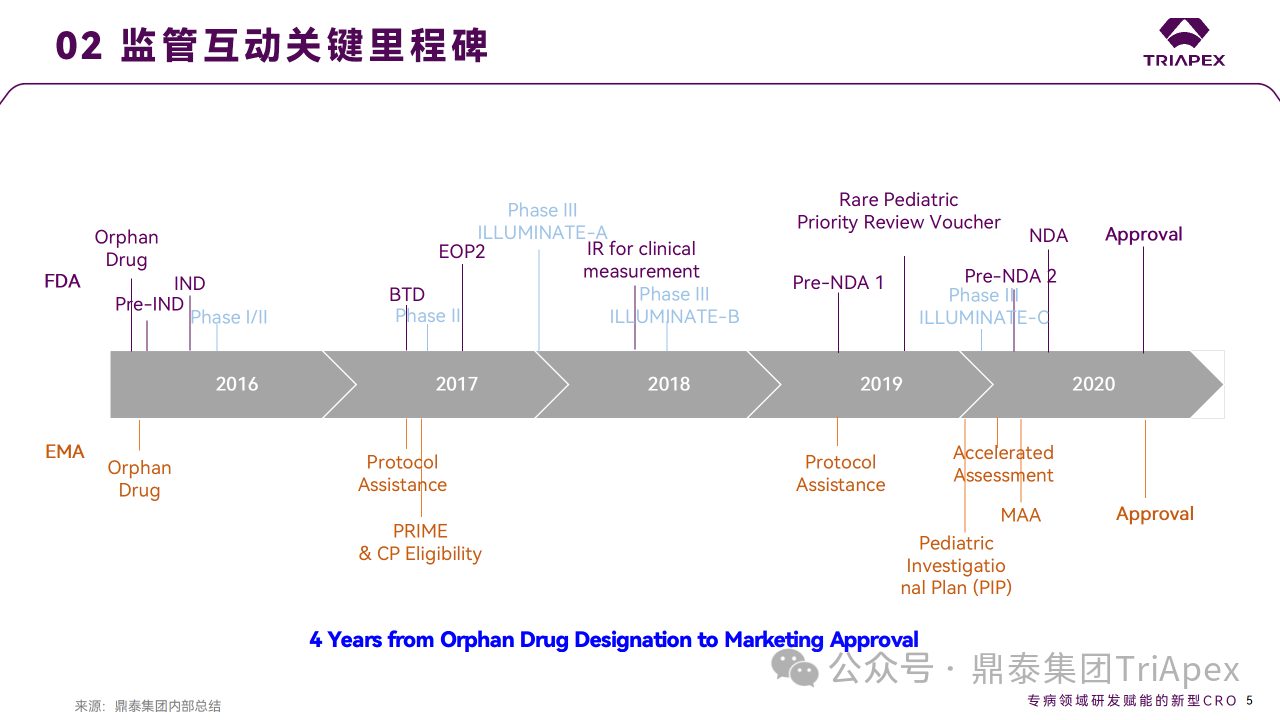
作为第3款获批上市的 siRNA 药物,Lumasiran 从 IND 申请到获批上市同样仅用了4年的时间,并被 FDA 批准同时用于治疗成人和儿童原发性高草酸尿症1型(PH1)。这是 FDA 批准的首款治疗罕见代谢紊乱疾病的药物,再次彰显了 siRNA 药物在治疗罕见疾病方面的巨大潜力。
作为一款同时获批用于成人和儿童患者的 siRNA 药物,Lumasiran 的开发路径与 Patisiran 和 Givosiran 相比有哪些独特之处?在本期内容中将为您揭晓。
| |
| |
| 临床开发路径 关键词:I/II 期无缝隙设计;2项关键III期 |
| 监管互动里程碑 关键词:EOP2;幼龄动物研究;致癌性研究 |
| |
| |
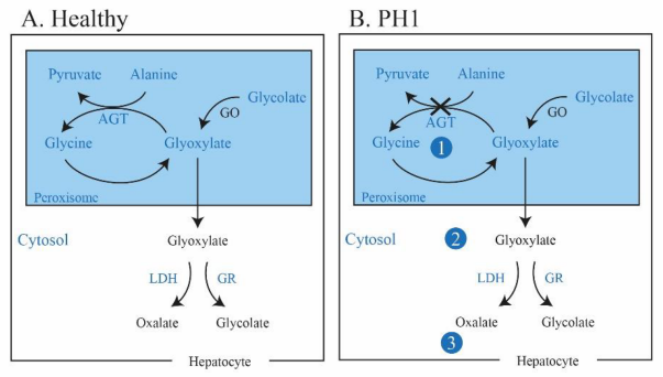
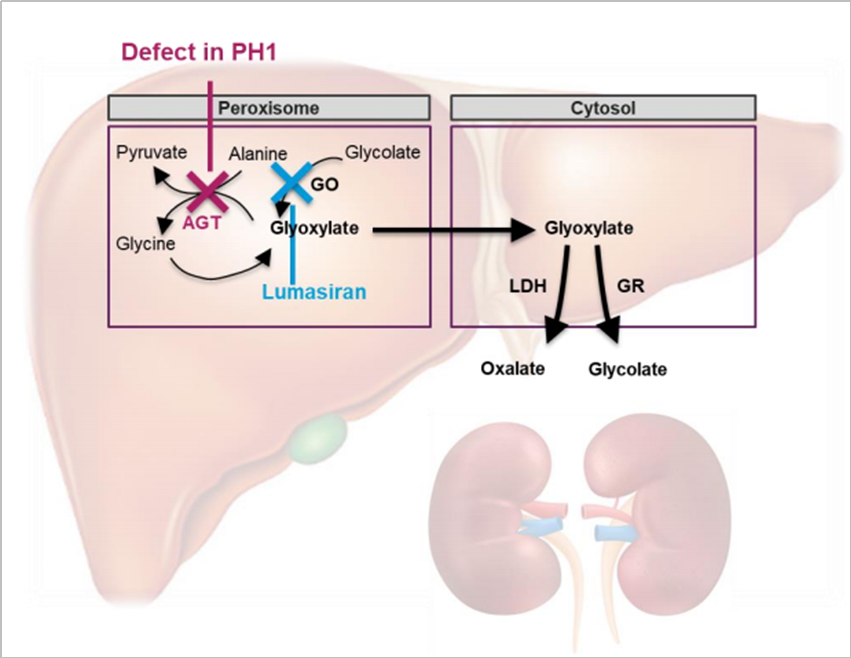
原发性高草酸尿症1型(PH1)是一种罕见的进行性常染色体隐性遗传病,由肝脏过氧化物酶丙氨酸-乙醛酸氨基转移酶(AGT)缺乏引起,其特征是肝脏草酸生成增加。当 AGT 功能降低或缺乏时,乙醛酸不能代谢为甘氨酸,过量的乙醛酸积聚并转化为草酸和乙醇酸。肝脏产生的草酸输送到肾脏,并通过尿液排泄,导致高草酸尿症。在肾脏中,过量的草酸与钙结合形成晶体,导致肾钙质沉着症、肾结石和进行性肾脏病,最终导致肾衰竭。PH1 是原发性高草酸尿症的最严重形式,约占原发性高草酸尿症确诊病例的80%。在欧洲,PH1 患病率为1~3例/100万,遗传患病率可能高出2~6倍,近亲结婚还会进一步增加该病的患病率[1]。PH1 患者通常在儿童时期出现肾结石、肾钙质沉着症、终末期肾病或全身性草酸沉积(血浆草酸水平充分升高)等。PH1 中的尿草酸水平是进展为终末期肾病的主要决定因素。目前 PH1 的治疗选择有限。水化(hyperhydration)、大剂量维生素 B6(AGT 的辅酶)和草酸钙结晶抑制剂(如柠檬酸盐)可降低肾结石的发生率并减缓疾病进展。尽管采取了这些干预措施,许多患者仍有严重和危及生命的表现。肝移植可改善 PH1 患者的草酸代谢过量,但有重大风险和并发症,包括终身免疫抑制[2]。
2020年11月19日,EMA 批准了 Lumasiran 用于所有年龄组 PH1 的治疗。2020年11月23日,美国批准 Lumasiran 用于成人和儿童患者 PH1 的治疗,为全球 PH1 患者带来新希望,同时也将为 RNAi 疗法在重大疾病领域的应用奠定基础。
Lumasiran 从孤儿药认定到获批上市仅历经4年,这离不开高效的临床开发策略。支持 Lumasiran 上市的主要临床试验包含1项 Ⅰ/Ⅱ 期试验、1项 Ⅱ 期试验和2项 Ⅲ 期临床试验。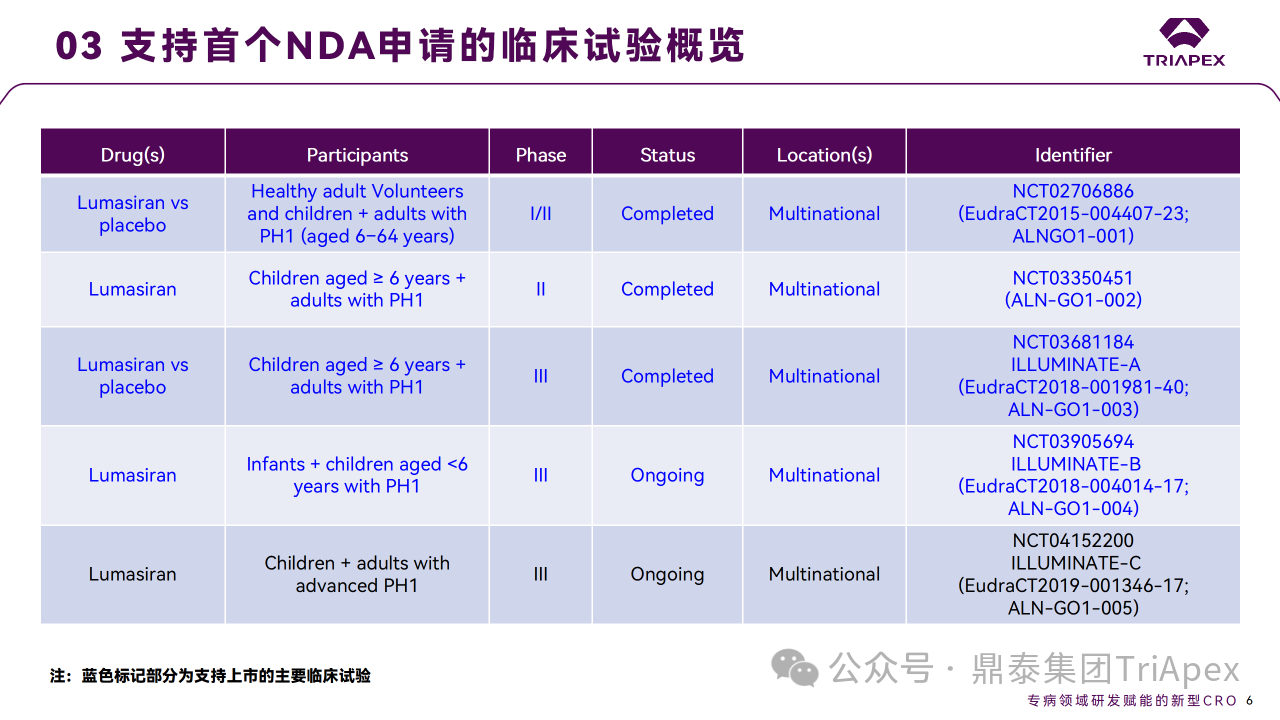
◆ I期临床试验(NCT02706886)主要目的是评估 Lumasiran 在健康受试者和 PH1 患者中的安全性和耐受性。
◆ II期扩展研究(NCT03350451)评估 Lumasiran 对 PH1 成人和儿童的长期和安全性和耐受性,研究完成日期为2023年6月。
◆ 2项 Ⅲ 期临床试验 ILLUMINATE-A(NCT03681184)和 ILLUMINATE-B(NCT03905694)分别评估 Lumasiran 治疗6岁及以上 PH1 患者和小于6岁的婴儿和儿童 PH1 患者的长期有效性和安全性,其中 ILLUMINATE-A 完成时间为2024年1月;提交 NDA 时,ILLUMINATE-B 还在进行中,提供了初始6个月的部分数据以支持6岁以下儿童用药,完整试验预计2024年8月完成。
Lumasiran 临床开发路径
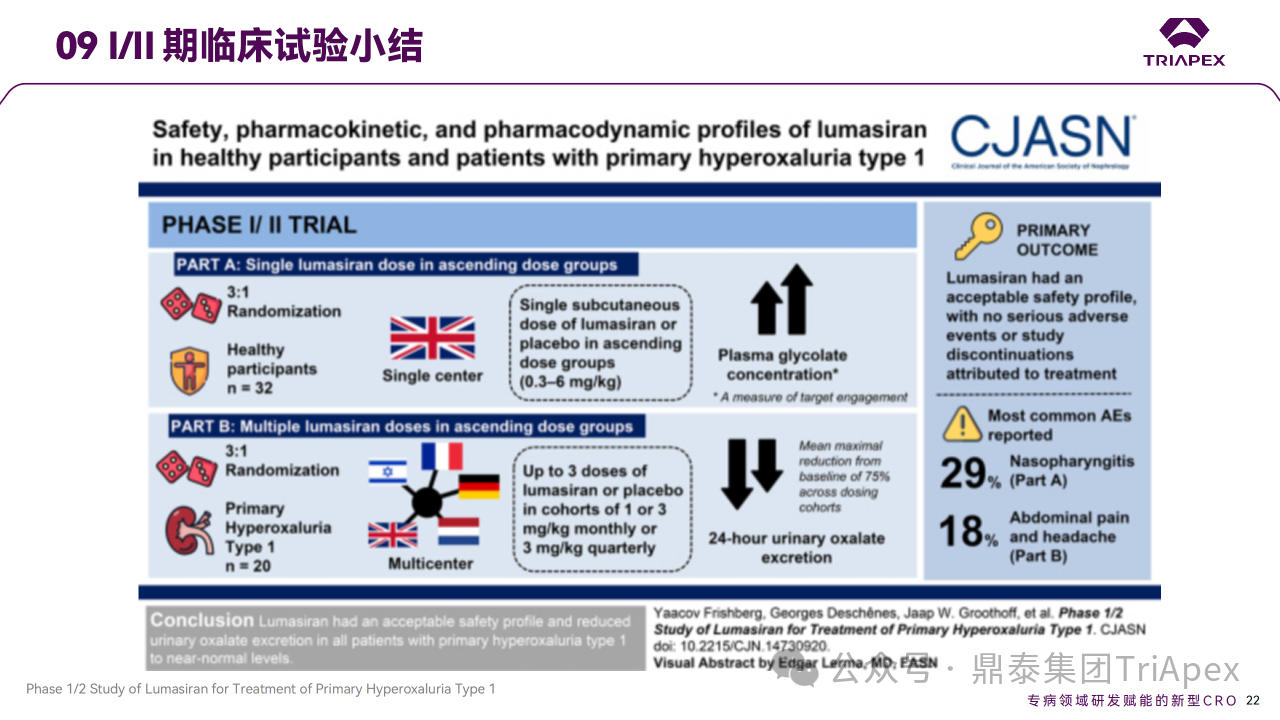
这是1项随机、单盲、安慰剂对照、单次和多次递增剂量的 FIH 试验,目的是评估 Lumasiran(代号ALN-GO1)在健康受试者和 PH1 患者中的安全性、耐受性、药代动力学和药效学,包含 Part A 和 Part B 两部分。

Part A 在英国开展,纳入32名健康受试者,以3:1随机接受单次 Lumasiran (0.3、1.0、3.0 和 6.0 mg/kg)或安慰剂。Part B 是一项跨地区多中心研究,纳入20名 PH1 成人和儿童患者。其中12名以 3:1随机接受最多 3 次 Lumasiran 或安慰剂,分为1 mg/kg QM、3 mg/kg QM 或 3 mg/kg Q3M共3个队列;最初分配到安慰剂组的患者在第 85 天交叉到 Lumasiran 组,使用相应剂量的 Lumasiran。在 Part B 的盲期(blinded period)之后为 OLE 研究,纳入该研究的8名患者均接受 Lumasiran 治疗,分为2个扩展队列:1 mg/kg QM 和 3 mg/kg QM(n=4)。主要终点是 AE 的发生率,次要终点包括药代动力学参数和药效学指标。
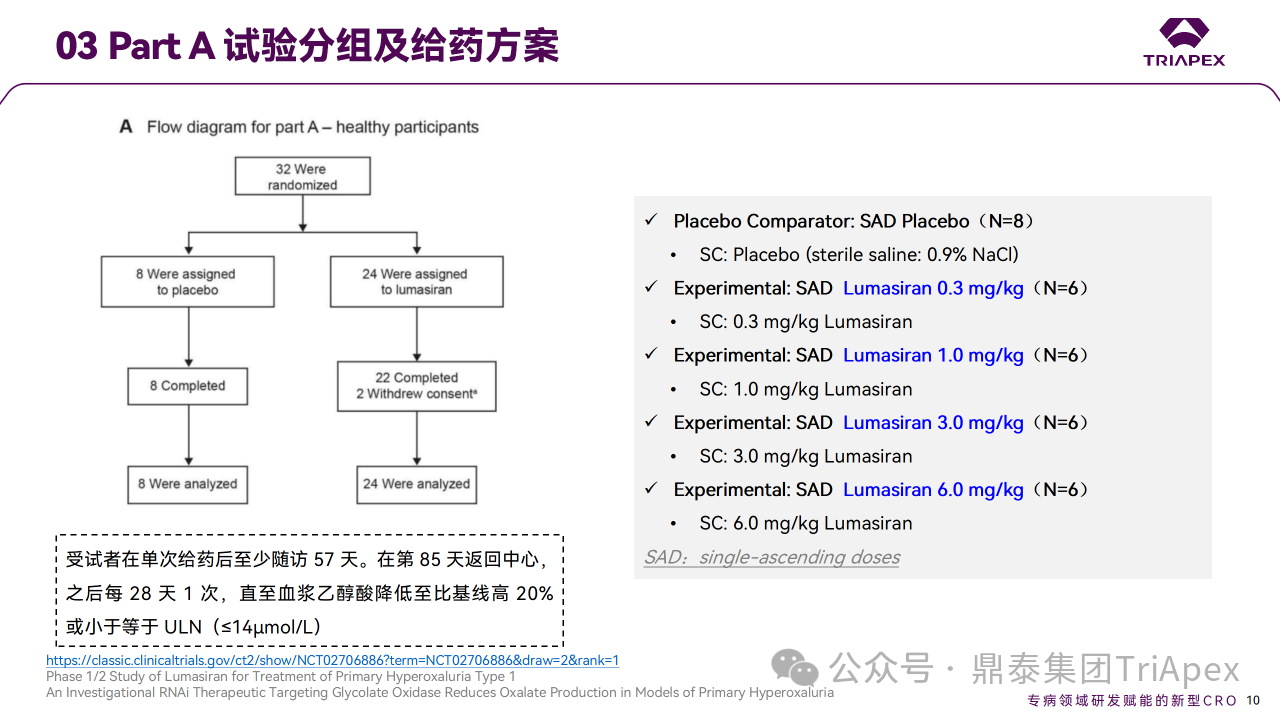

Ⅰ/Ⅱ 期临床试验分组和给药方案
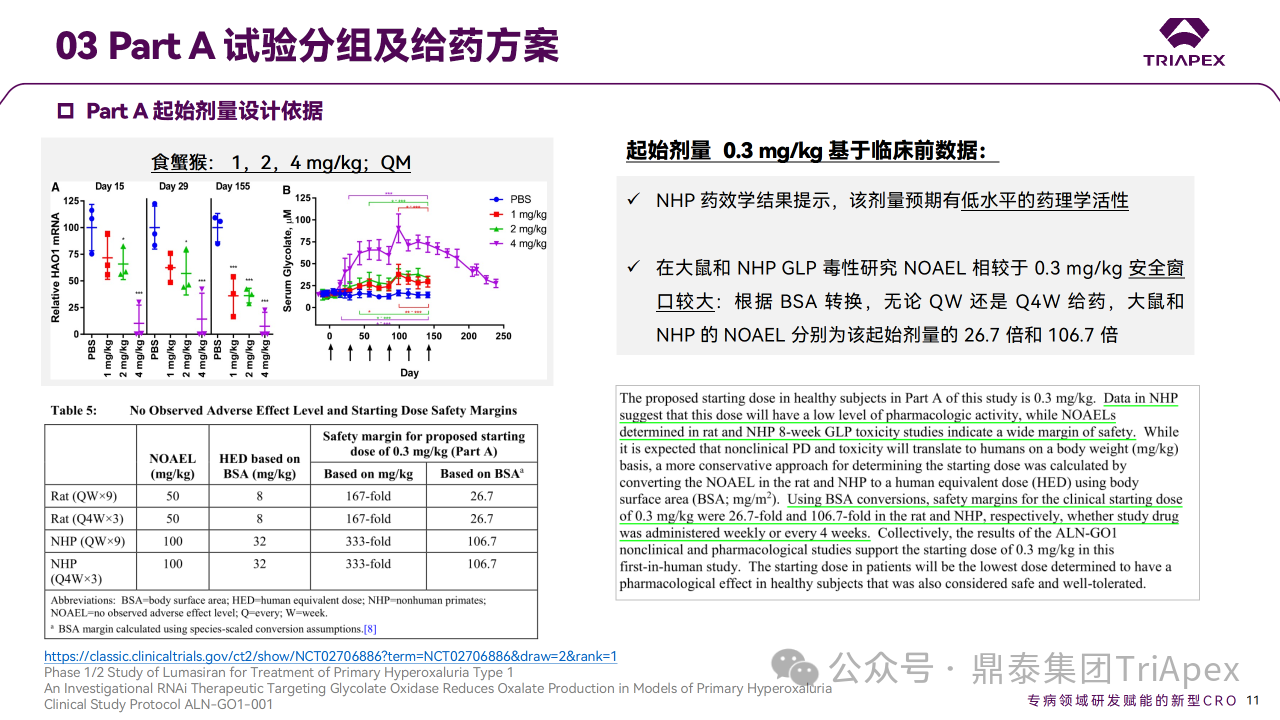
NHP 药效学结果提示,0.3 mg/kg 预期有低水平的药理学活性,且根据大鼠和 NHP GLP 毒性研究 NOAEL 相较于该剂量安全窗口较大。

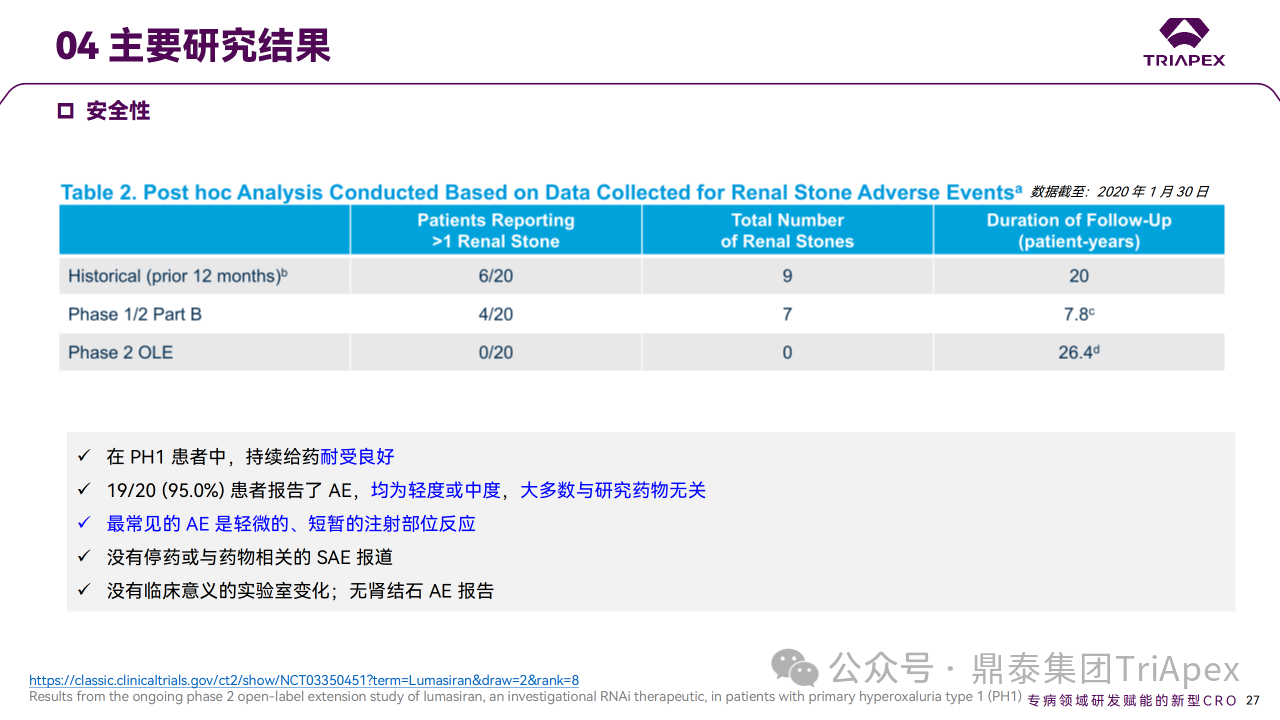
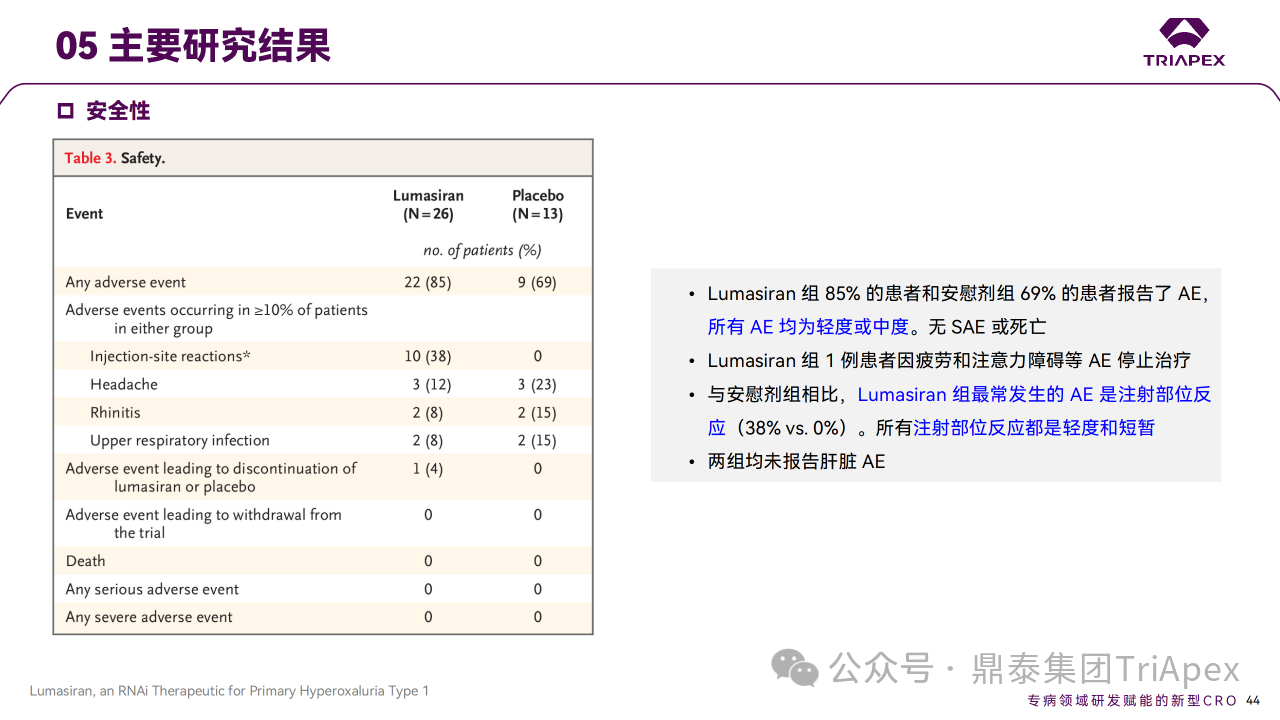
结果显示,在 Part A 和 Part B 中,Lumasiran 具有可接受的安全性,没有严重或因治疗而中断研究的 AE,主要 AE 为注射部位反应。
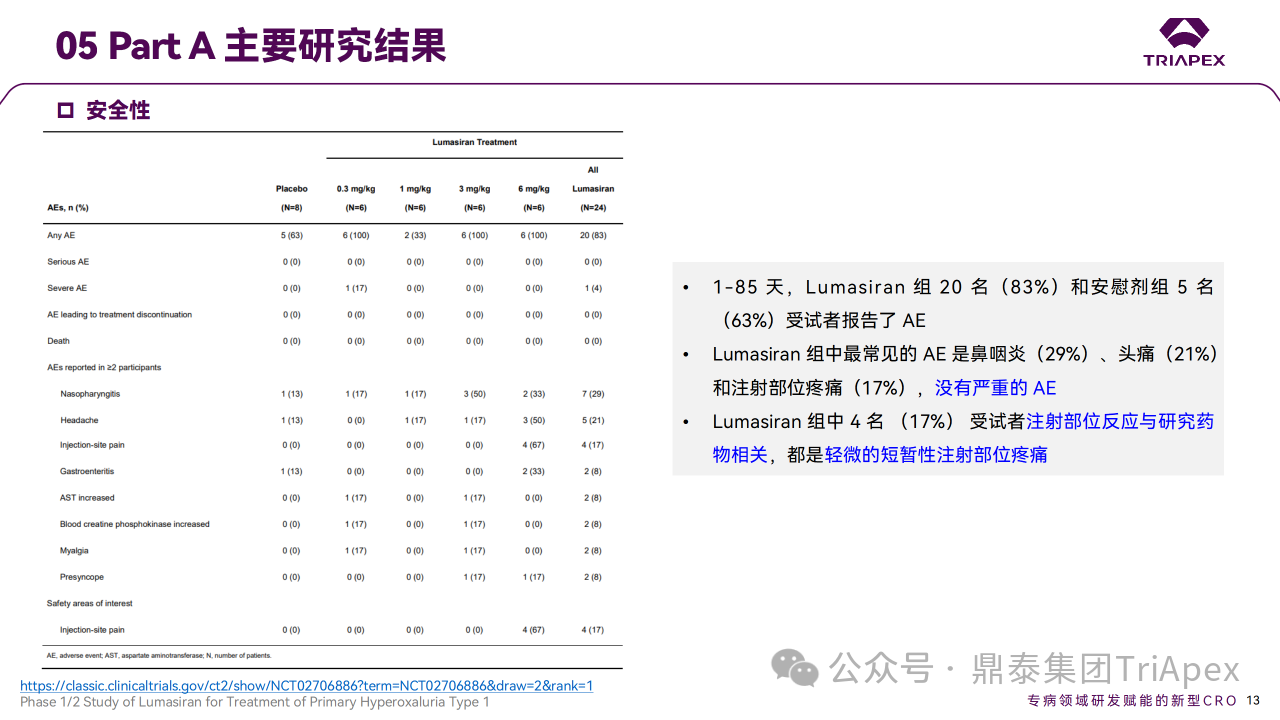
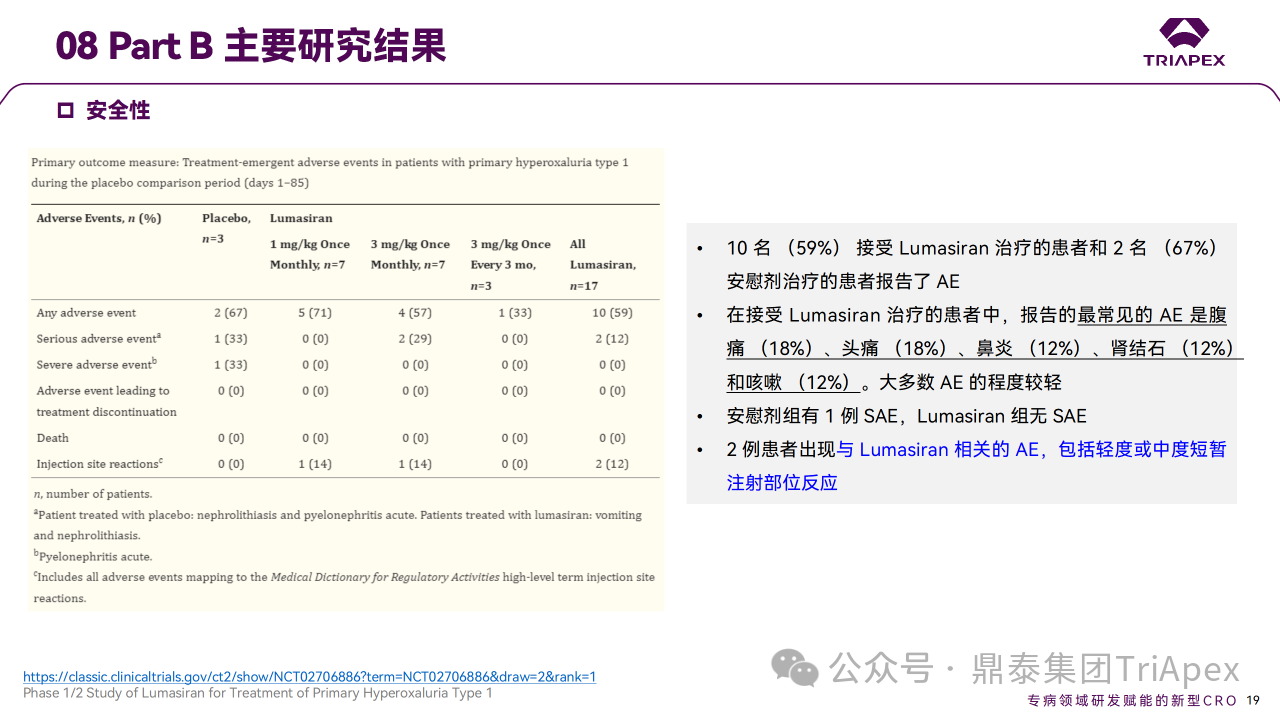
Ⅰ/Ⅱ 期临床试验安全性相关结果
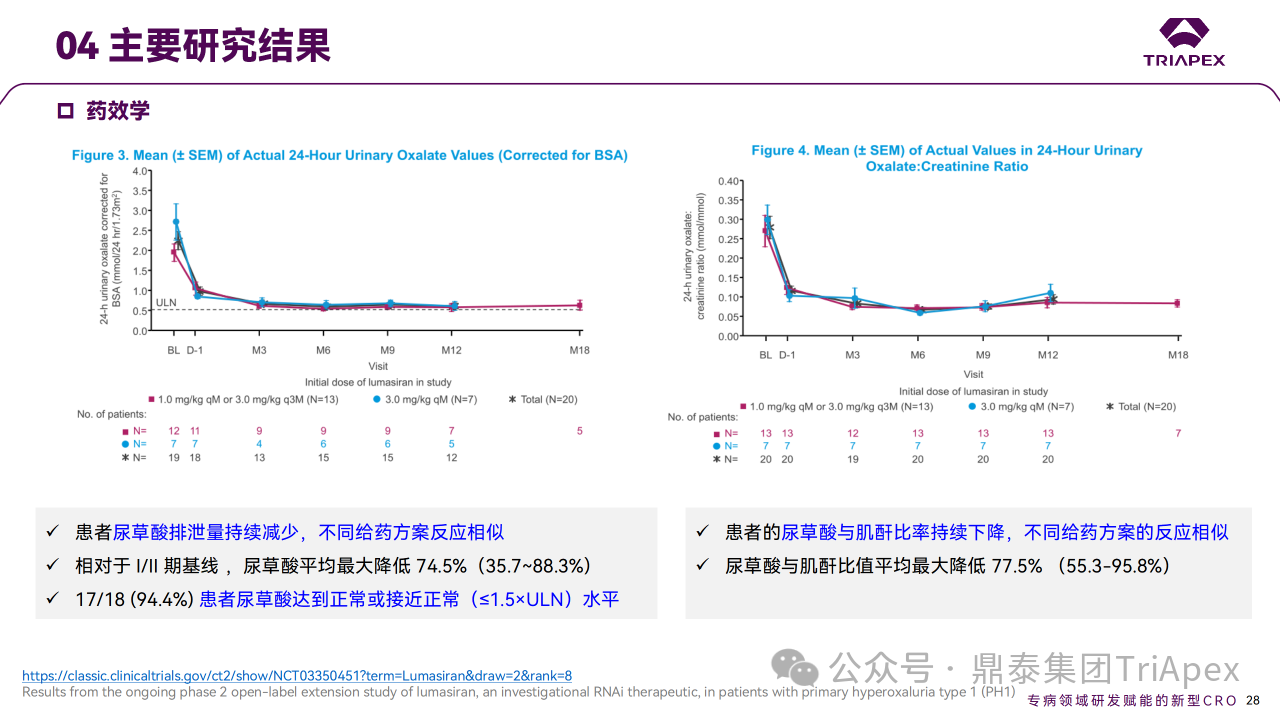
在 Part A 中,单次给药后健康受试者血浆和尿乙醇酸浓度增加。在 Part B 中,PH1 患者 24h 尿草酸排泄相对于基线的平均最大减少量为 75%,所有患者尿草酸排泄量均接近正常(≤1.5×ULN)。
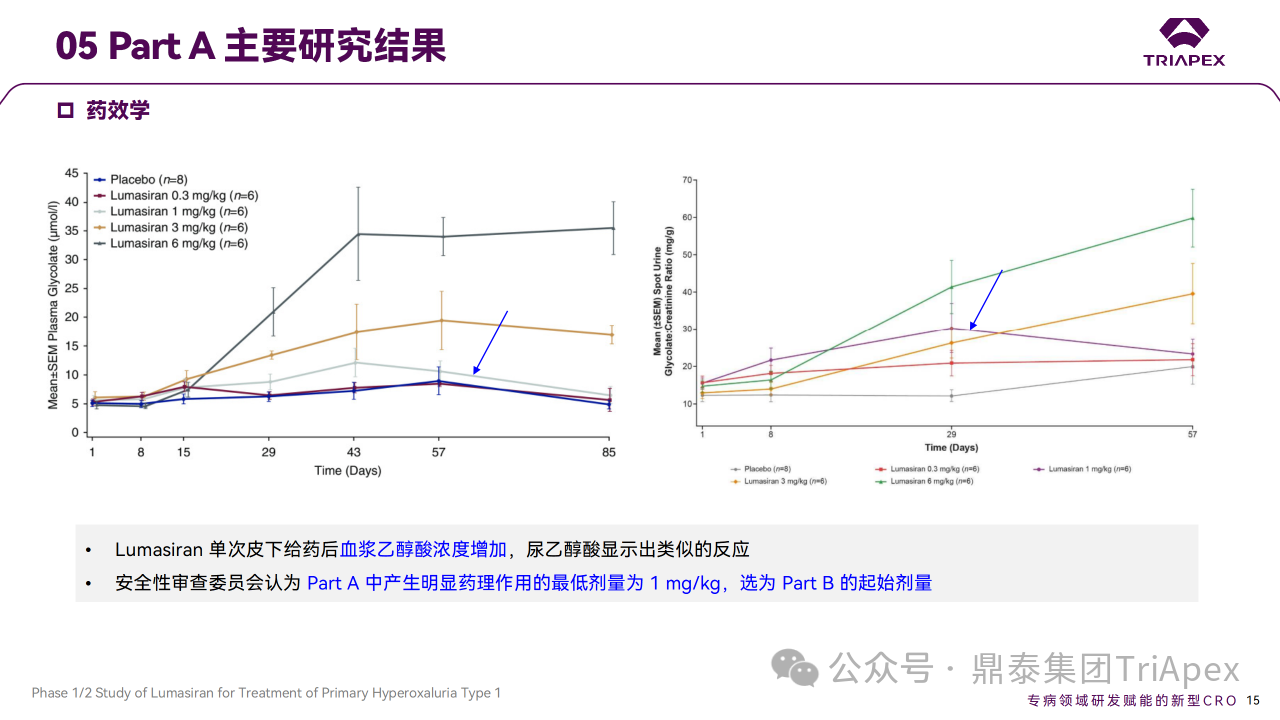
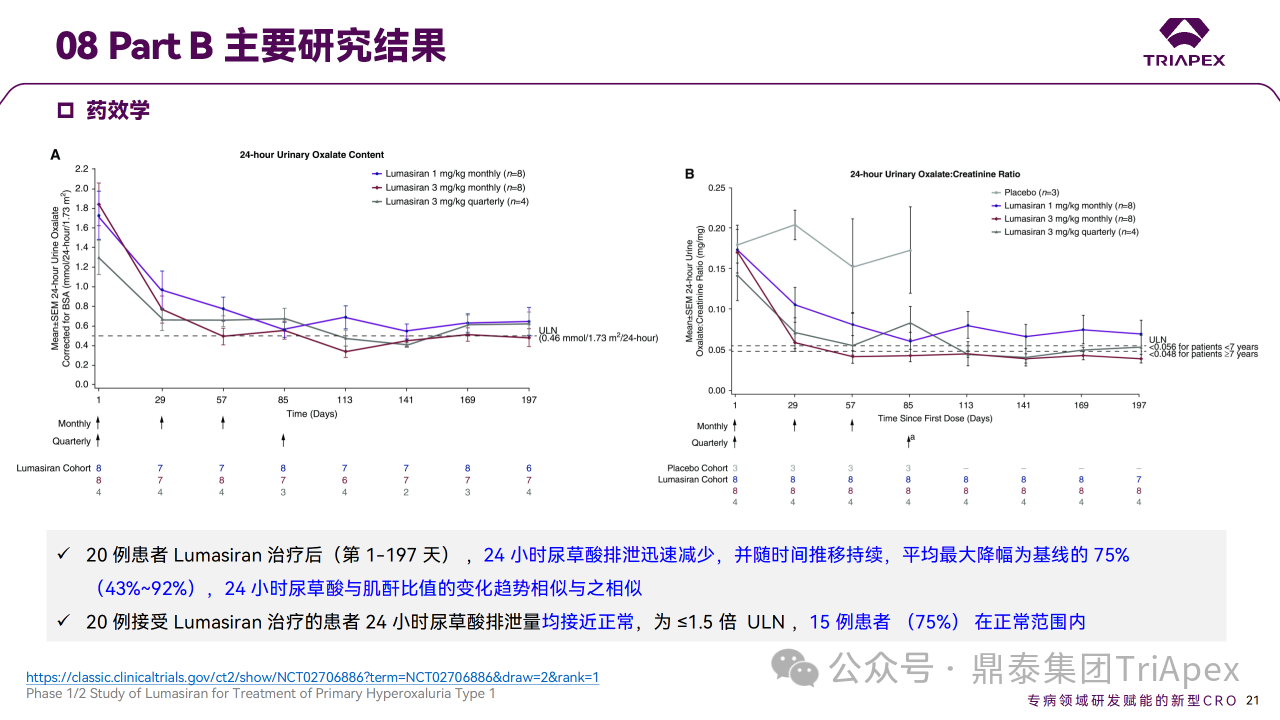
Ⅰ/Ⅱ 期临床试验药效学相关结果
药代动力学特征显示 Lumasiran 从血液循环中快速清除,表明被肝脏快速摄取 (rapid hepatic uptake)。尿排泄是 Lumasiran 的次要消除途径,占总清除率的 7% ~ 26%。Part B中接受 1 mg/kg 剂量 Lumasiran 的两名患者检测到 3 次阳性抗药抗体,滴度较低(1:50);ADA 的产生与 AE 未见相关性,对药代动力学或药效学参数未见影响。
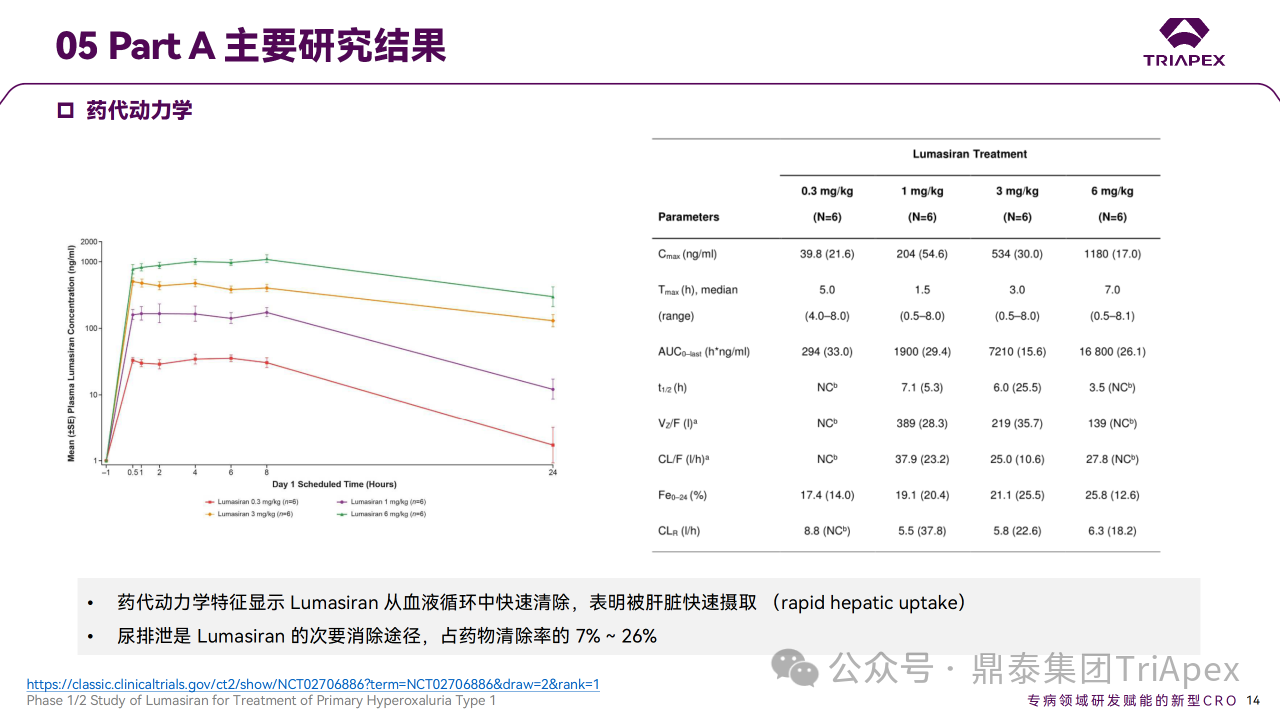
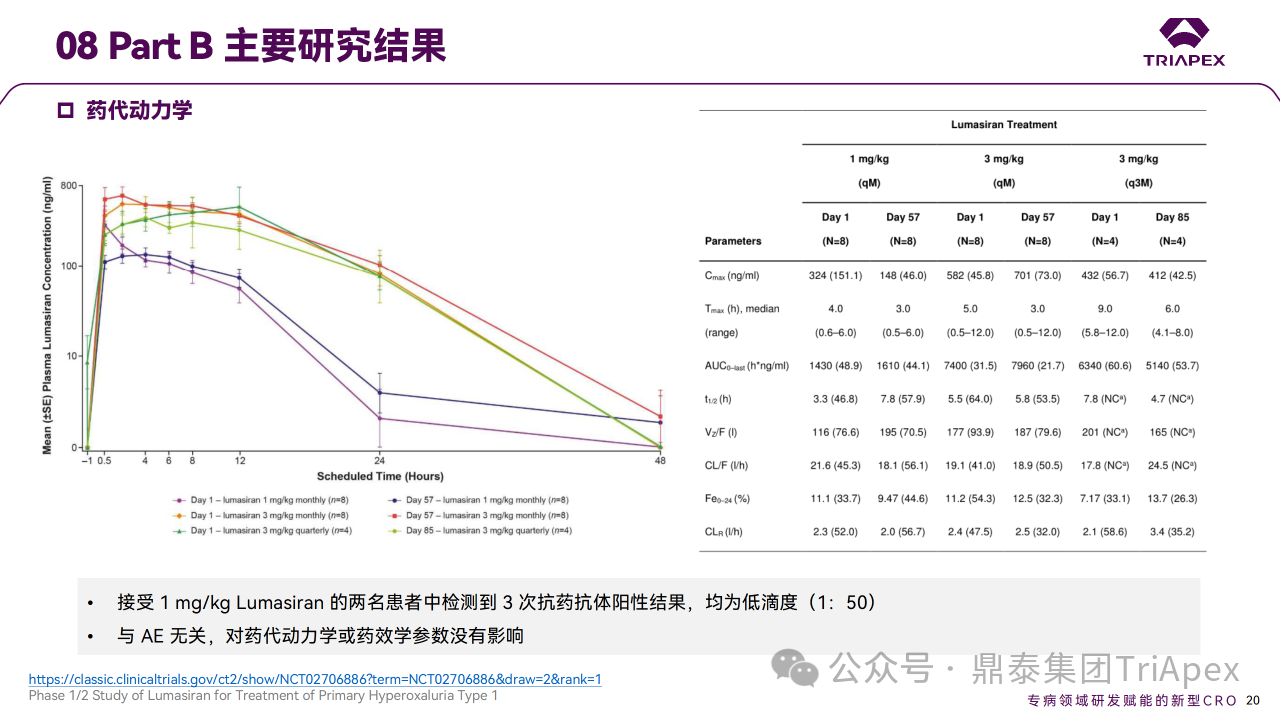
Ⅰ/Ⅱ 期临床试验药代动力学相关结果
本研究对 siRNA 用于治疗 PH1 进行了概念验证,研究结果支持了3项 Ⅲ 期临床试验(ILLUMINATE-A、ILLUMINATE-B 和 ILLUMINATE-C)的开展[1]。
Ⅱ 期临床试验为多中心、OLE 研究,目的是评估 Lumasiran 在 PH1 患者中的长期安全性和耐受性。受试者为已完成 Ⅰ/Ⅱ 期 Part B 临床试验的20名 PH1 患者。队列1在前6个月接受 1 mg/kg QM 或 3 mg/kg Q3M 给药,第6~51个月接受 3 mg/kg Q3M 给药;队列2患者前21个月接受 3 mg/kg QM 给药,第21~51个月接受3 mg/kg Q3M 给药。即所有患者都过渡到 3mg /kg Q3M。在 OLE 基线时,患者的平均年龄为16岁。主要终点为 AE 发生率,次要终点有包括 24h 尿草酸随时间的变化。


Ⅱ 期临床试验设计
截至2020年1月(median exposure 15 months 中位暴露时间15个月),与I/II期基线相比,24h 尿草酸水平平均最大降幅为74.5%,血浆草酸水平下降55.2%。绝大多数患者尿草酸正常或接近正常,且表现出可接受的安全性。
Ⅱ 期临床试验研究结果
在 Ⅱ 期 OLE 研究期间,继续使用 Lumasiran 治疗,尿草酸降低到接近或低于正常上限的水平;且表现出可接受的安全性,没有中断研究治疗或与药物相关的 SAE,最常见的药物相关 AE 是轻微的、短暂的注射部位反应,没有肾结石 AE 报告。这些数据提供了长达 22 个月 Lumasiran 暴露的长期有效性和安全性[3]。
Ⅲ 期临床试验——
ILLUMINATE-A(NCT03681184)
ILLUMINATE-A 为延长给药期的多中心、随机、双盲、安慰剂对照研究,旨在评估 Lumasiran 在 6 岁或以上的 PH1 患者中的有效性和安全性。该试验可分为3个部分:6 个月双盲期、3 个月双盲治疗扩展期和51个月开放标签扩展期。
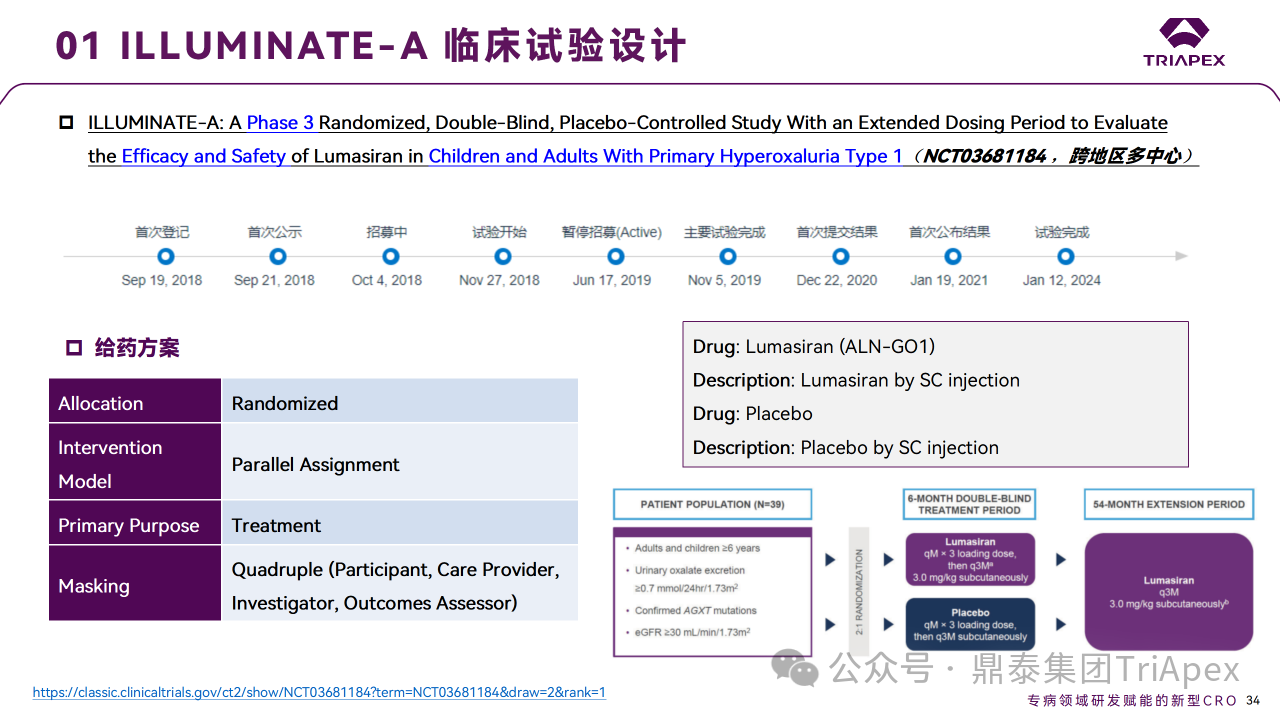
试验纳入39名 PH1 成人和儿童患者,以 2:1 的比例随机接受 Lumasiran 或安慰剂。在6个月双盲期,患者前3个月接受 3 mg/kg QW(负荷剂量)的 Lumasiran或安慰剂共3次,之后接受 3 mg/kg Q3W(维持剂量)的 Lumasiran 或安慰剂。在第6个月双盲期结束后,开始3个月的双盲治疗扩展期,两个组的患者均接受 Lumasiran:原安慰剂组在第6、7和8个月接受 3.0 mg/kg QM 给药;原 Lumasiran 组将在第6个月接受 3.0 mg/kg Q3M 给药,第7个月和第8个月给予安慰剂。在 51 个月开放标签扩展期,所有患者将接受 3.0 mg/kg Q3W(维持剂量)Lumasiran。
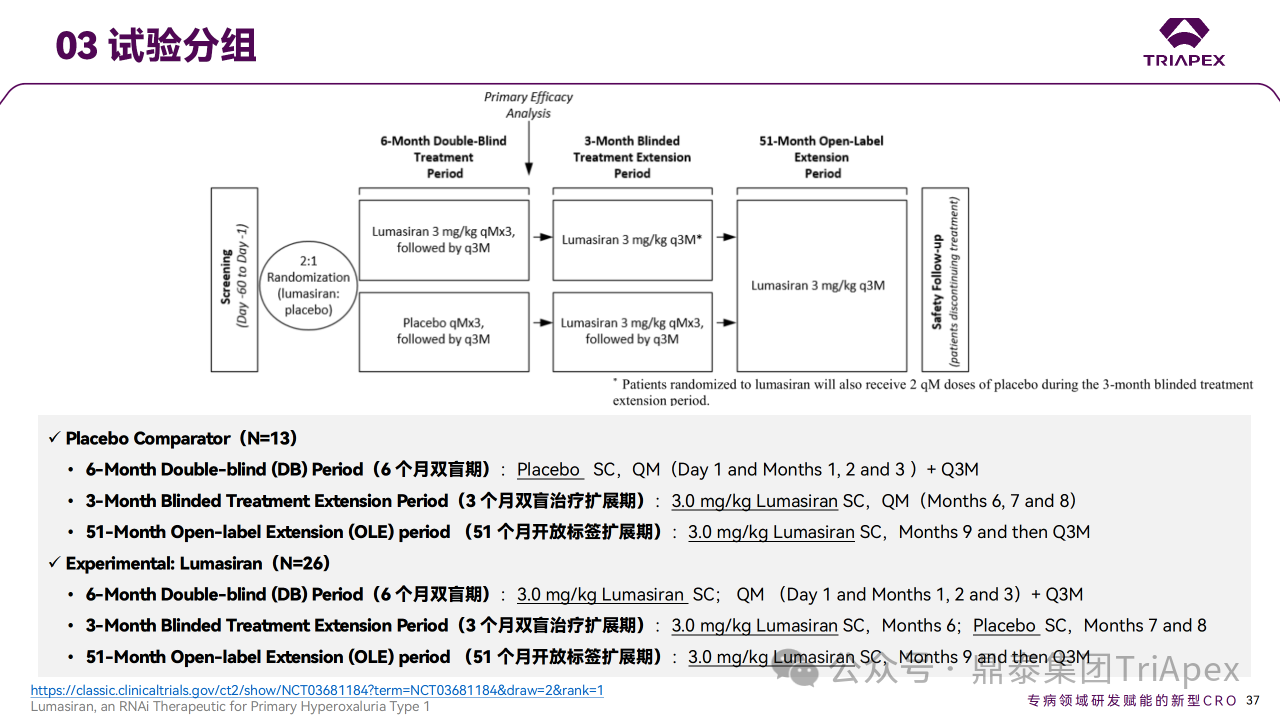
6岁及以上的 PH1 患者III期临床试验剂量和频率设计依据:
剂量设计主要基于研究 ALN-GO1-001 Part A 和 Part B中健康受试者和 PH1 患者的数据以及相关的 PK/PD 模型。在 PH1 患者中,群体 PK/PD 模型显示在剂量范围(1.0~6.0 mg/kg,QM 或 Q3M,SC)草酸呈剂量依赖性减少,随着剂量的增加,预期的附加效应逐渐减弱。
对于给定剂量,PK/PD 模型显示,与 Q3M 给药相比,QM 给药导致尿草酸水平下降更快。以 QM 负荷剂量 + Q3M 维持剂量给药,可以实现 PH1 患者尿草酸快速和持续降低到正常或接近正常水平的目标。

Ⅲ 期临床 ILLUMINATE-A 剂量设计依据
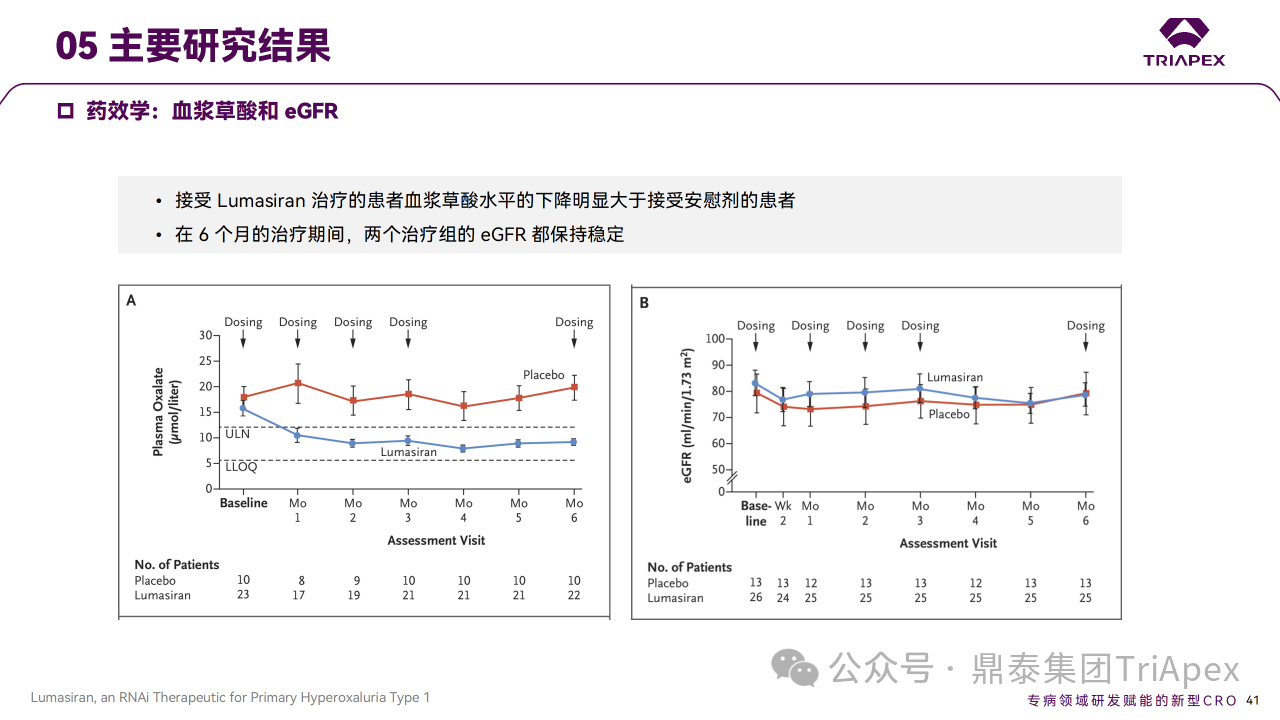
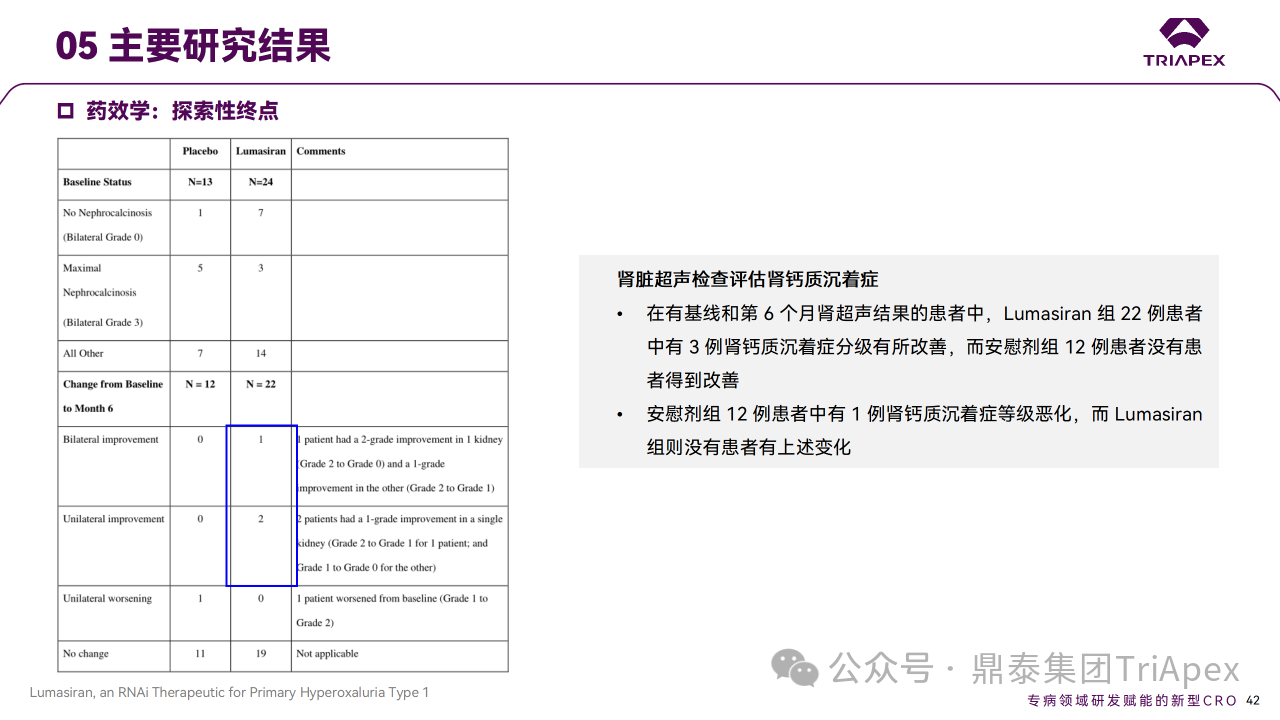
主要终点是从基线到第 6 个月根据 BSA 校正的 24h 尿草酸排泄的百分比变化。次要终点包括从基线到第 6 个月血浆草酸变化和扩展期 24h 尿草酸相对于基线随时间的百分比变化等,此外还评估了肾钙质沉着症和肾结石发生率。在6个月双盲期,与安慰剂相比,Lumasiran 组患者 24h 尿草酸显著降低,所有次要终点显著改善,Lumasiran 组 22 例患者中有 3 例肾钙质沉着症分级有所改善,肾结石发生率下降。在扩展期,最初随机分配到 Lumasiran 的患者到 12 个月时 24h 尿草酸持续减少(平均比基线减少64.1%),肾结石发生率下降;最初随机分配到安慰剂组的患者使用 Lumasiran 后,24h 尿草酸减少的时间过程和幅度相似(治疗 6 个月后平均减少 57.3%),肾结石发生率下降。
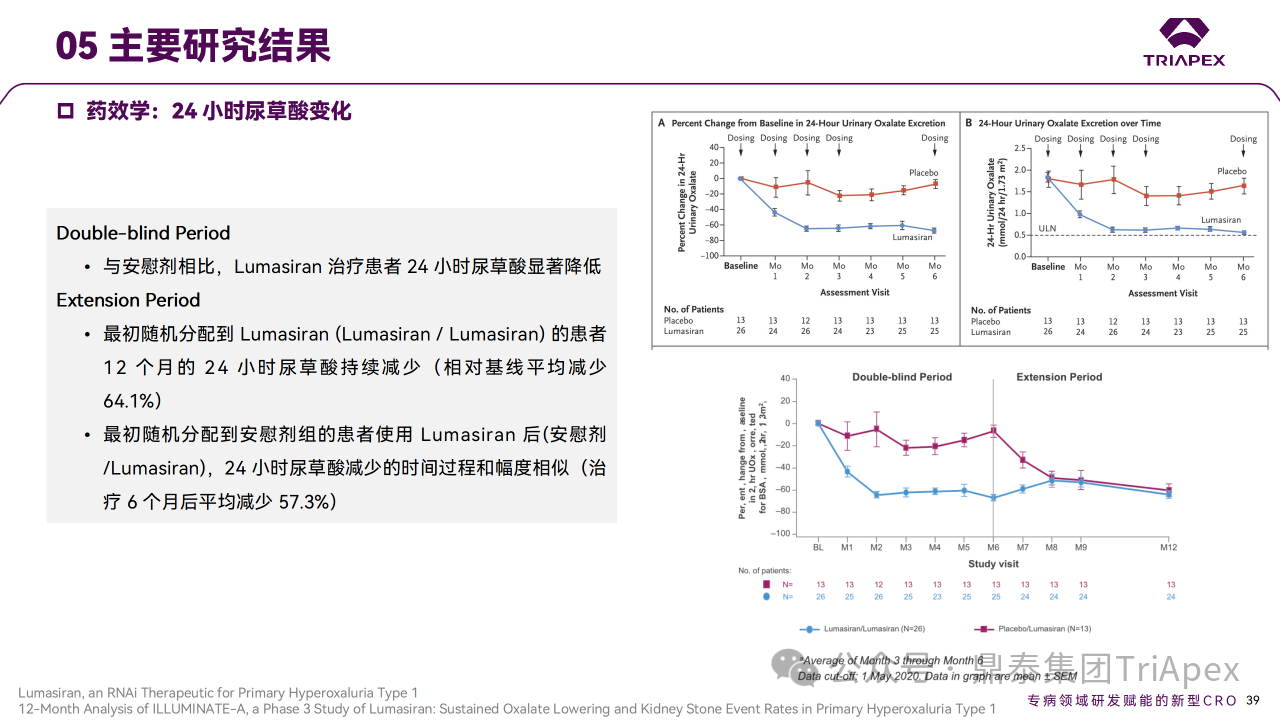

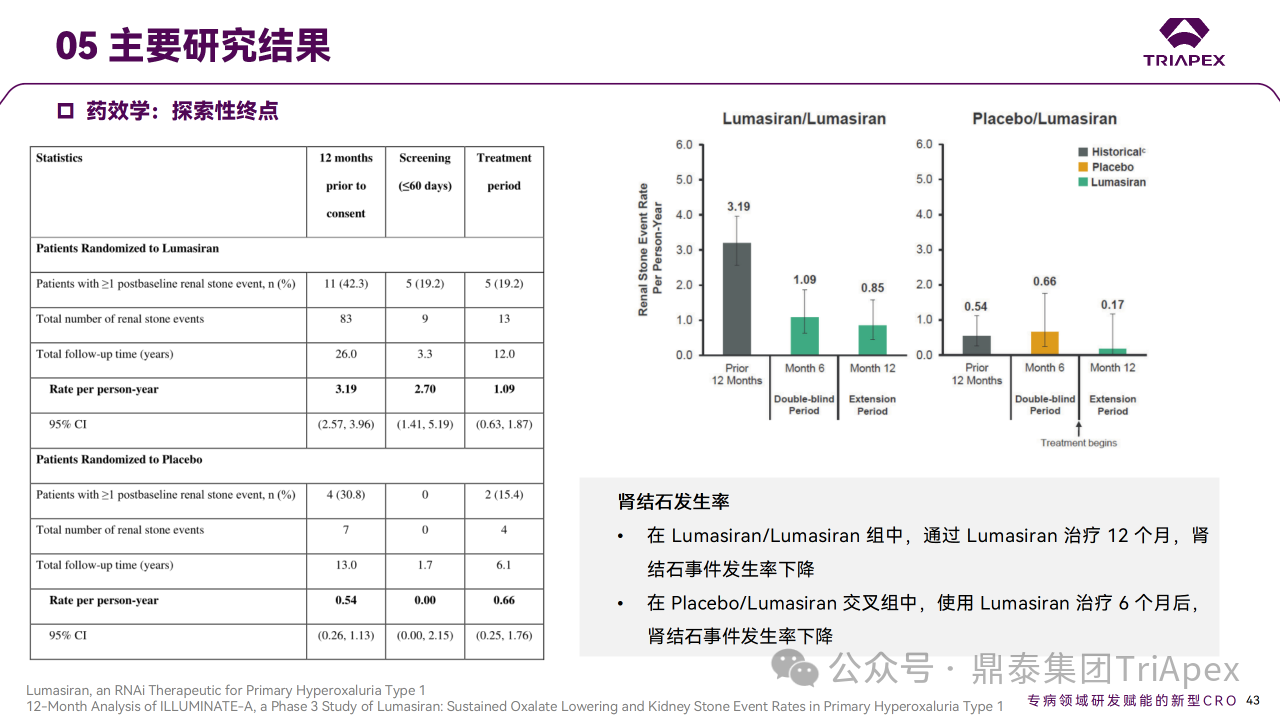
Ⅲ 期临床 ILLUMINATE-A 主要研究结果
在 6 个月的双盲期,Lumasiran/ Lumasiran 组患者尿草酸和血浆草酸的减少在 Placebo/ Lumasiran 交叉组患者中得到了重复,证实了结果的稳健性[2, 4]。
Ⅲ 期临床试验——
ILLUMINATE-B(NCT03905694)
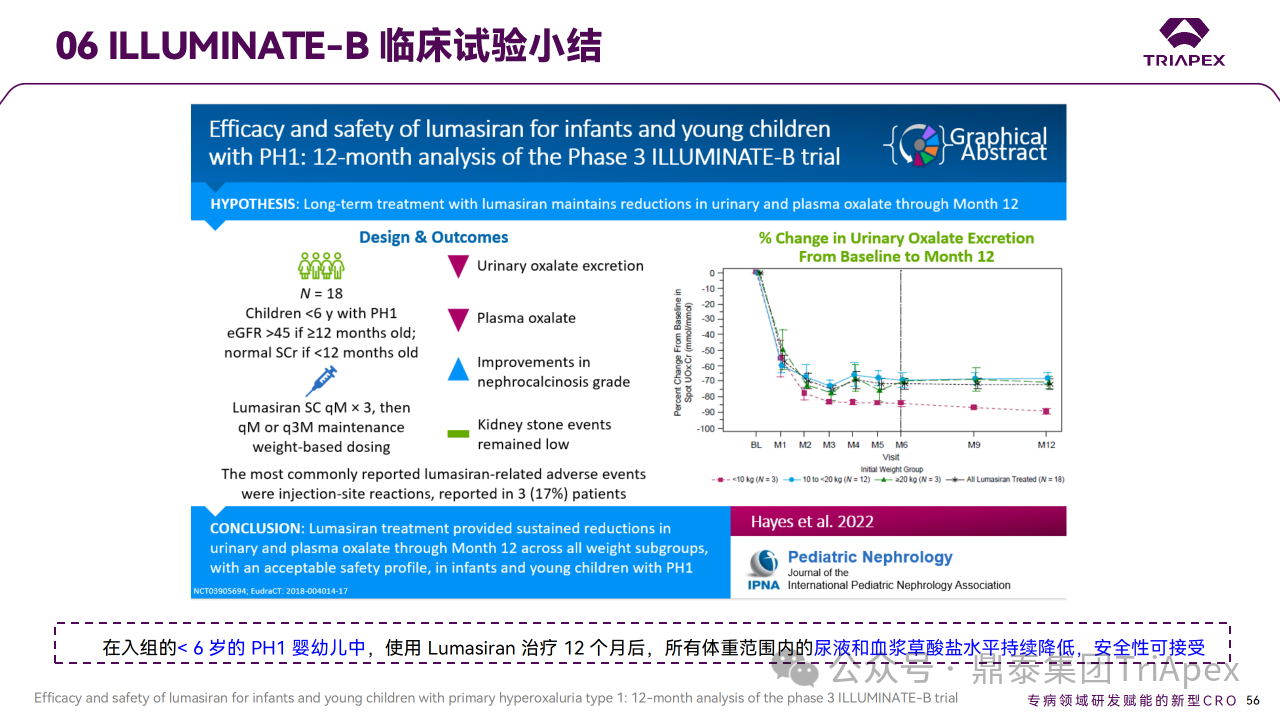
大多数 PH1 患者发生在儿童期或青春期早期,通常伴有肾结石和肾功能正常或降低症状。因此进行了单臂、开放标签研究,评估 Lumasiran 在 PH1 婴幼儿中的有效性、安全性、药代动力学和药效学。申请人对初始6个月的部分数据进行初步期中分析,以支持6岁以下儿童的适应症 NDA 的提交。截至数据分析时,18例已接受 Lumasiran 治疗的患者中,16例(89%)已完成6个月的随访并进入扩展期,其余2例患者已完成2个月的随访,没有患者停止治疗或退出研究。该试验预计2024年8月完成,目前已公布12个月的部分试验结果。

最终采用了3 种基于体重的给药方案,以在所有体重组中实现相似的肝脏浓度和靶点抑制:<10 kg,6 mg/kg QM*3 + 3 mg/kg QM;≥10 kg ~ < 20kg,6 mg/kg QM*3 + 6 mg/kg Q3M;≥20 kg,3 mg/kg QM*3 + 3 mg/kg Q3M。
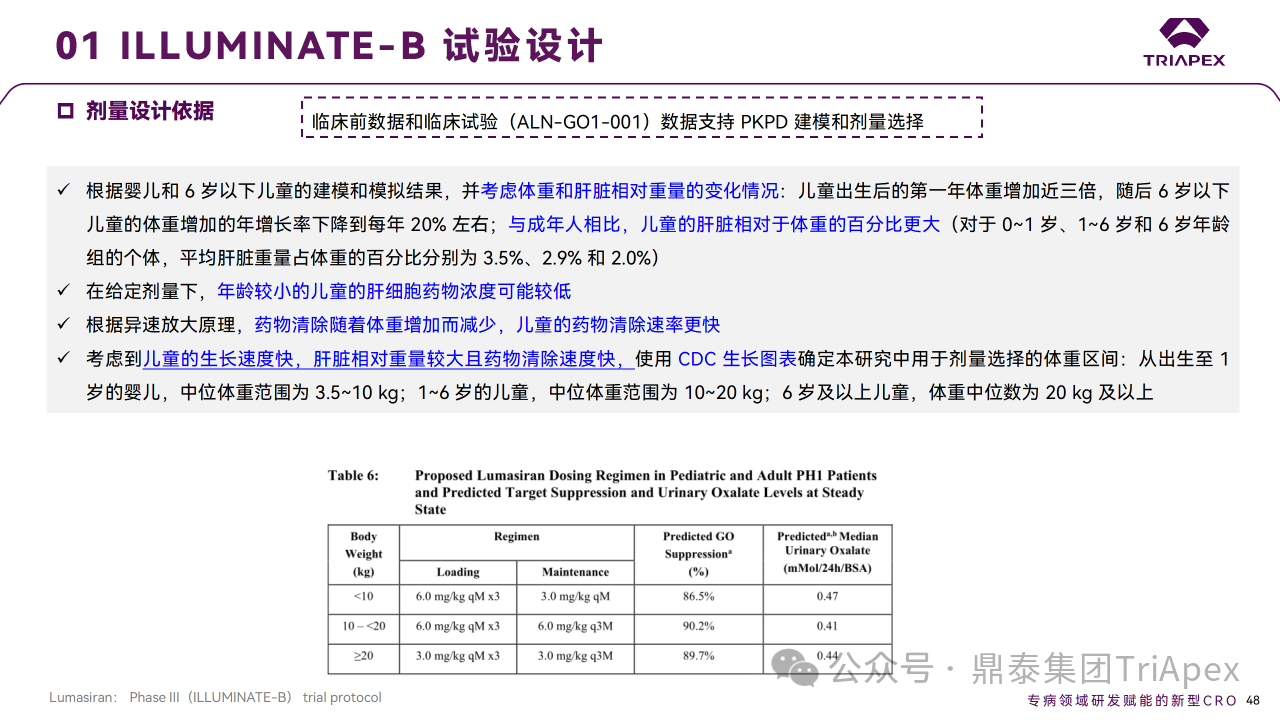
Ⅲ 期临床 ILLUMINATE-B 剂量设计依据
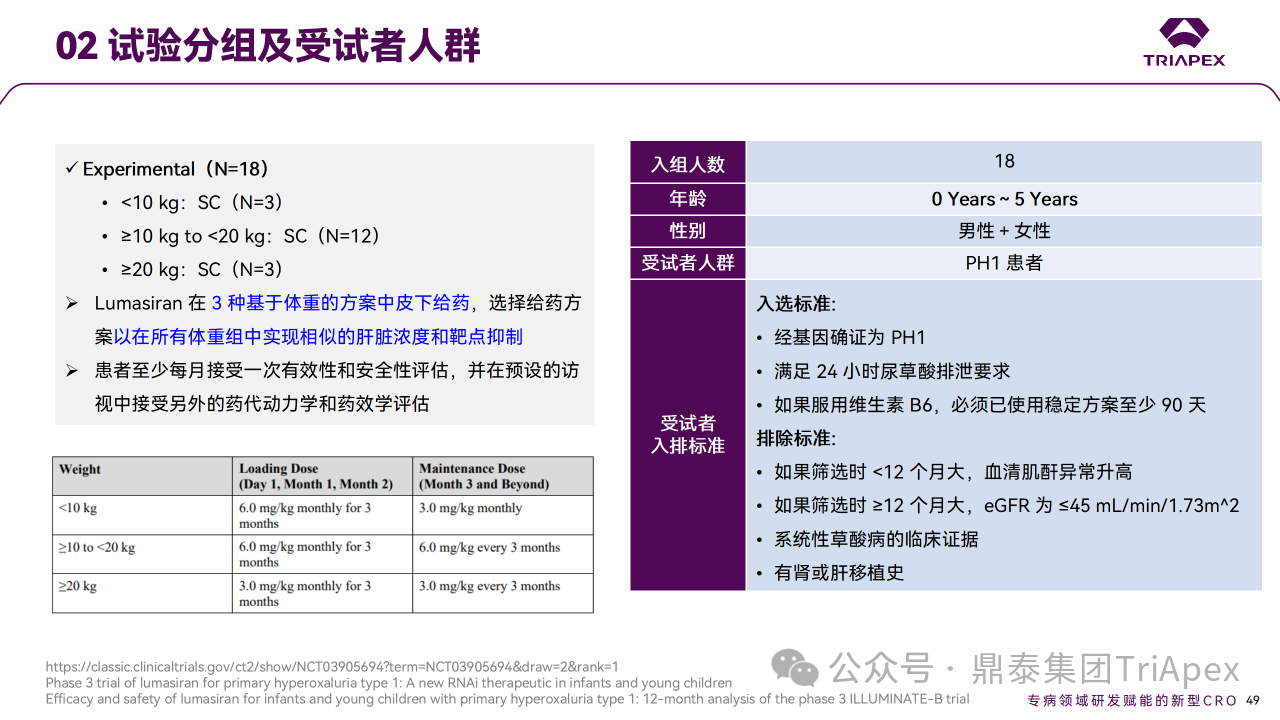
Ⅲ 期临床 ILLUMINATE-B 试验分组及受试者人群
主要终点是从基线至第 6 个月,尿草酸与肌酐比值 (UOx:Cr) 的百分比变化。次要终点包括尿草酸 ≤1.5×ULN的患者比例和血浆草酸变化。6个月时,Lumasiran 治疗可使 UOx:Cr 比值降低72%,并在12个月时维持在72%。在预设的体重亚组中,体重< 10 kg、10 ~ 20 kg 和 ≥20 kg 的患者在12个月时的平均降幅分别为89%、68%和71%。第6个月时血浆草酸水平相对于基线的平均降幅为32%,第12个月时改善至47%。肾钙质沉着症分级也有其他改善,肾结石发生率仍然较低。
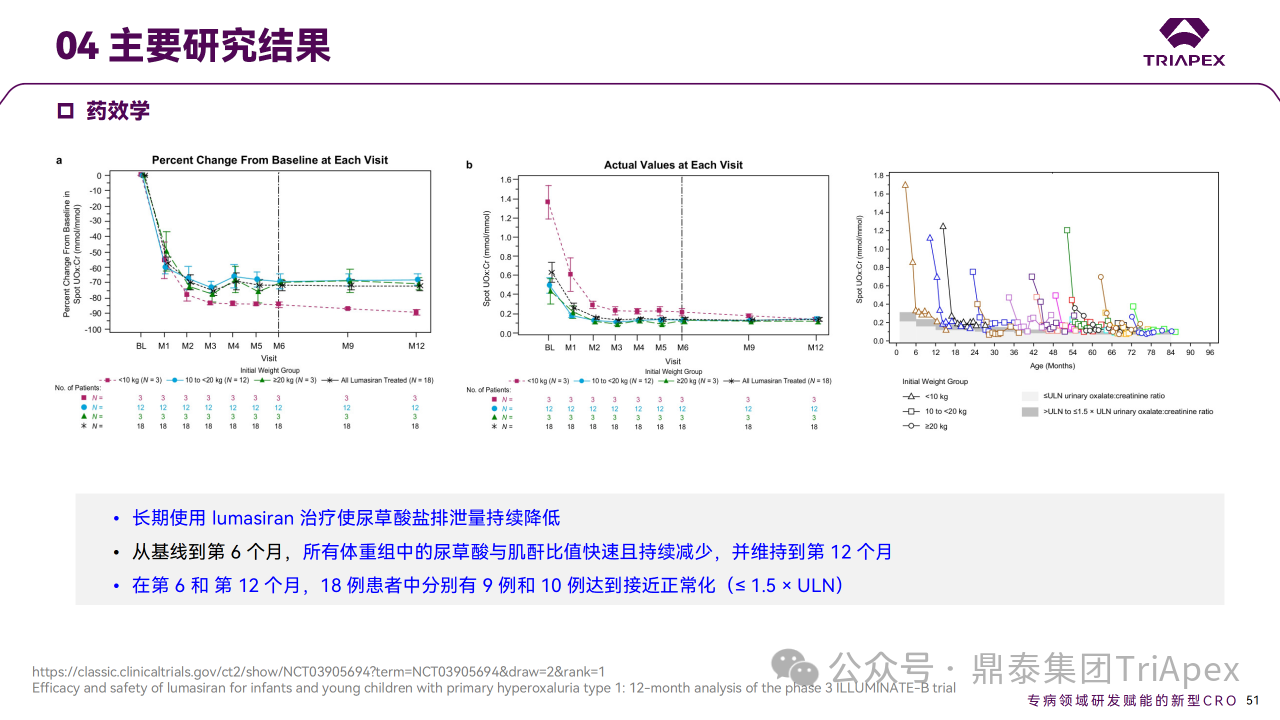
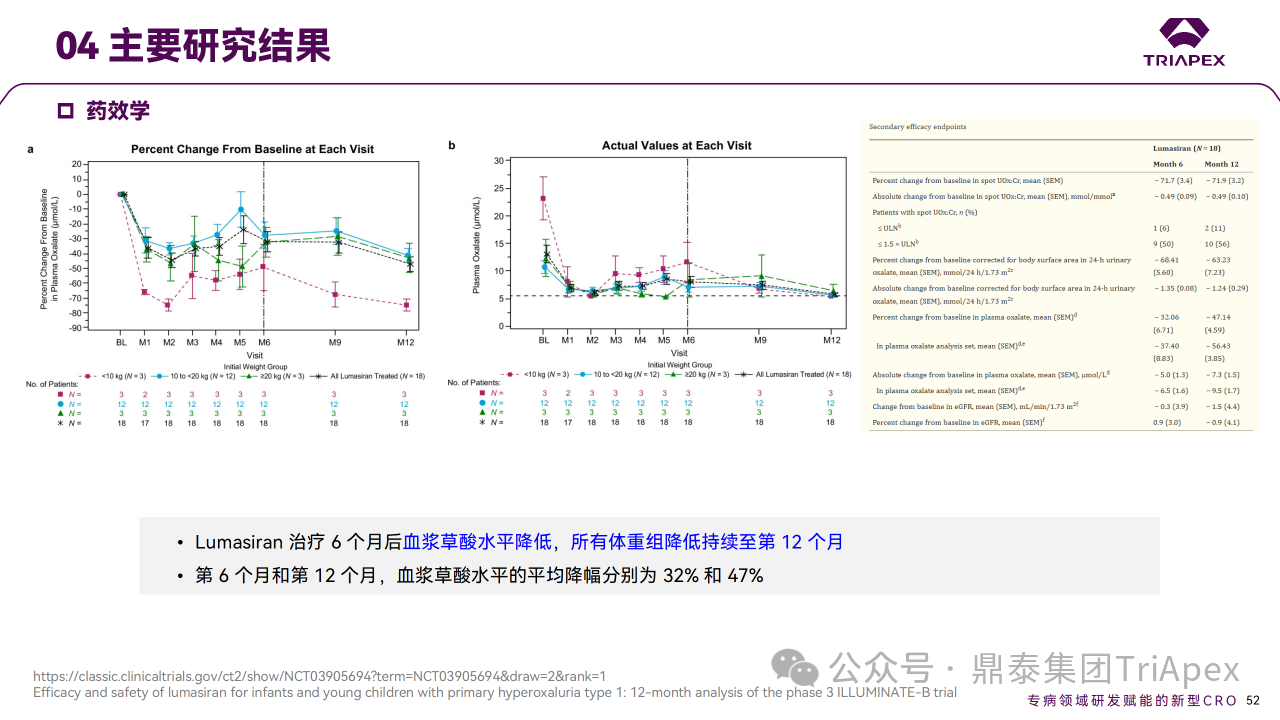
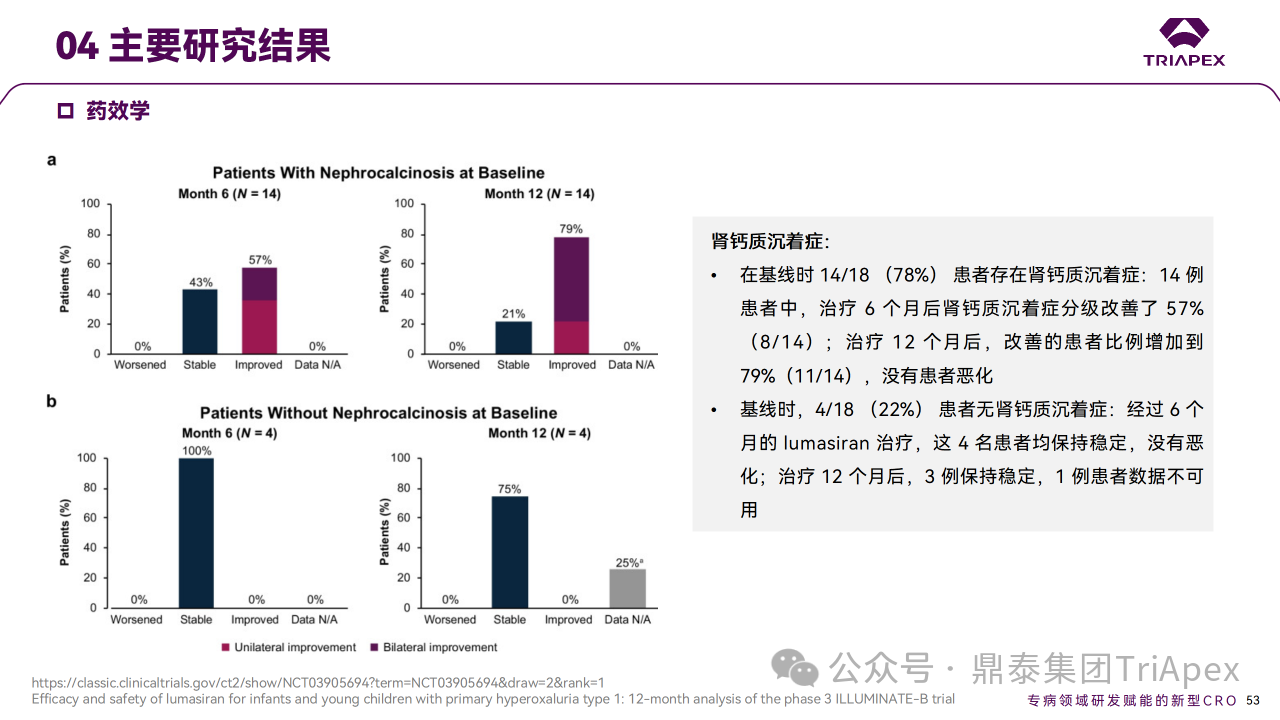
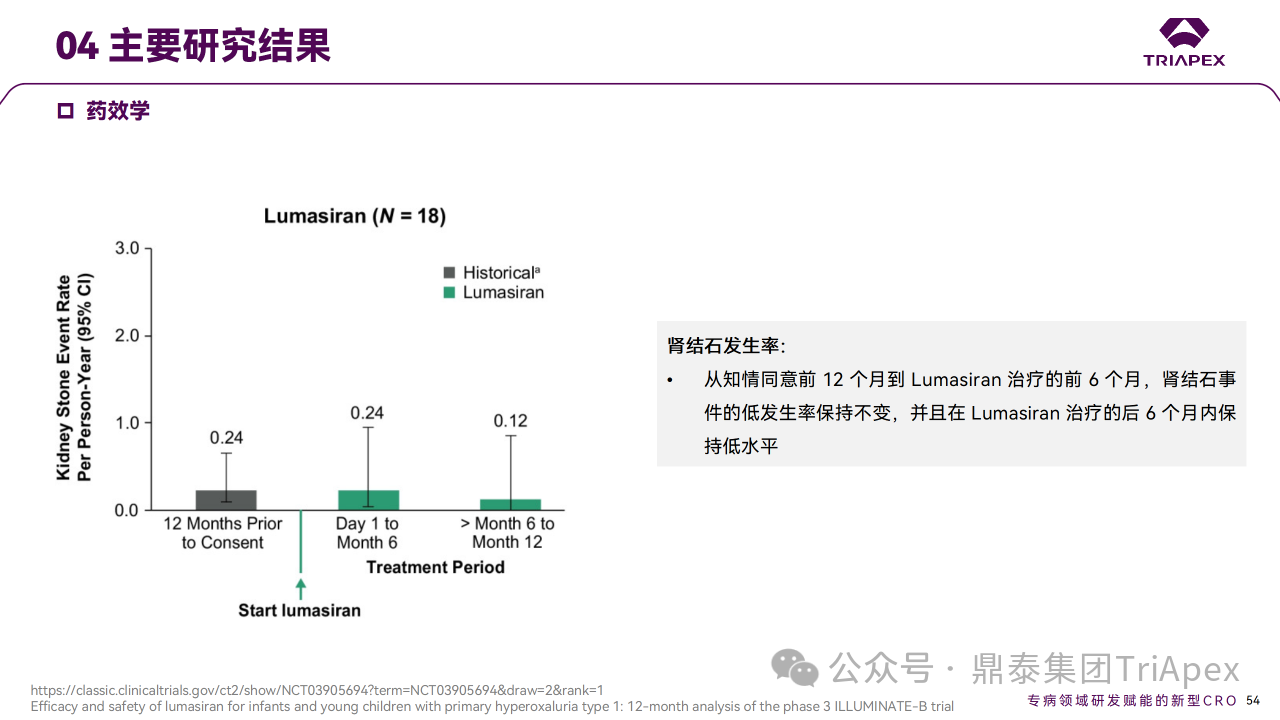
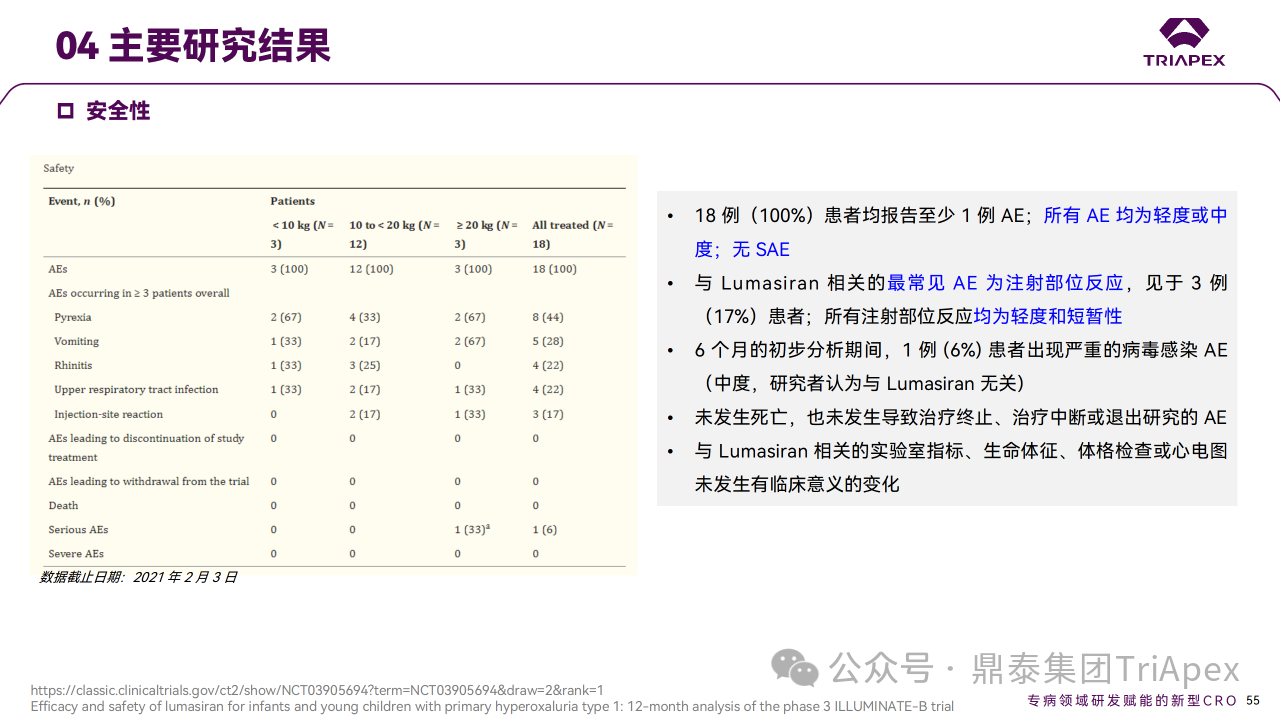
Ⅲ 期临床 ILLUMINATE-B 主要研究结果
对正在进行的 ILLUMINATE-B 研究的分析表明,在纳入研究的6岁以下 PH1 婴幼儿患者中,12个月的 Lumasiran 治疗使所有体重范围的患者尿液和血浆草酸水平持续降低,并且安全性可接受。鉴于尿草酸在肾损伤中的因果关系,肾功能稳定维持、肾结石事件的低发生率以及 Lumasiran 长期治疗期间观察到的肾钙质沉着症分级改善趋势均令人鼓舞。这些结果表明,基于 RNAi 的疗法在 PH1 年轻患者中得到了有效应用,且安全性可接受[5-6]。
一系列与监管的互动如 ODD、pre-IND、EOP2、BTD、优先审评及pre-NDA 也是 Lumasiran 快速上市不可或缺的。借助高效的监管互动,就支持 NDA 的 CMC 工艺变更、幼龄动物研究、致癌性试验开展时间等达成一致,保障了上市进度。临床生物分析,包括药代动力学、代谢产物研究和免疫原性检测等敏感问题,是如何处理的?该产品的非临床和临床研究又有哪些相关性….
[1] Phase 1/2 Study of Lumasiran for Treatment of Primary Hyperoxaluria Type 1
[2] Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1
[3] Results from the ongoing phase 2 open-label extension study of lumasiran, an investigational RNAi therapeutic, in patients with primary hyperoxaluria type 1 (PH1)
[4] 12-Month Analysis of ILLUMINATE-A, a Phase 3 Study of Lumasiran: Sustained Oxalate Lowering and Kidney Stone Event Rates in Primary Hyperoxaluria Type 1
[5] Phase 3 trial of lumasiran for primary hyperoxaluria type 1: A new RNAi therapeutic in infants and young children
[6] Efficacy and safety of lumasiran for infants and young children with primary hyperoxaluria type 1: 12-month analysis of the phase 3 ILLUMINATE-B trial
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容