上期文章中,鼎泰集团对第3款已上市 siRNA 药物 —— Lumasiran(Oxlumo®,点击查看原文) 的临床开发路径进行了复盘分析。可以看出, Lumasiran 之所以能在2个年龄段的人群中同时快速获批,离不开科学合理的临床试验设计和周密的临床研究规划:
- 在 Ⅰ/Ⅱ 期临床试验中同时纳入了健康受试者和 PH1 患者。健康受试者的数据为 PH1 患者的给药剂量和给药间隔设计提供了依据;
- Ⅱ 期 OLE 试验无缝衔接 Ⅰ/Ⅱ 期,将 Ⅰ/Ⅱ 期中纳入的 PH1 患者继续纳入研究,开展更长周期的试验;
- 2项 Ⅲ 期试验分别在6岁及以上患者、6岁以下婴幼儿患者中进行。在试验未完全结束时(仅提供初始6个月的数据),即获得上市批准。
本期内容将介绍助力 Lumasiran 快速上市的另一个重要因素 —— 与监管机构的良好互动、备受关注的临床生物分析、临床与非临床相关性评估等。这些因素为 siRNA 药物如何运用临床前研究结果指导临床开发,以及全局视角优化研发策略提供了参考和启发。
| |
| |
| 临床开发路径 关键词:I/II 期无缝隙设计;2项关键III期 |
| 监管互动里程碑 关键词:EOP2;幼龄动物研究;致癌性研究 |
| |
| |
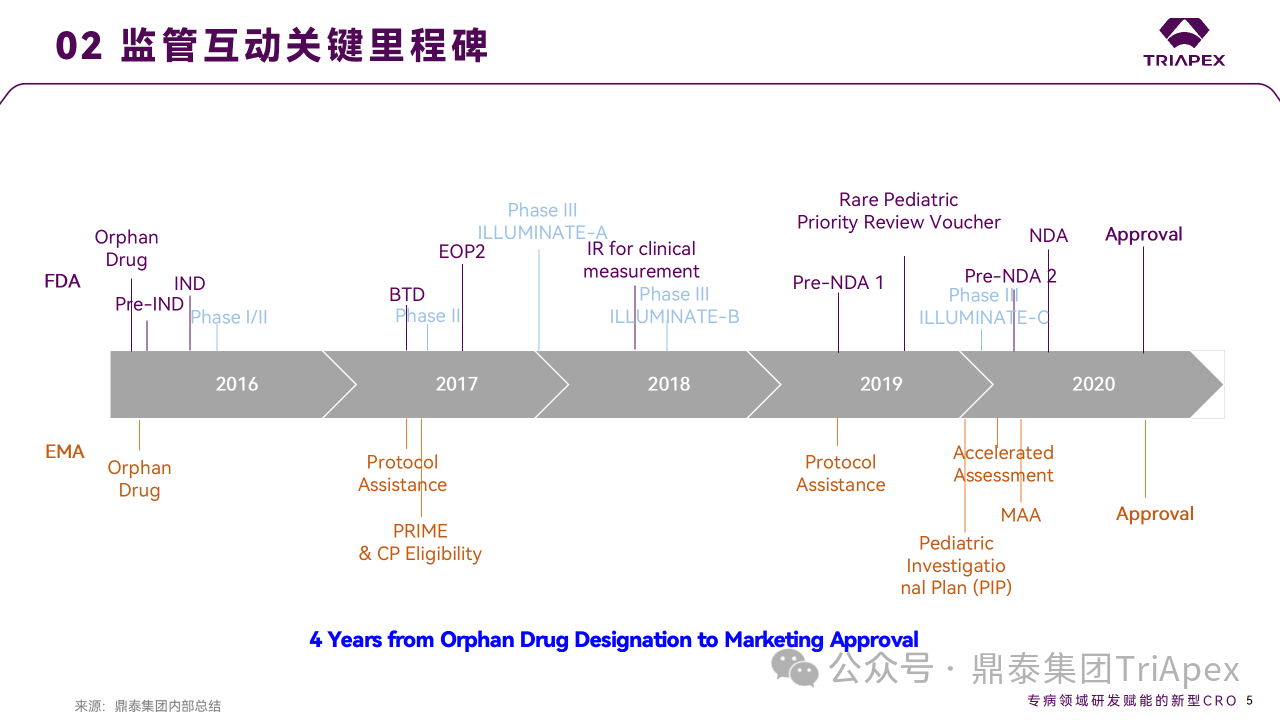
在 2018 年 4 月 26 日召开的 EOP2 会议上, Alnylam 主要就非临床和临床药理开发计划与 FDA 进行沟通。2018 年 2 月 23 日获得 BTD 认定,本次会议也作为首次 BTD 后会议。

幼龄动物研究:
FDA 同意鉴于已进行的包含 TK 评估和标准的组织病理学评估的 pilot neonate-juvenile study (PND 4~PND 32 给药,约为从新生儿到约6岁的人类年龄human equivalent age from newborn to approximately 6 years of age,剂量为0、10、30、100 mg/kg)和 8 周重复给药毒性试验中均未发现任何重大不良反应,且幼鼠的 PK/PD 特征与成年大鼠相似,申请人无需开展进一步的非临床研究以支持 6 岁以下儿科患者给药和 NDA 提交。值得一提的是,EMA 在 summary of product characteristics 中指出,对于1岁以下的患者,可获得的数据有限,因此在治疗这些患者时应谨慎。

致癌性试验:
申请人基于对文献和现有数据的评估,认为预期的作用机制(抑制 HAO1 mRNA)不存在致癌性方面的担忧,申请在获批上市后完成致癌性研究。FDA 认为该产品并不是完全不存在潜在的致癌性风险,可能的因素包括对 HAO1 mRNA 的抑制和/或 siRNA 的脱靶或非特异性效应,特别是在长时间给药的情况下。因此,在对 CAD(carcinogenicity assessment document) 进行审查之前,应提交致癌性研究方案并获得同意,并在提交 NDA 之前启动研究。
临床药理:
FDA 同意可不在非 PH1 患者中进行 DDI 研究、人类放射性标记 PK 研究、专门的肝功能和肾功能损伤患者的研究。需要提交相关文件(如 SAP、IB、方案、CRF、SAS 等)以评估是否需要进行 TQT 研究。

在 pre-NDA2 会议中, FDA 就上市后 CMC 变更(在提交给 NDA 的原始文件中包含可比性 protocol )相关问题、拟提交的 clinical data package 是否足以支持 Lumasiran 用于成人和儿童 PH1 治疗等问题给出回复。
在前述所有的临床试验中都采用经验证的 ELISA 法检测血清中抗 Lumasiran 的 ADA,评价免疫原性。该方法检测针对 Lumasiran DS(即双链 GalNac-siRNA,包含 GalNAc 元件和 linker) 的 ADA。在 Lumasiran 的所有临床研究中,包括 PH1 患者和健康受试者,共6/100 (6%)检测出 ADA 阳性。ADA 最早在 D29 出现,但滴度较低,均为一过性。比较了 ADA 阳性和阴性 PH1 患者尿液和血浆草酸水平以及健康受试者血浆乙醇酸水平。Lumasiran 的安全性、药代动力学和药效学指标未见有临床意义的显著差异,因此未对 ADA 的中和活性进行检测。上述结果表明,Lumasiran 具有较低的免疫原性,且不会对疗效和安全性产生影响。
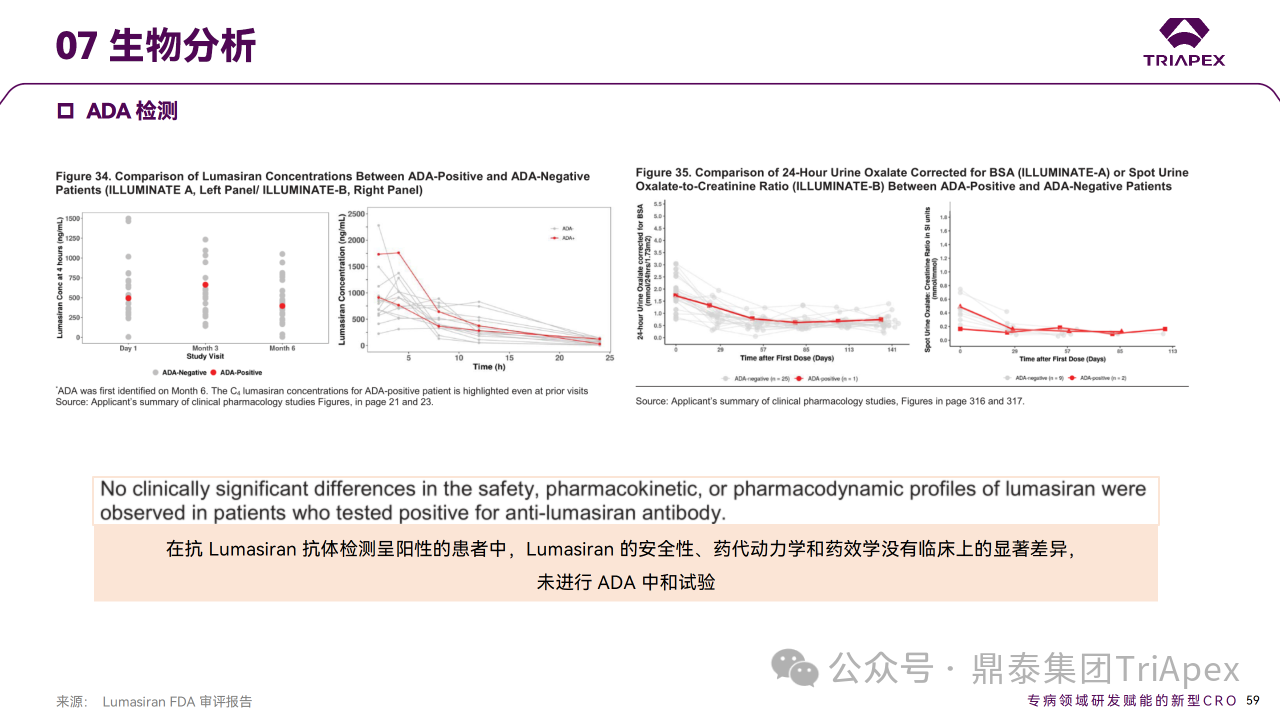
免疫原性检测方法和结果
Lumasiran 主要经核酸外切酶或内切酶进行降解。体外试验显示,Lumasiran 在大鼠、猴和人中均较稳定, AS(N-1)3′ 是主要代谢产物。通过分析给药后人的血浆和尿液(来源于临床研究 ALN-GO1-001),评价了 Lumasiran 在人体内的代谢情况。结果表明,尿液和血浆中主要代谢产物 AS(N-1)3’ 的比例<10%。笔者对上述试验所采用的生物分析方法进行了调研,检测方法为 LC-TOF-MS 法,分离方法为 SPE ,最低检出浓度为10 ng/mL,待测物包括 Lumasiran AS/SS 和代谢物。针对 siRNA 原形和代谢产物的检测,鼎泰集团内部已建立稳健的 SPE 和 LLE 分离手段、LC-MS/MS 检测方法,且具有更高的灵敏度。
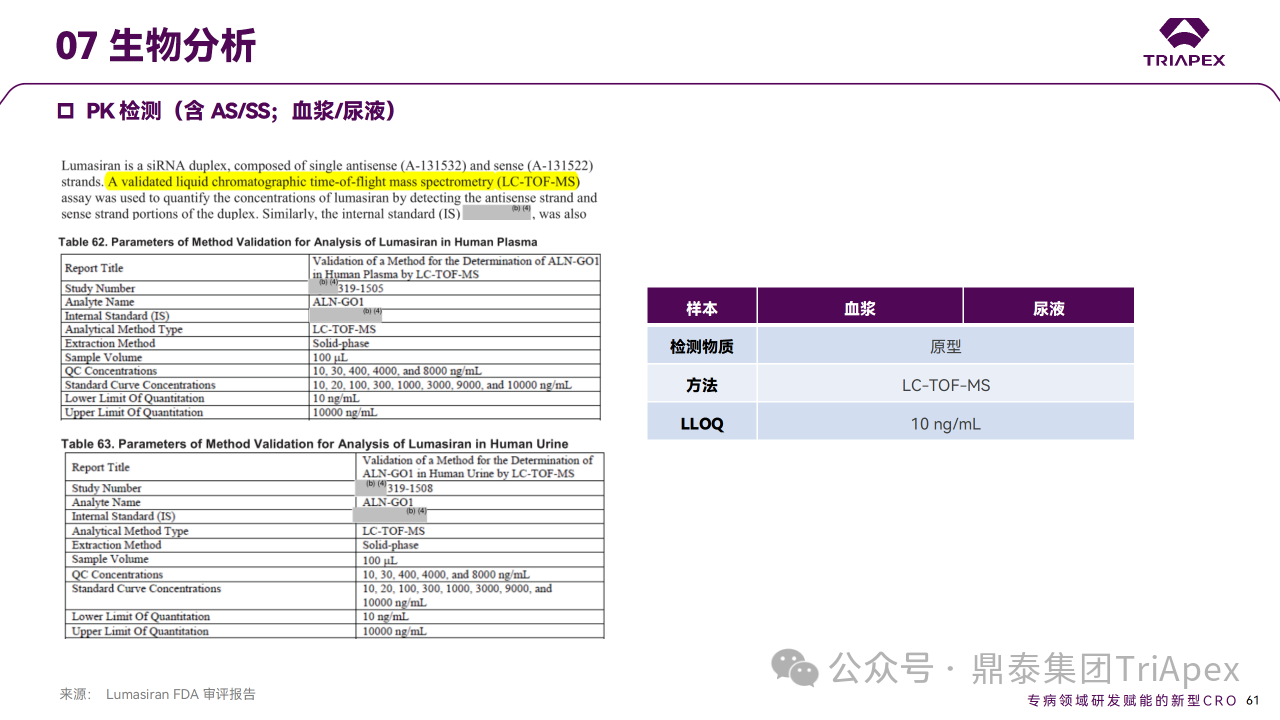
药代动力学检测方法学主要参数
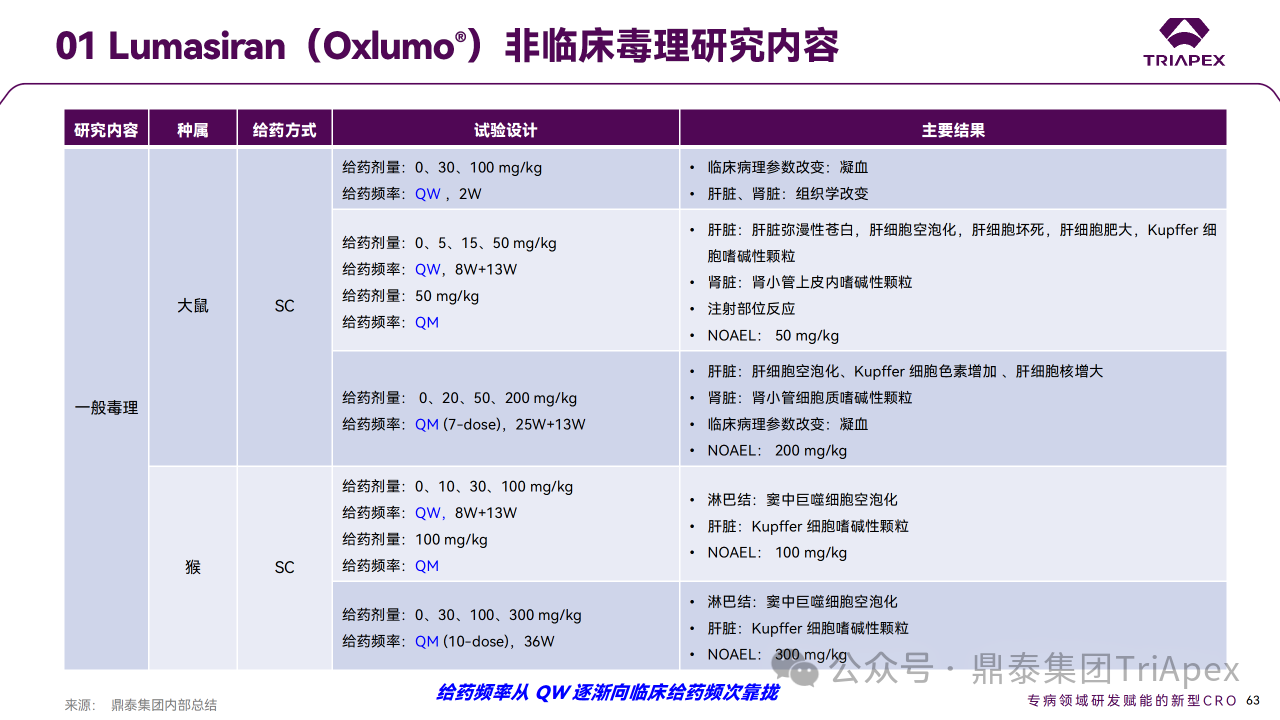
非临床研究的结果可以为临床试验的设计提供重要的依据,能够给临床试验带来参考和指导。此外,非临床研究还可以发现潜在的药物不良反应,为临床试验的安全性和有效性提供保障。

非临床研究与临床试验 PD marker 相关性分析
非临床药效学和毒理学研究结果为 FIH 提供了剂量设计依据。① NHP 中,1 mg/kg 显示中度肝脏 HAO1 mRNA 沉默,尿乙醇酸也相应升高,预期0.3 mg/kg 在人体中有低水平的药理学活性;② 根据 BSA 转换,无论 QW 还是 Q4W 给药,大鼠和 NHP 的 NOAEL 相对于该起始剂量的安全窗分别为 26.7 倍和 106.7 倍。
在非临床毒理学发现的 AE 可能预示药物在临床使用中会出现类似反应。在 Lumasiran 非临床中发现的注射部位反应在临床上也有表现。非临床试验数据和临床反应相结合,全面评估药物的安全性和风险。

Lumasiran 作为 FDA 批准的首款儿科用药的 siRNA 药物,纵观其上市历程和临床开发路径不难发现:与 FDA 的良好沟通互动,以及卓越的临床研究策略对于加快临床转化和推动产品上市至关重要。借助高效的药政策略,Alnylam 与 FDA 就产品上市历程中的关键问题进行了充分的沟通,并获得了 FDA 的认同和支持(如延后致癌性试验的完成时间、减少正式的幼龄动物研究),以及积极的开发建议。巧妙的临床研究规划既节省了患者数量(罕见病),又使得各项试验无缝隙衔接。此外,来自非临床研究积累的转化医学证据也为临床试验的设计提供了重要的参考,如起始剂量和给药间隔的设定、有助于提示疗效和/或毒性且可监测的生物标志物等。综上,Lumasiran 的成功经验为 siRNA 药物的研发提供了宝贵的借鉴,如重视与监管机构的沟通、优化临床试验设计、充分利用非临床研究结果指导临床等。这些策略和做法也为后续 siRNA 药物的研发提供了宝贵的经验和启示。
[1] Lumasiran: First Approval
[2] US FDA. FDA approves first drug to treat rare metabolic disor-der. 2020.
[3] US FDA. 214103Orig1s000, ADMINISTRATIVE and CORRESPONDENCE DOCUMENTS.
[4] US FDA. 214103Orig1s000, INTEGRATED REVIEW.
[5] European Medicines Agency. Oxlumo 94.5 mg/0.5 mL, solution for injection: summary of product characteristics. 2020.
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容
