
2024-06-24 17:12:25来源: 鼎泰浏览量:703
中枢神经系统(Central nervous system,CNS)疾病已经成为一项重大全球健康问题。据评估,全球遭受 CNS 疾病困扰的人口数量已经超过 10 亿,这使得 CNS 药物的临床需求和市场空间极大。然而,对 CNS 疾病病理机制认识的不足、血-脑屏障(BBB)和血-脑脊液屏障对药物递送的阻碍、临床前动物模型数据转化性较差,以及较高的临床失败率等因素,共同导致 CNS 药物的研发面临重重障碍,被视为“研发黑洞”。
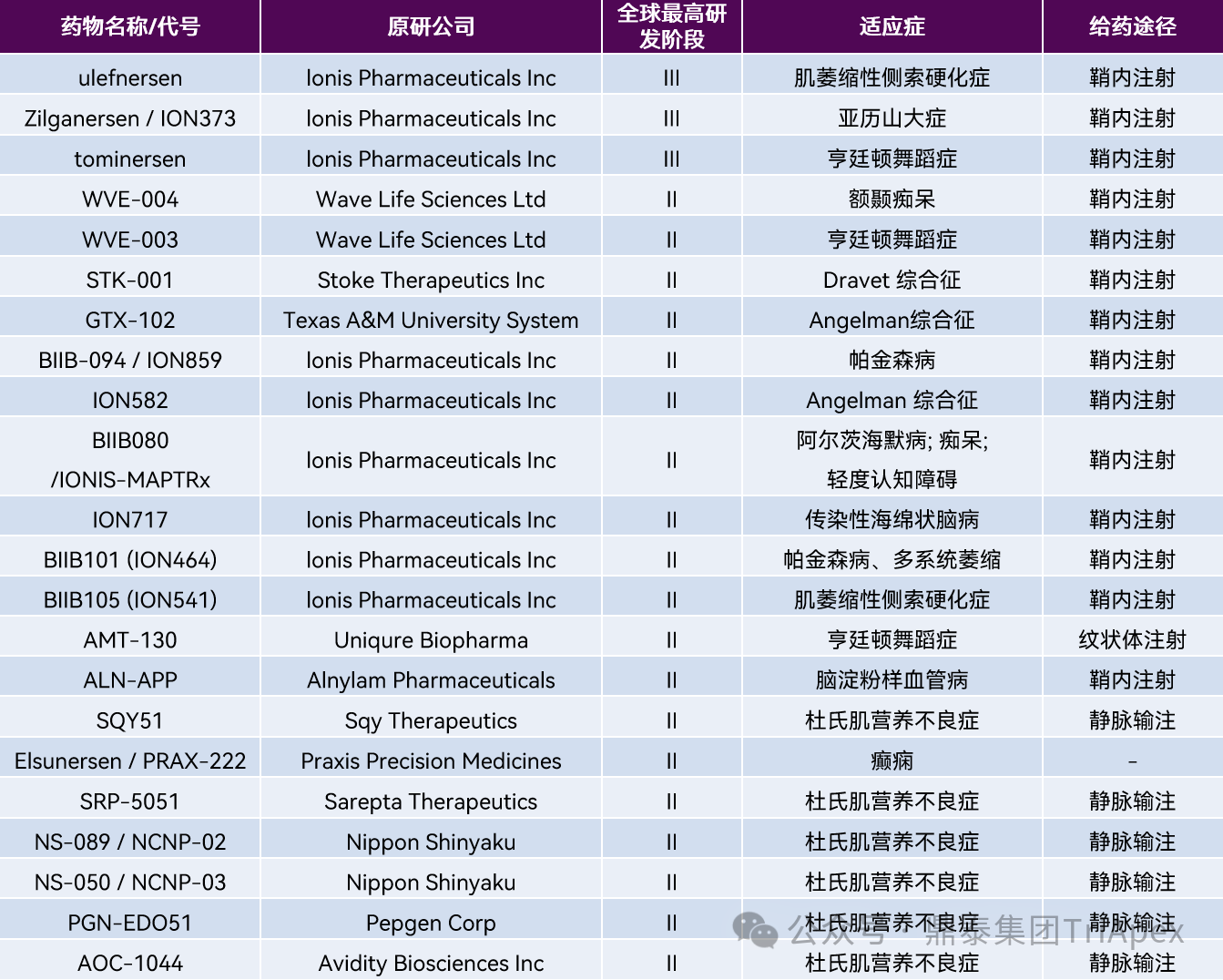
近年来,以反义寡核酸(Antisense oligonucleotide,ASO)和小干扰 RNA(Small interfering RNA,siRNA)为代表的寡核苷酸药物带来了继小分子药物和抗体药物之后的新药发展第三次浪潮。与传统药物相比,寡核苷酸药物直接与靶 RNA 结合,抑制翻译或调控,其特异性更高、研发周期更短,并可靶向许多难以成药的特殊靶标。在以 CNS 疾病为适应症的领域,寡核苷酸药物的研发势头日益高涨。迄今为止,在已上市的 20 款寡核苷酸药物中,有 10 款用于治疗 CNS 疾病(表1),另有多个药物处于 Ⅱ 期及以上临床研究阶段(表2)。这些寡核苷酸药物中,以 ASO 为主,下文所述内容主要针对 ASO 药物进行展开。
表1:已批准上市的用于治疗 CNS 疾病的寡核苷酸药物
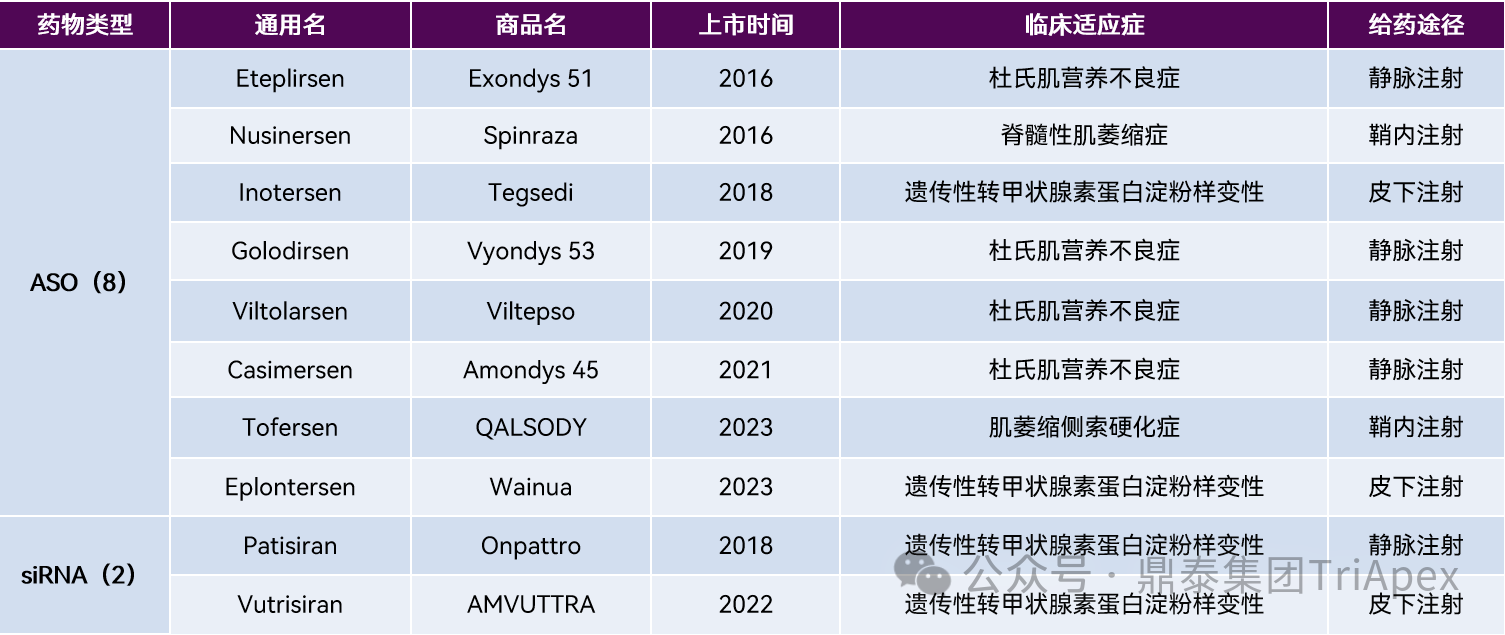
表2:全球处于临床 Ⅱ 期及以上治疗 CNS 疾病的寡核苷酸药物
由于 ASO 分子量较大,一般较难通过简单扩散穿过血-脑屏障(BBB)并在 CNS 中达到有效浓度。研究表明,在系统给药后,只有不到 1% 的 ASO 能进入大脑[1,2]。因此,为使 ASO 成功跨越 BBB 进入 CNS,往往需要采取特殊的递送策略。
目前,中枢直接递送 ASO 的主要方式包括:系统性给药、鼻腔吸入给药、脑室内注射给药和鞘内注射给药(图1)[3]。其中,鞘内注射或脑室注射可直接将 ASO 递送至脑脊液中,是目前临床上 ASO 进入 CNS 的主流给药途径。虽然枕大池注射也是将药物直接注入脑脊液中的一种方式,但一般不用于重复给药试验,因为其手术风险较高,操作不当可能穿透脑干或小脑,破坏维持生命所需的关键结构。鞘内注射对于脊髓和背根神经节的分布效率更强,而枕大池注射可能更有利于转导脑干和小脑[4]。与系统给药相比,上述局部直接中枢给药方式能使脑脊液中的药物浓度迅速升高,无需大剂量给药。同时,脑脊液和脑实质之间存在自由交换,而 BBB 可抑制 ASO 进入外周循环,保证了药物分子在 CNS 内高浓度,全身暴露量低,因此潜在的系统毒性风险低。但是,CNS 直接递送的局限性也很明显,例如侵入式给药可能会导致与手术操作相关的不良反应(如注射部位疼痛和神经组织损伤等),这可能会给组织病理学评估其供试品相关性带来一些干扰。
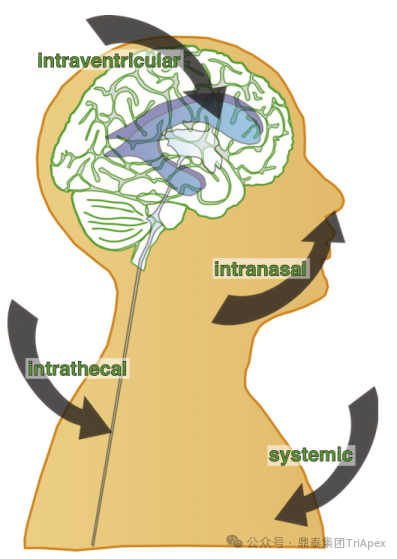
图1 寡核苷酸药物递送至中枢的途径[1]
鼎泰团队已高效完成多个经 CNS 递送的 ASO 药物及其他 new modality 的非临床研究,我们根据本团队经验及相关文献,简要概述了向啮齿类动物(大鼠、小鼠)及非人灵长类动物(Non-human primates,NHP,主要为食蟹猴和恒河猴)CNS 直接递送 ASO 的操作技术及特殊考虑,并对这些递送方式相关的组织病理学变化进行汇总和解释,阐明这类药物研发中安全性评估的挑战。
★ 文章导览 ★
01 | ASO 的中枢递送方式简介 |
02 | 中枢神经药物直接递送与组织病理学改变 |
03 | 结语 |
01
ASO 的中枢递送方式简介
1. 鞘内注射
鞘内注射直接将药物注入脊髓蛛网膜下腔,药物可以随脑脊液流动弥散至整个脑室系统,并通过软脑膜进入脑实质[5]。虽然大鼠、食蟹猴等较大的动物也可以采用重复侧脑室注射给药,但通常鞘内注射更为常用,主要原因为:
(1)大部分情况下鞘内注射是更接近人类临床的给药途径;
(2)鞘内注射不需要直接穿过大脑皮层,大大减少了对局部皮质组织和周围神经的潜在损害。寡核苷酸药物往往需要多次给药,鞘内重复给药操作的安全性更高;
(3)大动物的腰池体积大,鞘内注射操作更为简便。
不同动物鞘内给药的操作流程大致相似,但方法细节和具体给药部位还需考虑动物种属的解剖学差异或年龄因素。
1.1 大、小鼠
通常在成年大鼠和小鼠中进行鞘内注射,需将动物俯卧位固定消毒,从腰椎间隙缓慢进针,以尾巴出现颤动或突然的侧向甩动作为穿刺成功的标志。
新生小鼠鞘内给药技术目前尚未应用于上市寡核苷酸药物的临床前评价中,但已有文献报道了规范的操作步骤[6],与成年动物相比主要有以下区别:
(1)新生小鼠可使用低温麻醉,应注意避免低温时间过长带来的潜在风险;
(2)由于新生小鼠个体较小,可使用解剖显微镜辅助进行穿刺位点的确认。
(3)注射位点为两侧骨盆带之间的中线的椎间隙;
(4)关注推注速度和体积;
(5)注重术后保温。
1.2 NHP
NHP 是寡核苷酸药物非临床毒理研究最常用的动物种属。成年和幼龄 NHP 鞘内注射时的麻醉、消毒、动物姿态、停针等步骤大致相同。由于不同年龄动物体型差异,注射位点可能会有所不同,对于 15 个月或以上的动物,可在 L5~L6 穿刺;对于年幼的动物(9 至 15 个月),在 L4~L5 进行穿刺[7]。NHP 鞘内注射体积有一定的限制,给药体积较大时可能会导致脑脊液容量改变和颅内压升高,带来的严重并发症如恶心、呕吐、头痛、意识混沌和脑疝等,这可能导致额外的组织病理学改变。
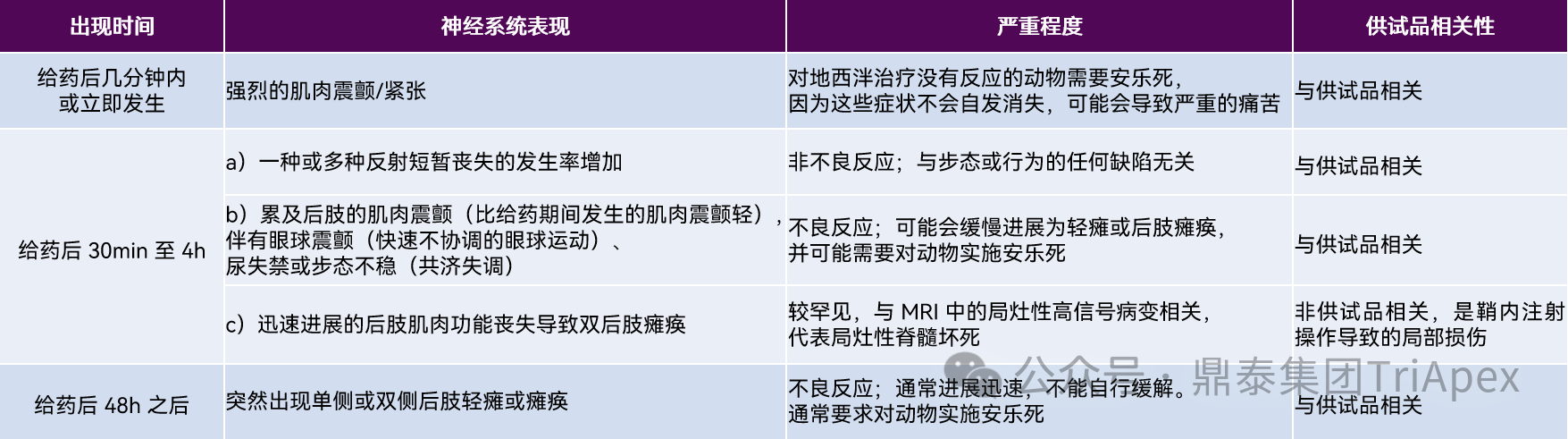
文献研究表明,食蟹猴重复鞘内注射 ASO 可能出现一系列神经系统变化[7],这些变化出现的时间、症状表现、严重程度及与供试品的相关性在表3中进行了总结。
表3:食蟹猴鞘内注射重复给予 ASO 药物后的一系列神经系统症状[7]
2. 脑室内注射
在临床上,具有神经活性的寡核苷酸药物最常用的局部给药途径是鞘内注射,但小鼠或幼龄啮齿类动物椎管和腰池体积小,重复鞘内注射操作困难、风险较高。在这种情况下,侧脑室是更为可靠的注射位点。进入脑室的药物途经室管膜细胞层进入实质发挥作用,文献研究表明,小鼠重复侧脑室注射与大鼠及 NHP 重复鞘内注射后,ASO 在脑和脊髓中的分布相似[8]。小鼠或幼龄啮齿类动物可进行单侧或双侧脑室注射,新生小鼠脑容量小,注射体积有限,通常不超过 5μL/单侧脑室[9]。双侧脑室注射可以给予更大容量的药物,有助于药物在大脑中实现更广泛的分布,但由于手术操作带来的机械损伤也会更大。小鼠重复脑室内注射通常限制在不超过 5 次,以防止由于累积的局部组织损伤引起的发病率和/或死亡率,每次沿同一轨迹穿刺会尽可能减少这种损伤[8]。新生小鼠侧脑室注射常在动物出生后的第 1 周内进行,随着动物年龄的增长,注射操作会变得越来越具有挑战性,对动物的伤害也会越大[9]。
对于成年的啮齿类动物和 NHP,鞘内注射往往是向 CNS 内递送寡核苷酸药物的首选方式,较少采用侧脑室注射。
02
中枢神经药物直接递送与组织病理学改变
中枢神经药物直接递送可能导致一些局部组织病理学改变。如何区分是给药操作导致改变还是供试品导致的改变变得非常挑战。首先是因为对照组和供试品组的组织病理变化通常很相似,差异可能只是发生率和严重程度不同。其次,非啮齿动物的非临床研究中每组动物数量较少(一般为 5 雌 5 雄),这增加了判断操作相关或供试品相关变化的难度。
在进行病理学评估时,研究人员需要详细检查一系列神经组织,包括脑和脊髓,以及注射部位。脑和脊髓均可以根据需要进一步采用分区域取材。样本在中性缓冲福尔马林(NBF)中固定 24 到 48 小时,并切片为 4 到 5μm。对于一般筛查,切片用苏木精-伊红(H&E)染色[10]。如果需要,可以将特殊的神经组织学方法应用于选择的 CNS 区域或结构的连续切片,以更好地表征供试品递送方式或供试品本身的组织反应[11]。
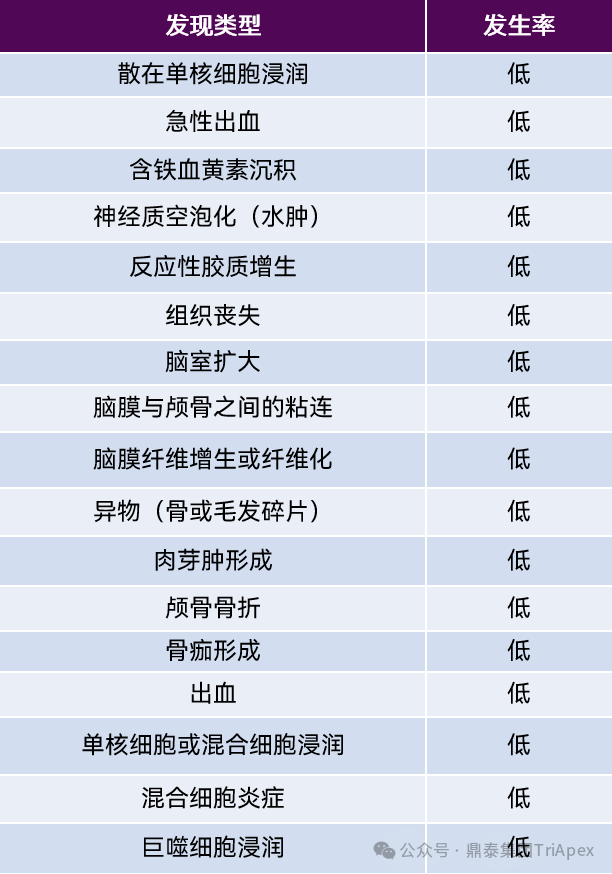
表4:脑室内注射小鼠对照组中的操作相关显微镜发现[10]
1. 鞘内注射
2.1 大、小鼠
在大鼠鞘内注射研究中,操作相关的显微镜发现包括有脑轻度单核或混合细胞浸润,急性实质性和/或脑膜出血灶,白质束内轻度神经纤维变性和散在的胶质增生等改变。脊髓最常见的发现是注射部位及其附近节段的背束和/或侧束白质的不对称神经纤维变性,局部单核或混合细胞浸润、脑膜和脊髓周围结缔组织的局部纤维化、异物肉芽肿、脑膜和/或实质性出血以及胶质增生。外周神经系统最常见的发现包括 DRG 中的神经纤维变性,通常局限于脊神经根,以及 DRG 神经元场和/或周围结缔组织中的单核细胞浸润。坐骨神经中的神经纤维变性通常也是轻度的。详见表5。
表5:鞘内(IT)注射后对照大鼠常见操作相关显微镜发现的发生率[10]
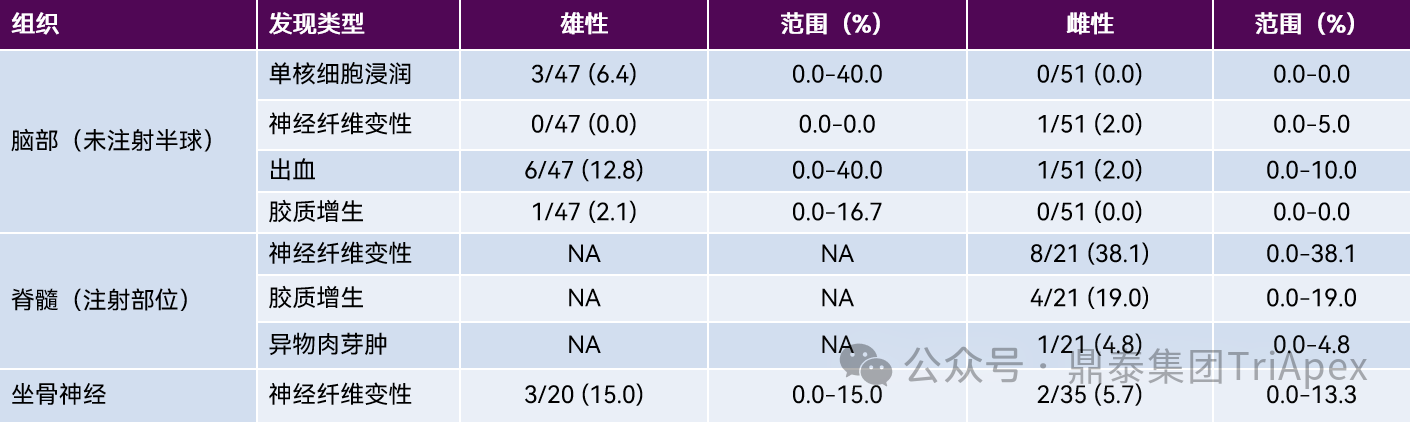
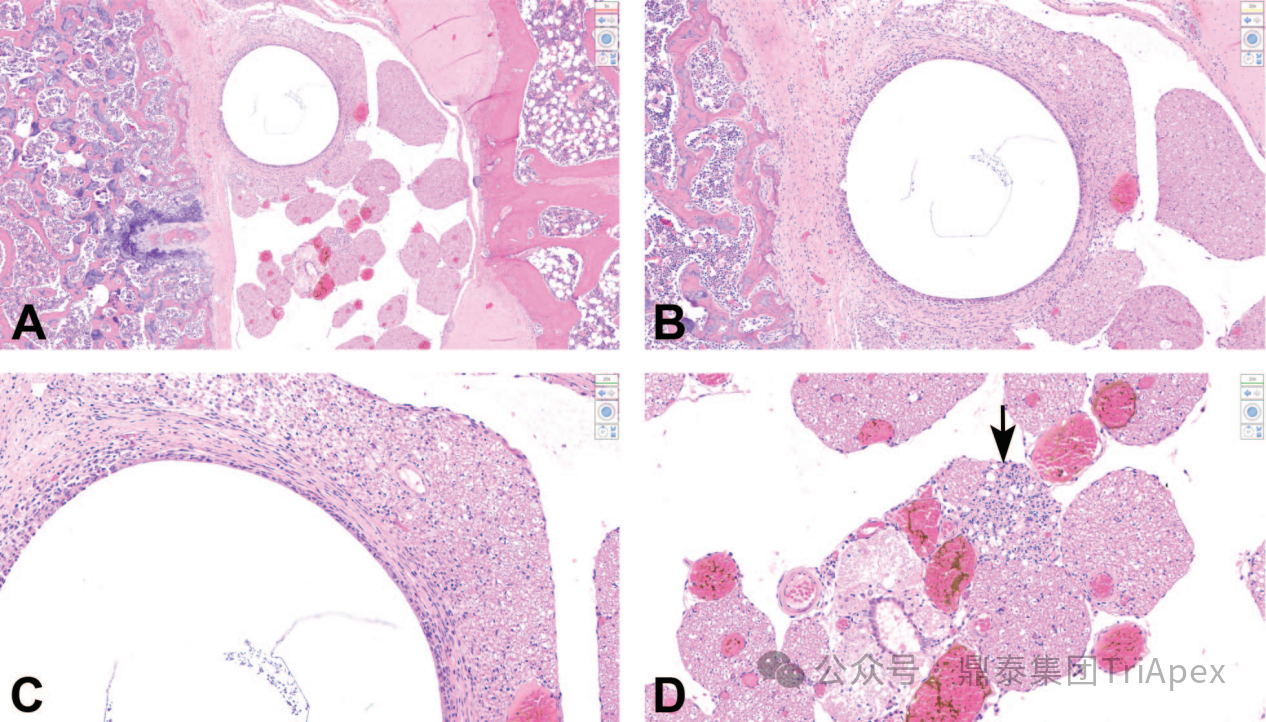
图2 与大鼠鞘内导管插入相关的发现,导管插入点邻近腰骶脊髓[10]
图2A:多根脊神经根旁边的鞘内导管位置表示为一个圆形的透明区域。
图2B和图 2C:放大后,导管位置周围有纤维化环,表示对导管的局部慢性反应。密集的纤维组织与脑膜连续并压迫附近的神经根。
图2D:受影响的神经根中可以看到轻度的神经纤维变性和神经胶质(Schwann细胞)增生(箭头),许多局部毛细血管充血。
2.2 NHP
在非人灵长类动物的鞘内注射研究中,常见的操作相关性改变包括有脑白细胞浸润,主要在脑膜、脉络丛、神经实质和/或血管周围。其它变化还可能有脑膜和/或实质性出血、胶质增生、充血和脑膜纤维化。脊髓脑膜、血管周围间隙、神经实质和/或相关的脊神经根中的单核细胞浸润,脊髓白质或相关神经根中的神经纤维变性,胶质增生,脑膜和/或实质性出血,脑膜纤维化和慢性炎症(有时描述为“肉芽肿性”)。DRG 和相关神经根可见神经元自噬、单核细胞浸润和矿化。常见的变化还包括神经纤维变性、单核细胞浸润、水肿和胶质增生。坐骨神经中常见的变化包括单核细胞浸润、水肿和矿化。详见表6。
表6:鞘内(IT)注射后对照食蟹猴常见操作相关显微镜发现的发生率[10]
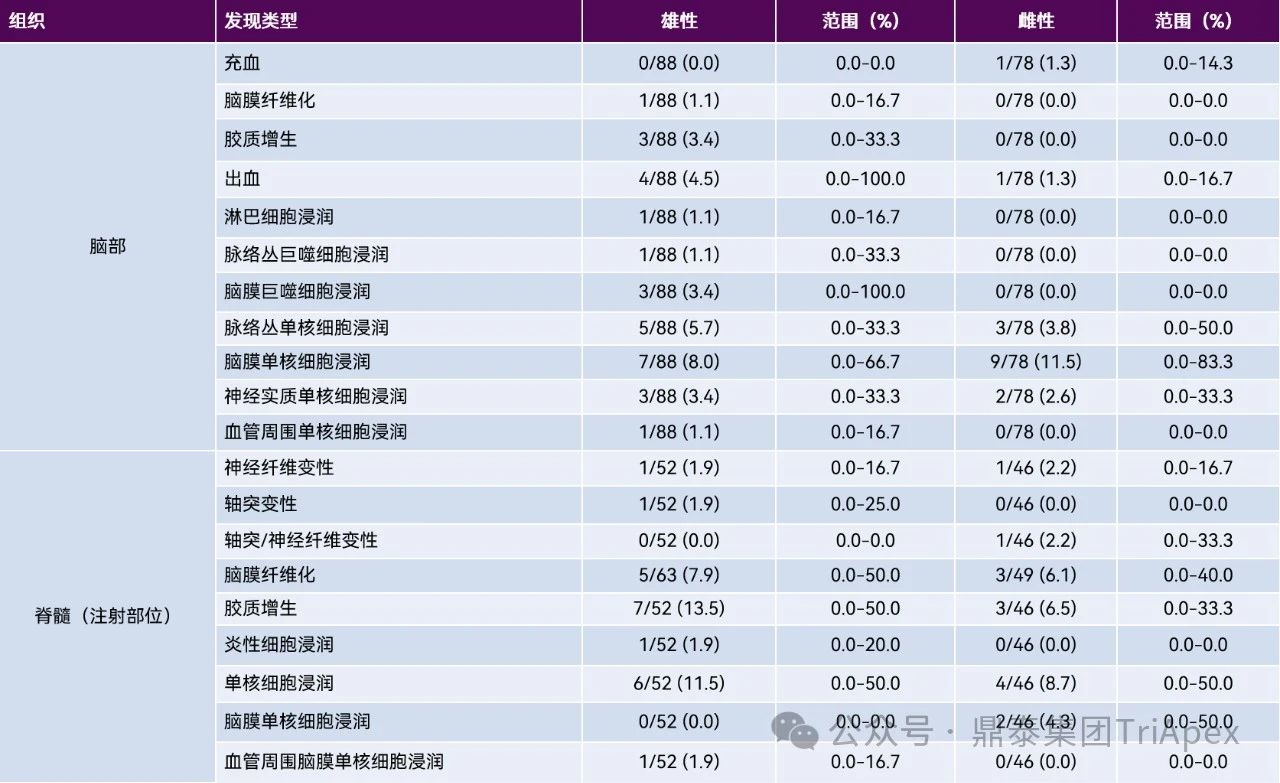
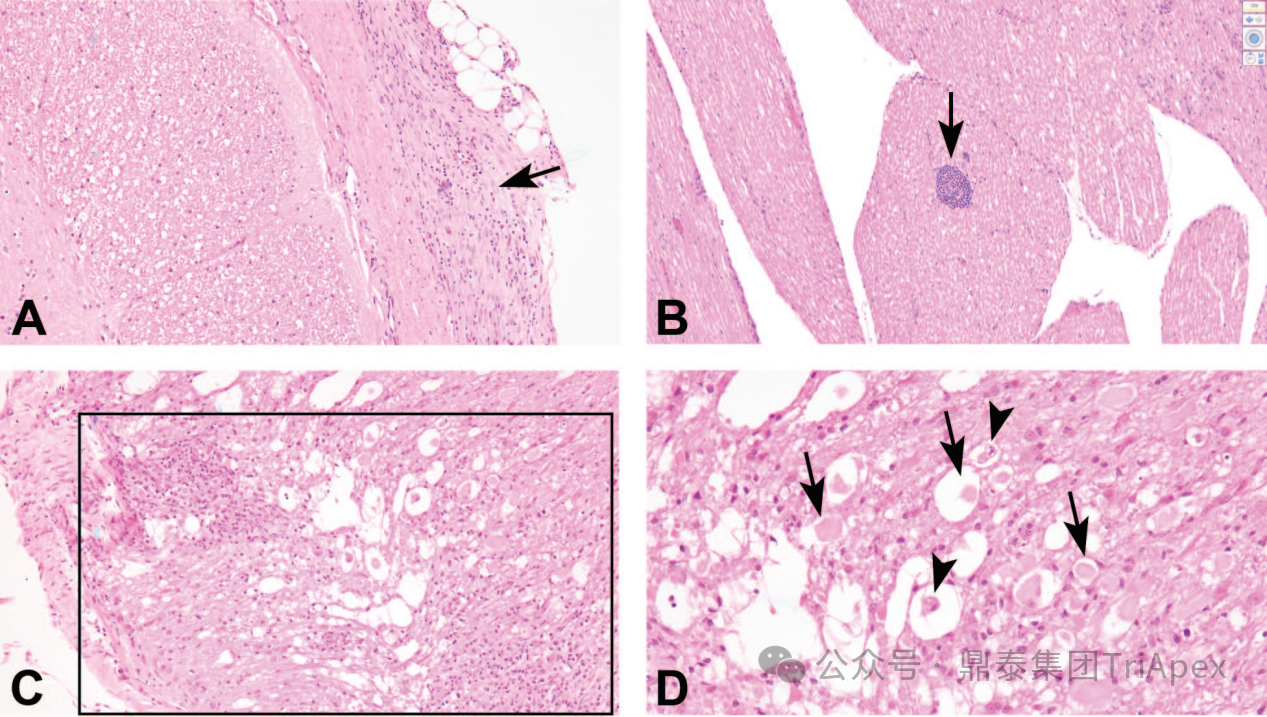
图3 猕猴腰池鞘内注射部位的操作相关发现
图3A:脑膜中与混合细胞浸润相关的纤维化(箭头)。
图3B:马尾神经根中的血管周围单核细胞浸润(箭头)。
图3C和图3D:脊髓白质中伴有神经胶质增生和单核细胞浸润的神经纤维变性(盒中区域)。受影响区域内有肿胀和/或碎裂的嗜酸性轴突(黑色箭头)和消化室(黑色箭头)。
2. 脑室内注射
有文献报道在小鼠的脑室内注射研究中,注射部位局部发现包括各种脑膜层之间和/或脑膜与颅骨之间的粘连,脑膜纤维增生或纤维化,异物(通常是骨或毛发碎片),伴有或不伴有肉芽肿形成,颅骨骨折有时伴有骨痂形成,出血,单核细胞或混合细胞浸润,混合细胞炎症和/或巨噬细胞浸润。
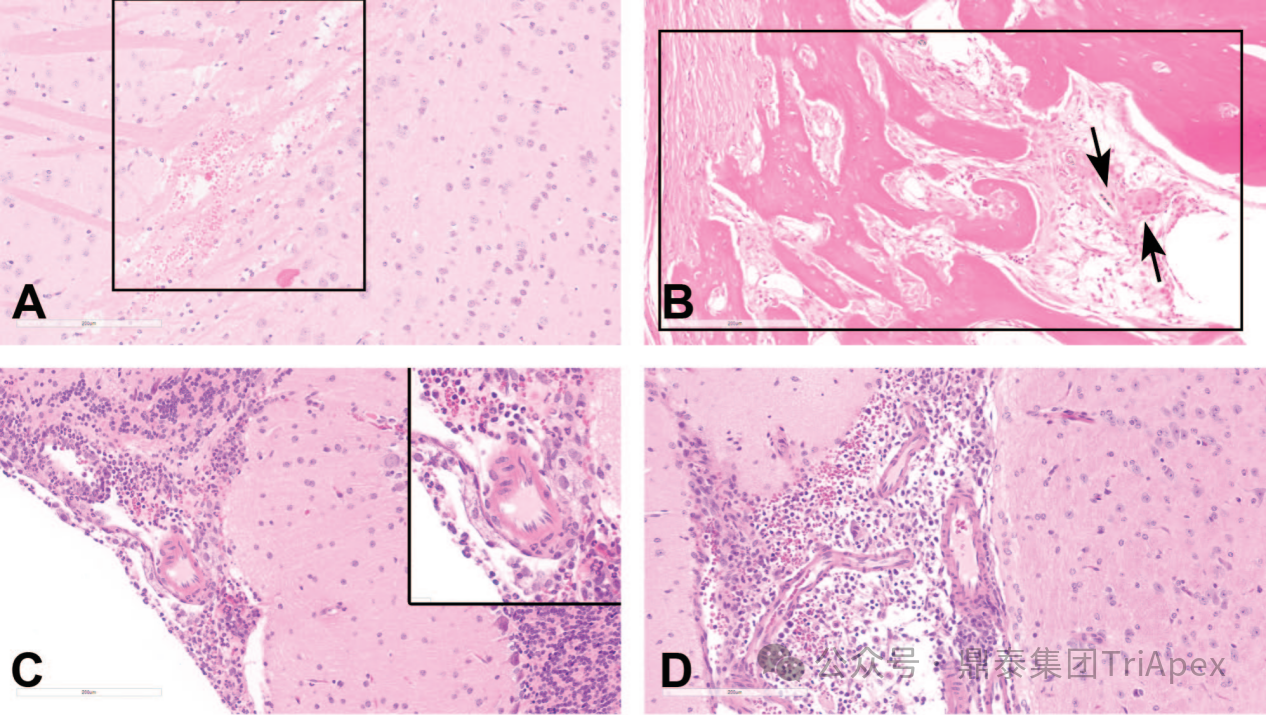
图4 小鼠脑室内(ICV)注射相关的发现[10]
图4A:小鼠大脑皮层周围脑室周围水肿和出血(框选区域)。
图4B:注射部位脑膜的纤维-骨增生。注意脑膜中的新生成纤维组织和骨组织(框选区域),以及附近的自由毛发轴,周围有单核细胞、巨噬细胞和一个多核巨细胞(黑色箭头)。
图4C和图4D:小脑脑膜(图2C及插图)和侧脑室(图4D)内的混合细胞炎症和出血。
03
结语
随着寡核苷酸药物的研发,中枢递送给药方式也逐渐推广应用。在这类药物研发中安全性评估有一定挑战, 例如给药操作相关的病理学变化与供试品相关的病理学变化可能呈现出相似性。我们需对病变进行仔细检查,结合病理改变的特点,发生率和严重度,以及测试物的信息等进行综合的毒性评估。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容


微信公众号

药方舟手机版


