
6月24日,Alnylam今天宣布了其siRNA药物vutrisiran的HELIOS-B 3期临床研究的阳性结果,该研究是一种正在开发的用于治疗ATTR淀粉样变性伴心肌病(ATTR-CM)的RNAi研究药物。
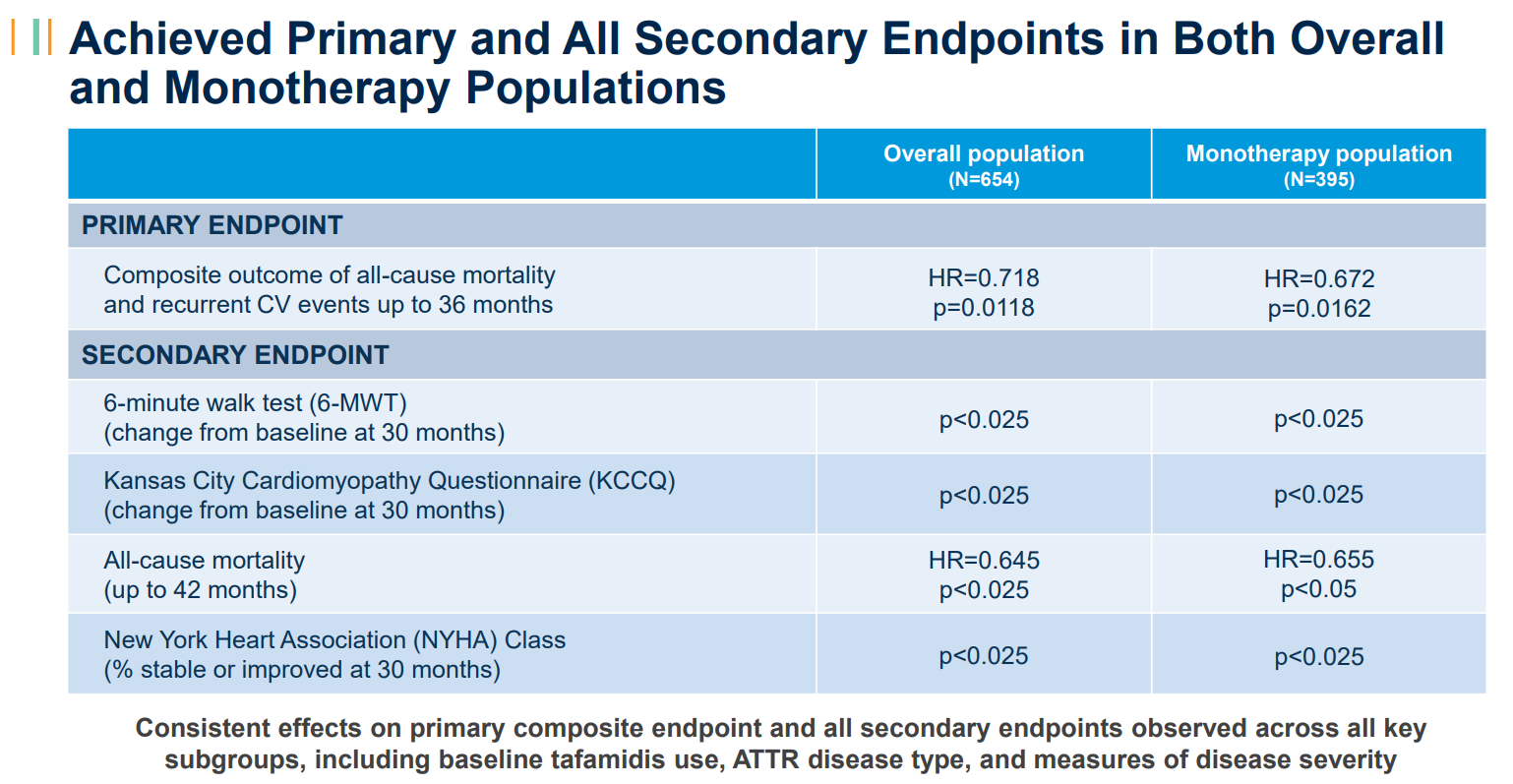
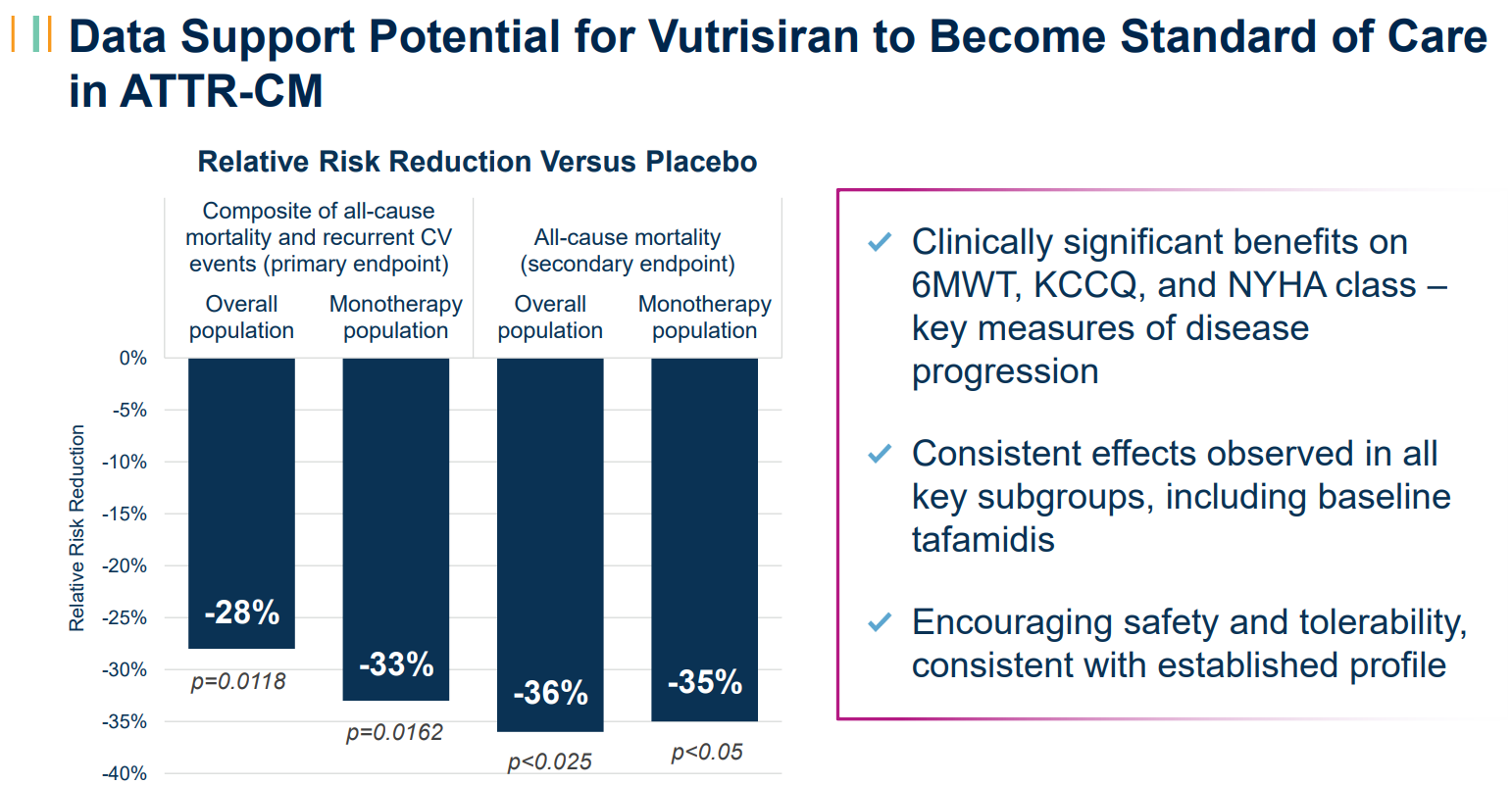
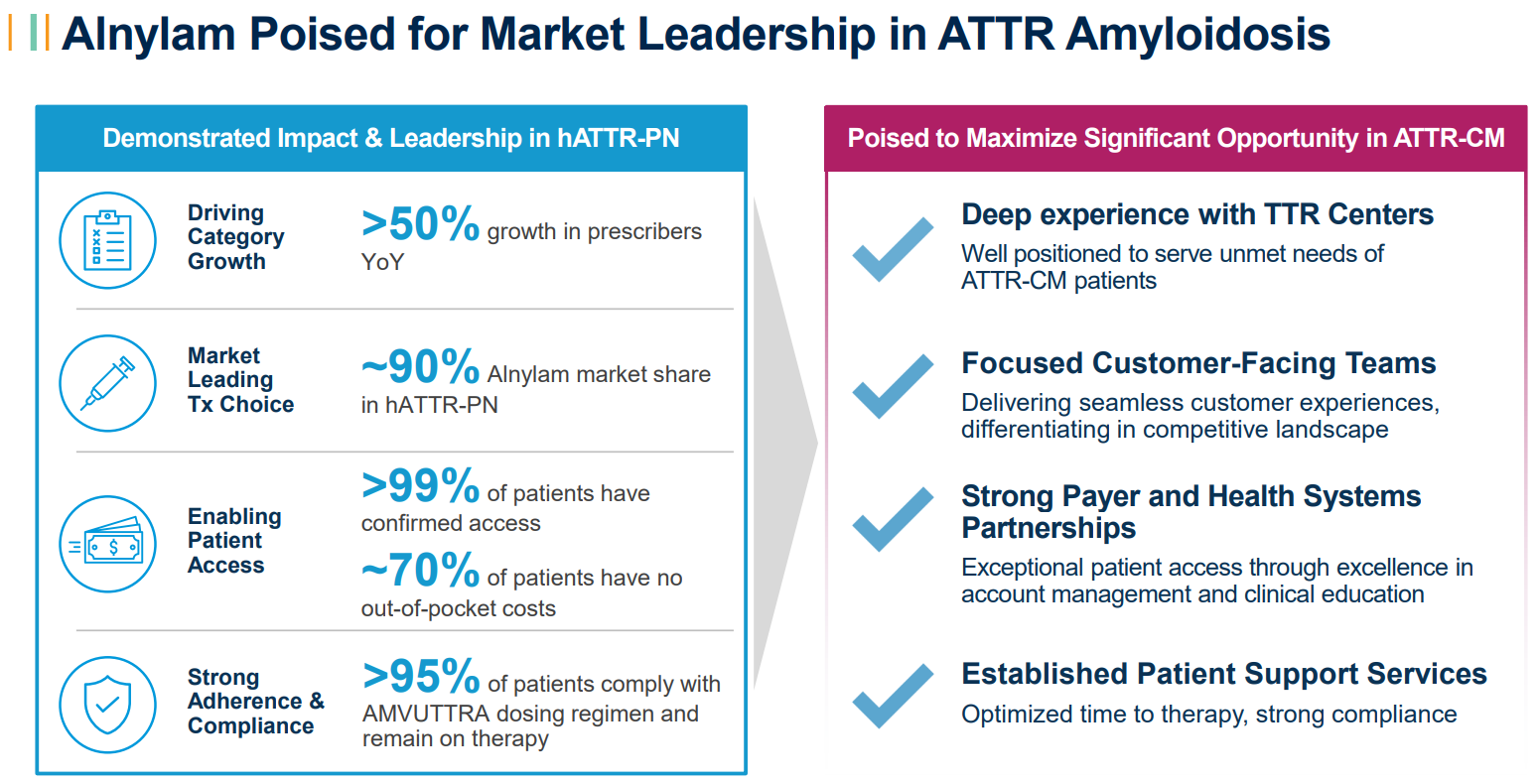
该研究达到了主要终点,证明在双盲期内,总体人群(HR 0.718,p值0.0118;n=654)和单药治疗人群(基线时未接受tafamidis治疗的患者;HR 0.672,p值0.01 62;n=395)的全因死亡率和复发性心血管(CV)事件的复合物在统计学上显著降低。该研究还表明,在总体和单药治疗人群中,所有次要终点都有统计学上的显著改善。这包括疾病进展的关键指标:6分钟步行测试(6-MWT)、堪萨斯城心肌病问卷(KCCQ)和纽约心脏协会(NYHA)第30个月的评分(所有评分均<0.025)。重要的是,vutrisiran治疗还降低了截至第42个月的总人群(HR 0.645,p<0.025)和单药治疗人群(HR 0.655,p<0.05)的全因死亡率。这是一项预先指定的意向治疗分析,包括来自开放标签扩展的长达六个月的数据。Alnylam首席医学官Pushkal Garg医学博士说:“HELIOS-B研究的这些压倒性的积极数据让我感到兴奋,这些数据表明,vutrisiran有潜力满足ATTR淀粉样变性伴心肌病患者的需求,这是一种稳步进展、使人衰弱并最终致命的疾病。研究结果表明,vutrisiran改善了所有ATTR心肌病患者群体的心血管结果,包括生存率、功能和生活质量。我们正在紧急向监管机构提交这些令人信服的数据,将这种药物带给世界各地的患者。”此外,vutrisiran对所有关键亚组的主要复合终点和所有次要终点表现出一致的影响,包括tafamidis的基线使用、ATTR疾病类型和疾病严重程度的测量。在HELIOS-B研究中,vutrisiran显示出令人鼓舞的安全性和耐受性,与其既定的特征一致。vutrisilan组和安慰剂组的不良事件(AE)、严重AE和导致研究药物停用的AE发生率相似。与安慰剂组相比,vutrisiran组的AE发生率没有增加≥3%。Alnylam首席执行官Yvonne Greenstreet表示:“我对HELIOS-B研究的结果感到非常高兴,这表明vutrisiran有可能成为ATTR淀粉样变性伴心肌病患者的变革性药物。假设监管审查有利,vutrisiran有可能成为治疗这种疾病的新标准,推动Alnylam的下一个大幅增长时代。”HELIOS-B(NCT:NCT04153149)是一项3期、随机、双盲、安慰剂对照的多中心全球研究,旨在评估vutrisiran在降低全因死亡率和复发性心血管事件方面的疗效和安全性,作为ATTR淀粉样变性伴心肌病患者的主要复合终点。该研究将655名成人ATTR淀粉样变性(遗传型或野生型)伴心肌病患者随机分组。在长达36个月的双盲治疗期内,患者被1:1随机分组,每三个月皮下接受一次25mg vutrisiran或安慰剂。双盲期结束后,所有仍在研究中的符合条件的患者都可以在开放标签延长期内接受vutrisiran治疗。HELIOS-B研究的详细结果已作为最新的摘要提交给欧洲心脏病学会进行介绍。Alnylam计划从今年晚些时候开始进行全球监管提交,包括使用优先审查凭证向美国FDA提交补充新药上市申请。AMVUTTRA®(vutrisiran)是一种RNAi治疗药物,可快速敲低突变型和野生型转甲状腺素(TTR),解决转甲状腺素(ATTR)淀粉样变性的根本原因。AMVUTTRA每季度通过皮下注射给药,已在15多个国家获得批准并上市,用于治疗成人遗传性转甲状腺素介导的淀粉样变性(hATTR-PN)的多发性神经病。Vutrisilan也在开发用于治疗ATTR淀粉样变性伴心肌病(ATTR-CM)的药物,该疾病包括野生型和遗传型。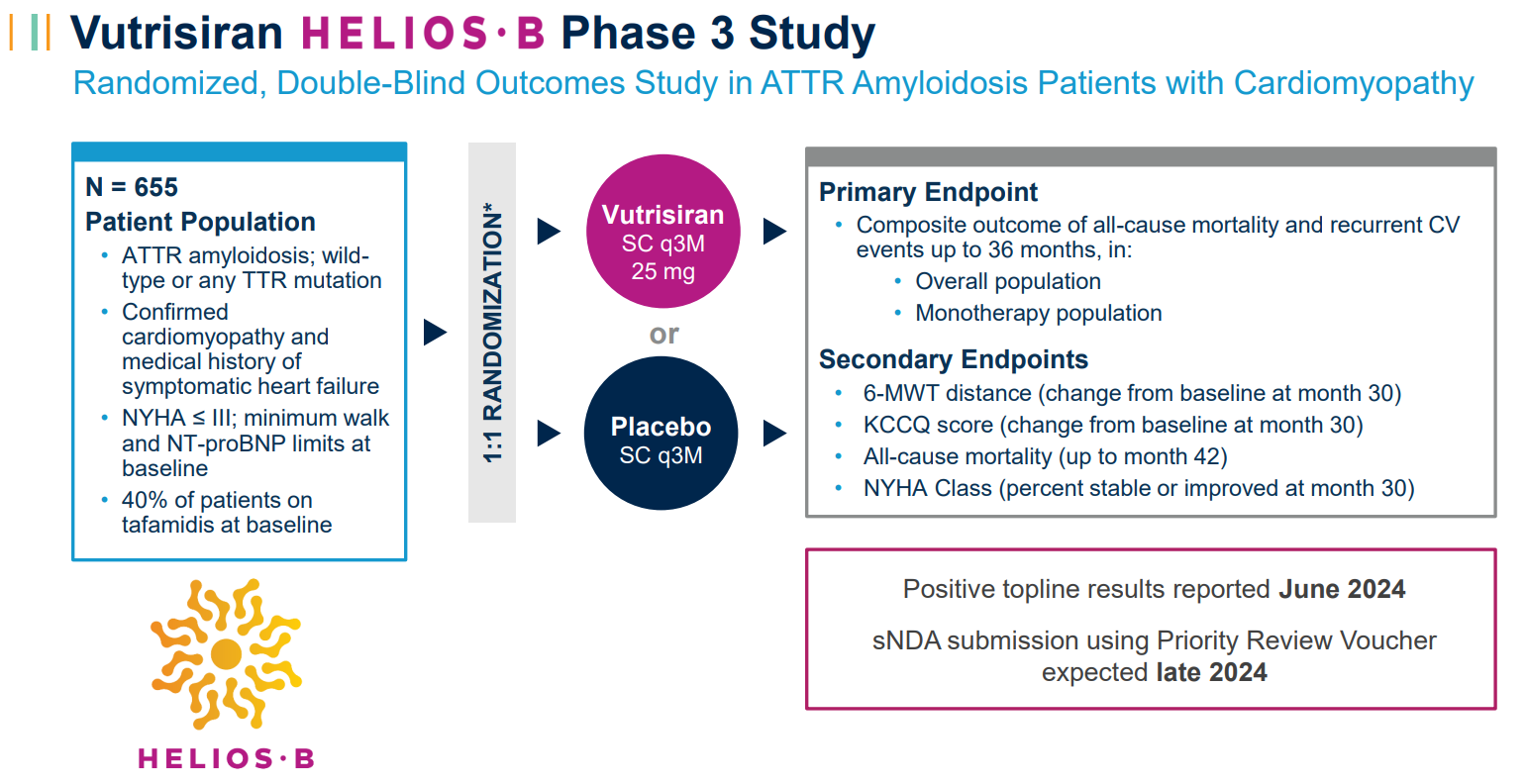


声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容
