
2024-06-27 11:21:19来源:医药观澜浏览量:4150
▎药明康德内容团队编辑
根据中国国家药监局(NMPA)官网批件信息及公开资料统计,截至6月26日,2024年上半年共有43款新药*首次在中国获批上市,其中1类创新药有21款;另外还有约40款新药在中国获批一项或多项新适应症/新剂型。(*本文中“新药”的统计范围包括:化学药品1类和5.1类、治疗用生物制品1类和3.1类,不含疫苗类产品)
梳理上半年在中国获批上市的新药,我们发现以下特点:
首次获NMPA批准上市的新药中,1类创新药有21款,占比约为50%。这些新药中有4款来自国际药企,包括卫材/渤健、诺华、罗氏、诺和诺德;其余十多款来自恒瑞医药、海思科、正大天晴、康方生物、科济药业等中国公司,其中正大天晴有3款1类新药迎来获批上市,海思科、再鼎医药均有2款新药获批上市。
从适应症来看,首次获NMPA批准上市的新药中,抗肿瘤适应症最多,占比约为35%;其次是代谢类疾病和罕见病,占比均为16%左右。其中代谢类疾病中有6款新药均针对2型糖尿病。
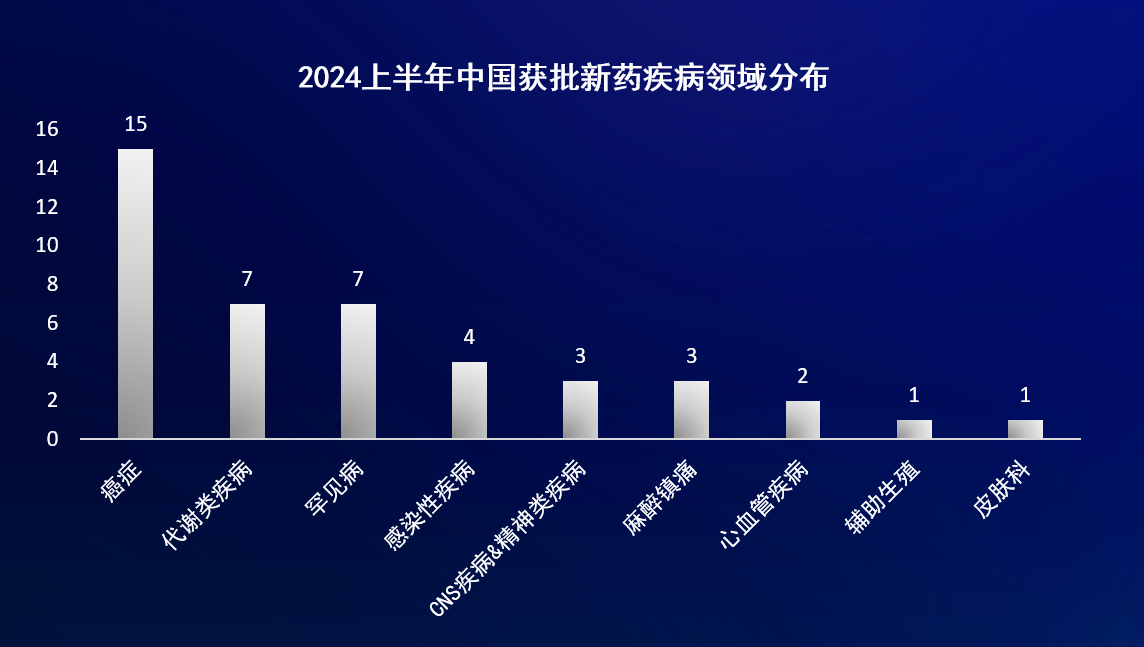
从药物类型来看,首次获NMPA批准上市的新药中,小分子新药占比最多,达到60%,这些新药的靶点涵盖SGLT-2、CGRP、ROS1、EGFR、ALK、DPP4等;其次是单克隆抗体药物,占比为16%,包括了皮下注射的抗HER2单抗复方制剂、每月一次的CGRP单抗、长效抗RSV单抗、抗Aβ单抗、每四周一次的抗C5单抗等等。
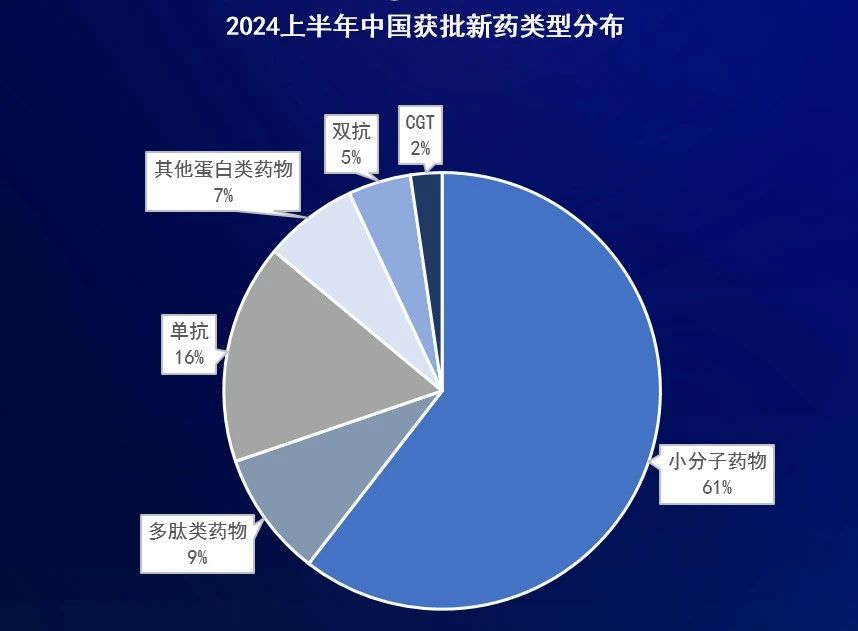
除了首次获批上市的新药,还有约40款新药在中国获批了44项新适应症/新剂型,其中抗PD-1/L1单抗获批了10项新适应症,数量最多,JAK抑制剂、酪氨酸激酶抑制剂、GLP-1受体激动剂等新适应症的获批也备受关注。
多款境外新药或新适应症在中国实现了全球首次获批,意味着这些新药正在以更快的速度惠及中国患者。比如:罗氏的新型抗C5循环单克隆抗体可伐利单抗在中国实现全球首批、勃林格殷格翰的罕见皮肤病创新药佩索利单抗(皮下注射)在中国实现全球首发、艾尔建美学A型肉毒毒素针对咬肌突出的新适应症在中国实现全球首批……
以下将介绍上半年首次获NMPA批准上市的1类新药。(扫描文末二维码,您将可以获取由我们整理的《2024上半年中国获批上市新药》完整名单)。
卫材/渤健:仑卡奈单抗
1月9日消息,卫材(Eisai)/渤健(Biogen)仑卡奈单抗注射液正式在中国获批上市,用于治疗早期阿尔茨海默病。根据卫材新闻稿介绍,仑卡奈单抗是一款人源化抗可溶性β淀粉样蛋白(Aβ)单抗,它可清除大脑中的Aβ原纤维和Aβ斑块,延缓阿尔茨海默病疾病进展、降低认知和功能衰退速度。
惠升生物:脯氨酸加格列净片
1月19日消息,四环医药旗下惠升生物研发的SGLT-2抑制剂加格列净片在中国获批上市,用于治疗2型糖尿病。该产品是一类非胰岛素依赖性的降血糖药物,通过作用于体内的SGLT-2转运蛋白,防止已滤过的葡萄糖在肾脏内重吸收,从而有效控制血糖水平。
恒瑞医药:富马酸泰吉利定
1月31日消息,NMPA宣布批准恒瑞医药富马酸泰吉利定注射液上市,适用于腹部手术后中重度疼痛。这是一款靶向μ阿片受体(MOR)的小分子药物。MOR激动剂是阿片类药物中镇痛作用较强的一类。据恒瑞医药公开资料介绍,与经典的MOR激动剂相比,泰吉利定可在产生类似的中枢镇痛作用的同时,降低常见的胃肠道不良反应发生率。
罗氏:可伐利单抗注射液
2月7日,NMPA宣布批准罗氏(Roche)可伐利单抗注射液上市,用于未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症成人和青少年(≥12岁)患者。可伐利单抗是一款新型抗C5循环单克隆抗体,患者可每四周一次在家中自行皮下注射。值得一提的是,该品种为全球同步研发,中国首先批准上市。而根据罗氏新闻稿,这也是该公司第一次在中国市场实现一款创新物的全球首发。
科济药业:泽沃基奥仑赛注射液
3月1日消息,科济药业靶向BCMA的CAR-T细胞产品泽沃基奥仑赛注射液在中国获批上市,用于治疗复发或难治性多发性骨髓瘤成人患者。该药获批上市是基于一项在中国进行的单臂1/2期临床试验。研究有效性数据显示,102例患者的中位随访时间为9个月,总缓解率(ORR)为92.2%,非常好的部分缓解(VGPR)及以上缓解的比率为85.3%,完全缓解/严格意义完全缓解率(CR/sCR)的比率为45.1%。
科州制药:妥拉美替尼
3月15日,NMPA宣布通过优先审评审批程序附条件批准科州制药妥拉美替尼胶囊上市,适用于含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。这是一款针对NRAS突变的ATP非竞争性MEK抑制剂。在关键2期注册研究中,有效性分析集中经确认的ORR为34.7%,中位无进展生存期(mPFS)为4.2个月,1年总生存期(OS)率为57.2%,既往接受过免疫治疗的ORR达到39.1%。
诺华:盐酸伊普可泮胶囊
4月26日,诺华(Novartis)宣布盐酸伊普可泮胶囊在中国获批上市,用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。这是一款特异性补体B因子口服抑制剂,为PNH提供了一种新型的口服单药靶向治疗选择。在关键3期研究中,在接受治疗24周后,大多数患者的血红蛋白水平达到12g/dL或以上,几乎所有患者实现避免输血,患者报告的疲劳也有所改善。
正大天晴:安奈克替尼
4月30日消息,正大天晴宣布其自主研发的创新药富马酸安奈克替尼胶囊在中国获批上市,用于ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。安奈克替尼是新型小分子受体酪氨酸激酶抑制剂,对ALK、ROS1和MET基因突变均有较强的抑制作用。在一项2期研究中,111例受试患者基于IRC(独立评审委员会)评估的ORR达到81.08%,缓解持续时间(DOR)中位数达到20.3个月。
亿腾景昂:恩替司他片
4月30日,亿腾景昂宣布恩替司他片在中国获批上市,用于联合芳香化酶抑制剂治疗HR+/HER2-经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。恩替司他是一种新型、口服的HDAC抑制剂,该药凭借半衰期较长的独特特性,实现了一周一次的临床给药方式。
正大天晴:贝莫苏拜单抗
5月9日,正大天晴宣布贝莫苏拜单抗已在中国获批上市,联合安罗替尼胶囊和依托泊苷及卡铂一线治疗广泛期小细胞肺癌(ES-SCLC)。这是一款全新序列的创新抗PD-L1人源化单克隆抗体,在3期ETER7011临床研究中,接受贝莫苏拜单抗联合疗法的患者中位OS达19.3个月,较单纯化疗组延长了7.4个月。
图片来源:123RF
再鼎医药/百时美施贵宝:瑞普替尼胶囊
5月11日,NMPA宣布批准瑞普替尼胶囊上市申请,适用于ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。瑞普替尼是一款ROS1和NTRK靶向抑制剂,再鼎医药拥有该产品在大中华区的独家开发及商业化权。在治疗ROS1阳性非小细胞肺癌成人患者的临床研究中,针对中国亚组ROS1 TKI初治队列患者,经BICR评估的经确认的ORR达到91%。
海思科:苯磺酸克利加巴林胶囊
5月20日,NMPA宣布批准海思科苯磺酸克利加巴林胶囊上市,用于治疗成人糖尿病性周围神经病理性疼痛(DPNP)。克利加巴林为抑制性神经递质GABA的结构衍生物,为一款无需滴定的口服第三代中枢神经系统钙离子通道调节剂,具有镇痛、抗癫痫和抗焦虑的活性。相比于同机制药物,该产品与α2δ亚受体结合力更强,预期止痛疗效更好。
再鼎医药/Entasis公司:SUL-DUR
5月20日,NMPA宣布批准“注射用舒巴坦钠/注射用度洛巴坦钠组合包装”上市申请,用于治疗18岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。这是再鼎医药引进的抗感染新药SUL-DUR,由舒巴坦(一种静脉输注的β-内酰胺类抗生素)和durlobactam(一种新型广谱静脉输注的β-内酰胺酶抑制剂,或称BLI)组合而成。
倍而达药业:甲磺酸瑞齐替尼胶囊
5月20日,NMPA宣布批准倍而达药业的甲磺酸瑞齐替尼胶囊上市,适用于治疗既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌成人患者。瑞齐替尼是EGFR激酶抑制剂,对EGFR突变体(如EGFR T790M、L858R)具有不可逆抑制作用。
康方生物:依沃西单抗
5月24日,NMPA宣布批准康方生物依沃西单抗注射液上市,用于联合培美曲塞和卡铂,治疗经EGFR-TKI治疗后进展的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(nsq-NSCLC)患者。依沃西单抗是一种靶向VEGF-A和PD-1的IgG1亚型人源化双特异性抗体。在3期HARMONi-A研究中,依沃西单抗联合化疗治疗EGFR-TKI进展EGFR突变nsq-NSCLC相较于对照组显著延长患者PFS(7.1个月 vs 4.8个月),降低疾病进展或死亡风险54%;OS获益趋势明显(17.1个月 vs 14.5个月),降低死亡风险20%,且安全性可控。该研究已经于今年6月获《美国医学会杂志》(JAMA)在线发表。
兴盟生物:泽美洛韦玛佐瑞韦单抗注射液
6月12日消息,兴盟生物泽美洛韦玛佐瑞韦单抗注射液已在中国获批上市,这是一款抗狂犬病病毒单克隆抗体组合制剂——单抗鸡尾酒疗法产品,由两株靶向狂犬病毒糖蛋白不同中和位点的人源化单克隆免疫球蛋白IgG1κ抗体混合制成,主要用于成人狂犬病病毒暴露者的被动免疫。
正大天晴:枸橼酸依奉阿克胶囊
6月17日,NMPA宣布批准正大天晴的创新药枸橼酸依奉阿克胶囊上市,用于未经过ALK抑制剂治疗的ALK阳性的局部晚期或转移性非小细胞肺癌患者的治疗。依奉阿克胶囊是正大天晴自主研发的新一代ALK抑制剂。该产品对比第一代ALK抑制剂一线治疗ALK阳性晚期非小细胞肺癌的3期临床研究显示,IRC评估的mPFS分别为24.87个月与11.6个月。针对基线存在可评估脑转移病灶的患者,依奉阿克对比对照药的ORR分别为78.95%和23.81%,DOR分别为25.82个月和7.39个月。
圣和药业:甲磺酸瑞厄替尼片
6月17日,NMPA宣布批准圣和药业甲磺酸瑞厄替尼片上市,用于治疗既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者。根据圣和药业新闻稿,在2期关键性临床研究中,瑞厄替尼片治疗患者经IRC评估的ORR为60.8%,疾病控制率(DCR)为92.5%,中位PFS为12.2个月,中位缓解持续时间(DoR)为13.9个月,表现出良好的治疗效果。
迪哲医药:戈利昔替尼胶囊
6月19日,迪哲医药宣布高选择性JAK1抑制剂戈利昔替尼胶囊在中国获批上市,单药适用于既往至少接受过一线系统性治疗的复发或难治的外周T细胞淋巴瘤(r/r PTCL)成人患者。该产品的关键性注册临床研究已经发表于《柳叶刀·肿瘤学》(Lancet Oncology),戈利昔替尼单药治疗r/r PTCL的ORR达到44.3%,DoR达到20.7个月。
诺和诺德:依柯胰岛素注射液
6月24日,NMPA宣布已批准诺和诺德(Novo Nordisk)的依柯胰岛素注射液上市,用于治疗成人2型糖尿病。这是一种新型的基础胰岛素类似物,该产品经过创新的分子设计和结构修饰,作用时间显著延长,每周一次皮下注射即可满足一整周的基础胰岛素需求。根据诺和诺德新闻稿,依柯胰岛素是该公司首次实现在中国、欧盟和美国同步开展临床试验,同步递交上市申请的产品。

图片来源:123RF
海思科:考格列汀片
6月24日,NMPA宣布批准海思科创新药考格列汀片上市,适用于改善成人2型糖尿病患者的血糖控制。考格列汀是海思科开发的长效DPP-4抑制剂,其半衰期超过100小时,14天DPP-4酶抑制率仍能达到80%,从而可以实现双周一次的长给药间隔。考格列汀单药/联合二甲双胍治疗的多项研究显示,无论是初诊初治患者人群还是二甲双胍控制不佳的患者人群,经过考格列汀治疗24周后,糖化血红蛋白(HbA1c)相较基线可以降低0.9%以上。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容