资本市场进入“牛市”以来,上市药企也正忙着通过授权合作释放“卫星”,以吸引投资者的关注。
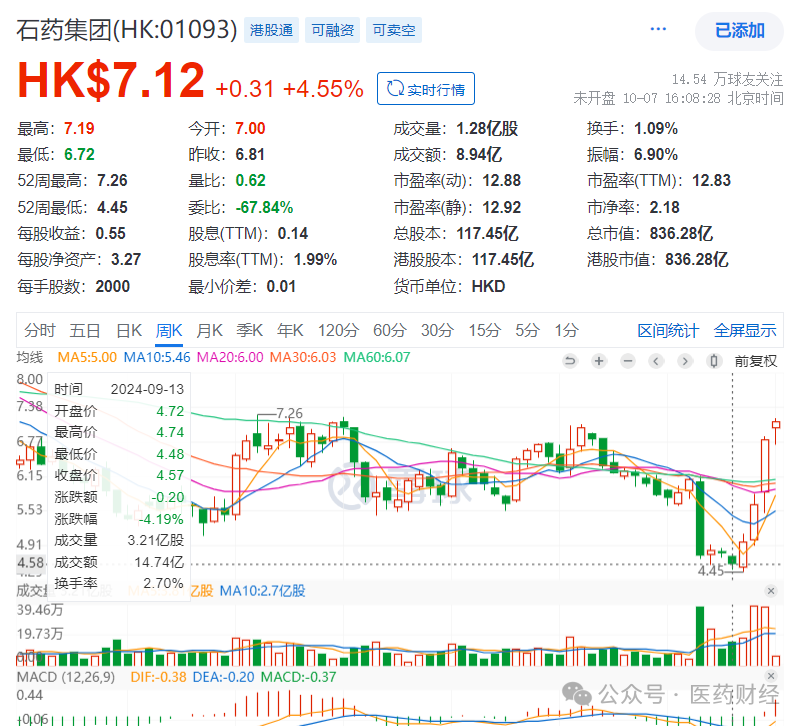
就在昨天(10月7日),港股老牌上市药企石药集团披露:与阿斯利康订立了独家协议,将通过收取1.0亿美元的预付款 ,最高3.7亿美元的潜在开发里程碑付款及最高15.5亿美元的潜在销售里程碑付款,以及适当的销售分成,向在华外资贸易型药企阿斯利康授权一项心血管慢病领域的早期化合物(脂蛋 白抑制剂 YS2302018)的全球化权益。
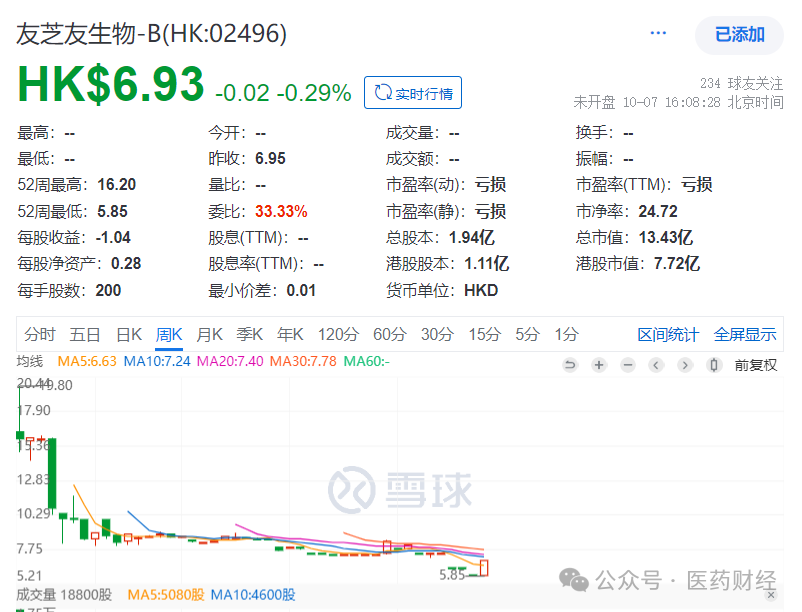
今日早晨(10月8日),另一家港股老牌药企中国生物制药有限公司也披露公告,其公司附属公司正大天晴药业集团股份有限公司(“正大天晴”)与武汉友芝友生物制药股份有限公司(“友芝友生物”)签署独家许可与合作协议。据此,正大天晴获得友芝友生物研发的M701(CD3/EpCAM双抗)在中国大陆地区的开发、注册、生产和商业化的独家、可分许可的许可。正大天晴将根据研发进展情况,就许可产品向友芝友生物支付约3.15亿元人民币的首付款及研发里程碑款项,并支付最高不超过7亿元人民币的销售里程碑款项,同时按年淨销售额的个位数至低双位数百分比向友芝友生物支付分层特权使用费。此前,医药财经也披露过友芝友生物CD3/EpCAM双特异性抗体患者招募信息。从公告披露的药理信息看,M701是友芝友生物自主研发的生物一款CD3/EpCAM双特异性抗体,拟被开发用于肿瘤引起的恶性胸水(MPE)和恶性腹水(MA)的治疗,目前处于临床III期,是国内首个自主开发并进入临床试验阶段的CD3/EpCAM双特异性抗体。M701可以同时靶向肿瘤细胞靶点EpCAM和免疫T细胞活化靶点CD3,通过双靶结合桥连肿瘤细胞和免疫T细胞,从而启动T细胞对肿瘤细胞进行杀伤,因此腹腔/胸腔灌注M701可启动免疫细胞靶向清除和抑制腹腔/胸腔中的肿瘤细胞。从公告披露的疾病机制和流调数据来看,恶性胸水和恶性腹水是肿瘤患者疾病进展到晚期阶段,肿瘤细胞转移至胸膜或腹膜造成血管内液体主动渗出至胸腔或腹腔,但无法从淋巴回流而导致的。恶性胸腹水是中晚期癌症患者的常见并发症。数据显示:中国每年预计有超过60万名新发恶性胸腹水患者,超10%的癌症患者在临床病程中会出现恶性胸腹水。中国生物制药表示,这款CD3/EpCAM双特异性抗体将与现有产品矩阵在肿瘤领域形成强势协同,而肿瘤领域也正是公司创新研发的四大重点治疗领域之一,同时也是集团最重要的收入来源。中国生物制药预计,M701的销售峰值将突破20亿元人民币,有望成为肿瘤领域下一个重磅产品。值得一提的是,友芝友也是港股18A公司,目前市值约25亿港元。
友芝友生物的二股东是石药集团。早在1994年6月,石药集团就已在港交所上市,市值曾超千亿港元,也曾经营(主要组织架构调整和业务不断拆分),市值跌落至400亿港元。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容