
2024-10-11 09:25:28来源:TargetMol小分子化合物专家浏览量:1840
截至2024年9月底,美国食品药品监督管理局(FDA)药物评估与研究中心(CDER)在前三季度批准了34 款新药。其中有 22款为新分子实体,12款为生物制品。
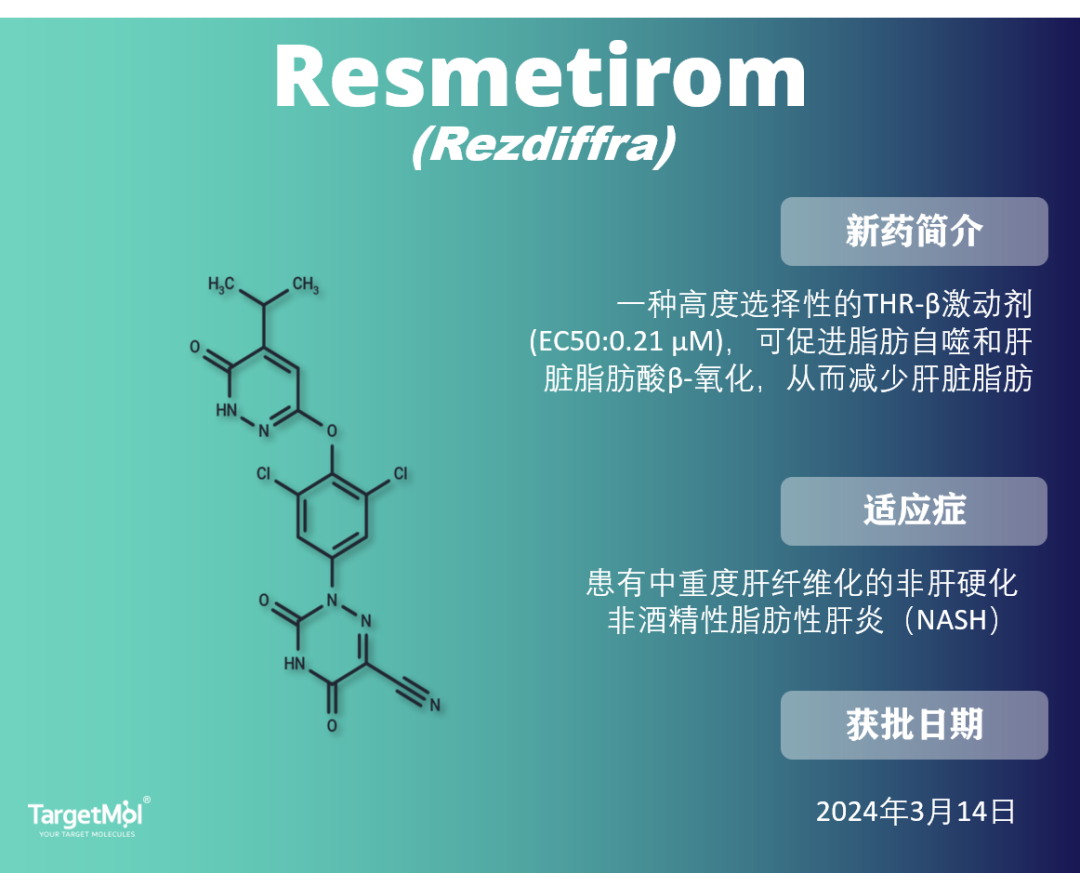
Resmetirom 是一种 甲状腺激素受体-beta(THR-β)激动剂,促进脂肪自噬和肝脏脂肪酸β-氧化,从而减少肝脏脂肪。与主要在心脏和骨骼中表达的甲状腺激素受体-alpha(THR-α)相比,它对 THR-β 的选择性约为 FT3 的28倍。
2024年3月14日,它获得 FDA 批准,成为治疗非肝硬化性非酒精性脂肪肝炎(NASH)导致的肝纤维化的首个疗法,这是一种非酒精性脂肪肝病(NAFLD)的形式。
Xanomeline & trospium chloride:首款精神分裂药物
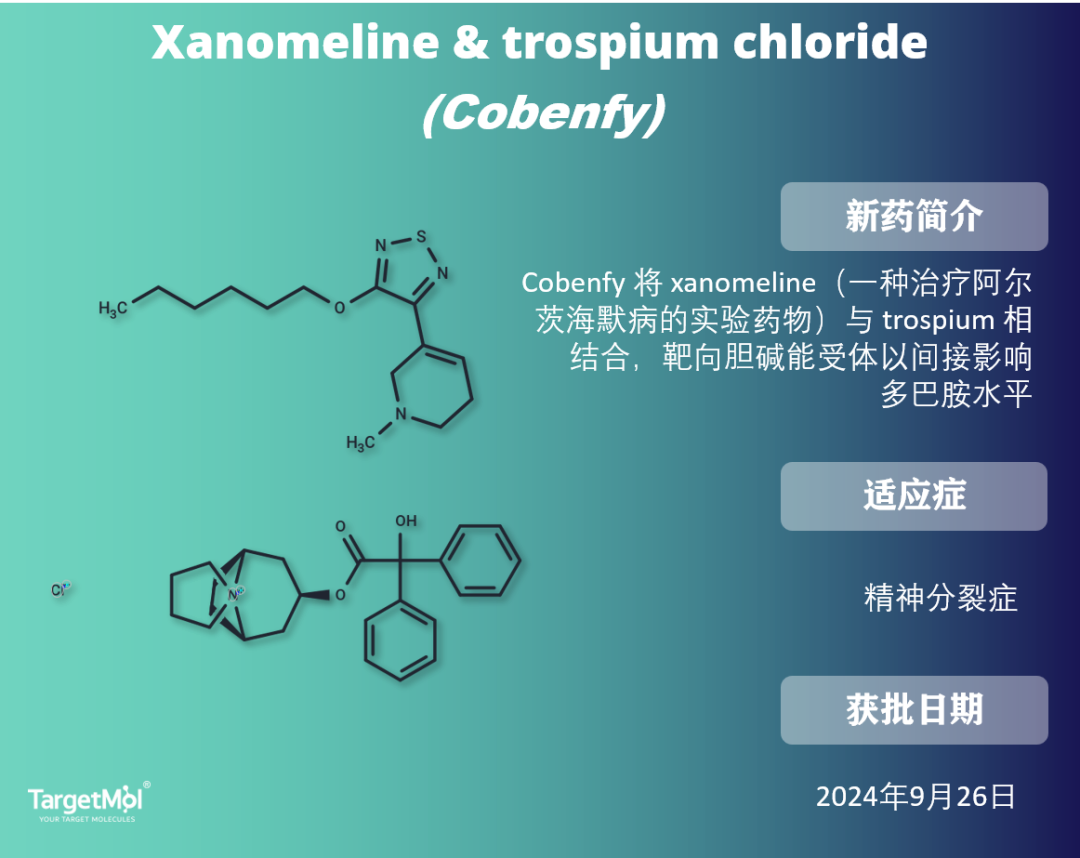
目前的抗精神病药物主要靠阻断多巴胺受体,以帮助控制幻觉、妄想和其他精神分裂症症状。但这些药物会引起严重的运动和代谢副作用,从而导致心脏病和糖尿病。
2024年9约26日,FDA批准了 Cobenfy(xanomeline 和 trospium chloride)胶囊口服用于治疗成人精神分裂症。它是 首款被批准用于治疗精神分裂症的抗精神病药物,靶向胆碱能受体,而不是多巴胺受体。
Ensifentrine:首款PDE3/4双靶点抑制剂
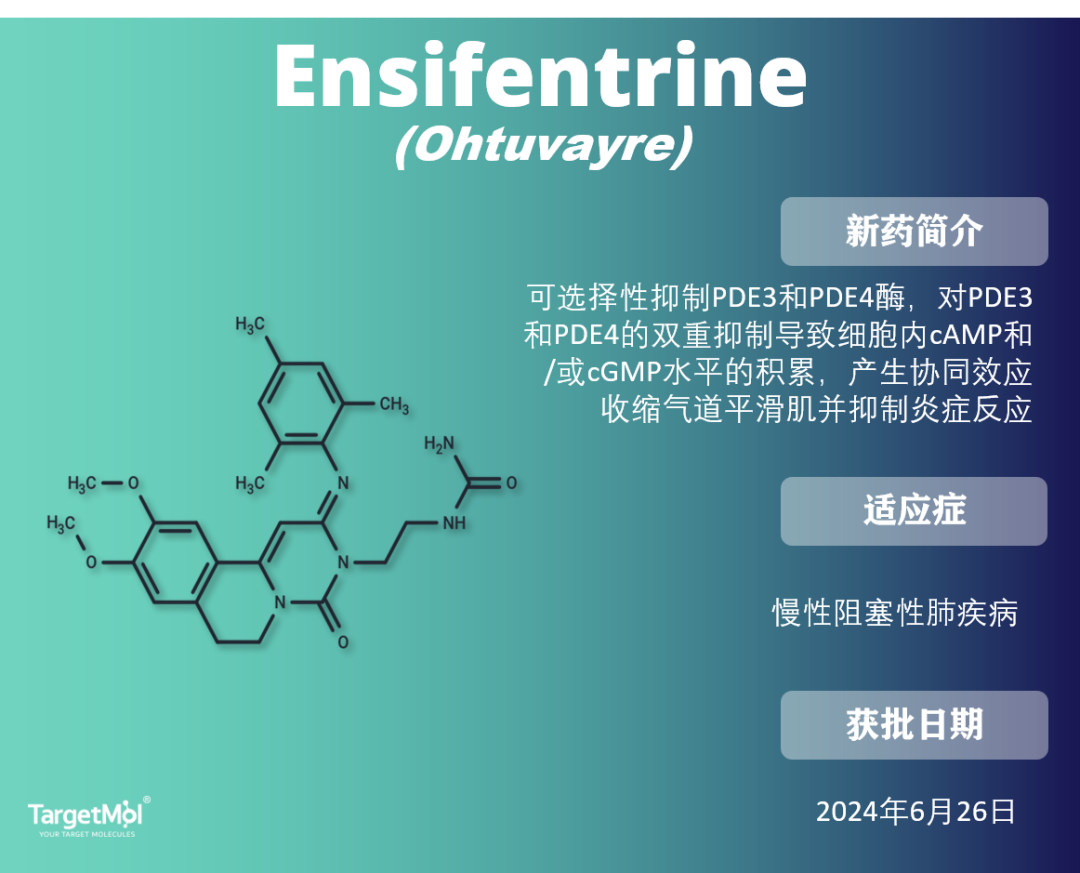
慢性阻塞性肺病(COPD)以气流逐渐受限和呼吸道慢性炎症为特征。由于磷酸二酯酶3(PDE3)和磷酸二酯酶4(PDE4)在气道平滑肌、炎症细胞和支气管上皮细胞中表达,并驱动炎症和支气管肌肉张力,因此这两种PDE亚型被确定为COPD治疗中的治疗靶点。Ensifentrine是首个具有新颖作用机制的吸入性产品,能够提供支气管扩张和抗炎双重作用,显著改善患者的呼吸功能和生活质量。
Givinostat:首款适用所有DMD患者的非类固醇疗法
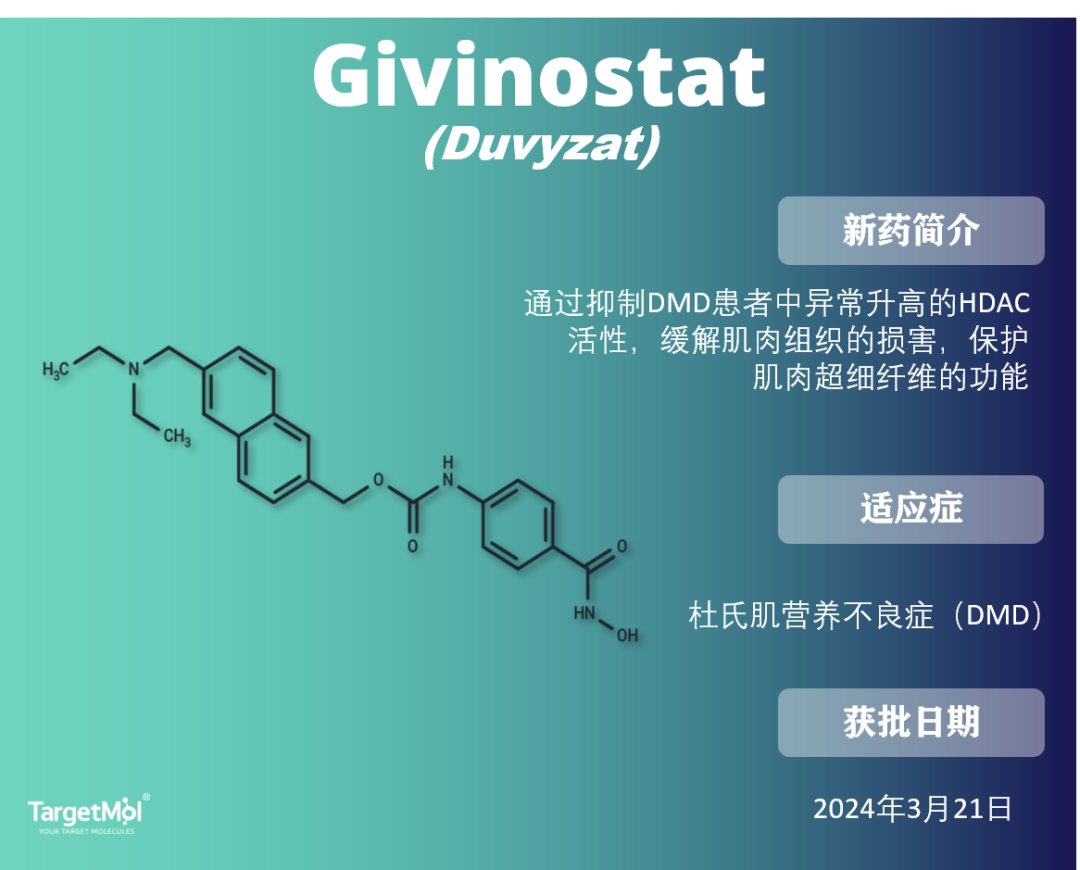
Givinostat 于2024年3月获得FDA批准,用于治疗6岁及以上的杜氏肌营养不良症(DMD)患者。这是 首个获批用于治疗所有DMD遗传变异患者的非类固醇药物。
Axatilimab-csfr:首款靶向CSF-1R的单抗

靶向 CSF-1R 抑制信号传导可以减少疾病介导巨噬细胞及其单核细胞前体的数量,这在慢性 GVHD 和特发性肺纤维化(IPF)等疾病的纤维化疾病过程中起关键作用。Axatilimab 于2024年8月获得FDA批准,用于 cGVHD 的第三线治疗。
Tarlatamab-dlle:首款双特异性 T 细胞接合剂

Tarlatamab 是一种首创的T细胞接合剂抗体,用于治疗小细胞肺癌(SCLC)。它是一种双特异性单克隆抗体,靶向表达在T细胞表面的CD3以及delta-like配体3(DLL3),后者是一种抑制性配体,抑制 Notch 信号传导,并在不同 SCLC 疾病阶段和治疗状态中高度表达。其双特异性导致T细胞的激活、炎性细胞因子的释放以及对表达DLL3细胞的裂解。
Tarlatamab-dlle于2024年5月获得FDA批准,适用于已接受过铂类化疗但未获成功的患者,成为 首个获得市场批准的DLL3靶向双特异性T细胞结合剂。
Arimoclomol:首款尼曼-匹克病C型(NPC)药物
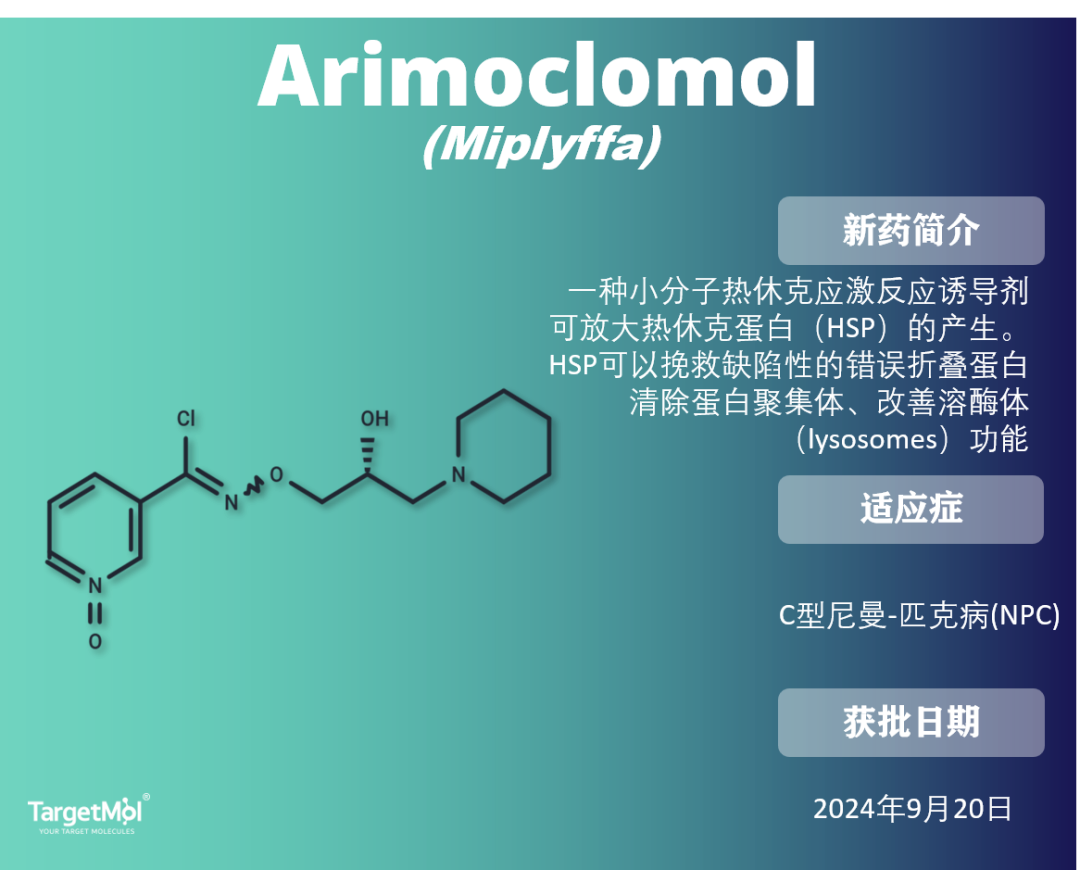
尼曼-匹克病C型(NPC)是一种遗传性溶酶体贮积病,与NPC1或NPC2蛋白的突变相关,会导致严重的全身和中枢神经系统症状,如认知障碍、小脑共济失调、构音障碍、猝倒和癫痫。
Arimoclomol是一种羟胺衍生物,属于热休克蛋白-70(HSP70)共同诱导剂,于2024年9月20日获得FDA批准成为首个用于治疗尼曼-匹克病C型(NPC)的药物。它还在肌萎缩侧索硬化症(ALS)和包涵体肌炎中进行研究。
Berdazimer:首款治疗软疣感染药物
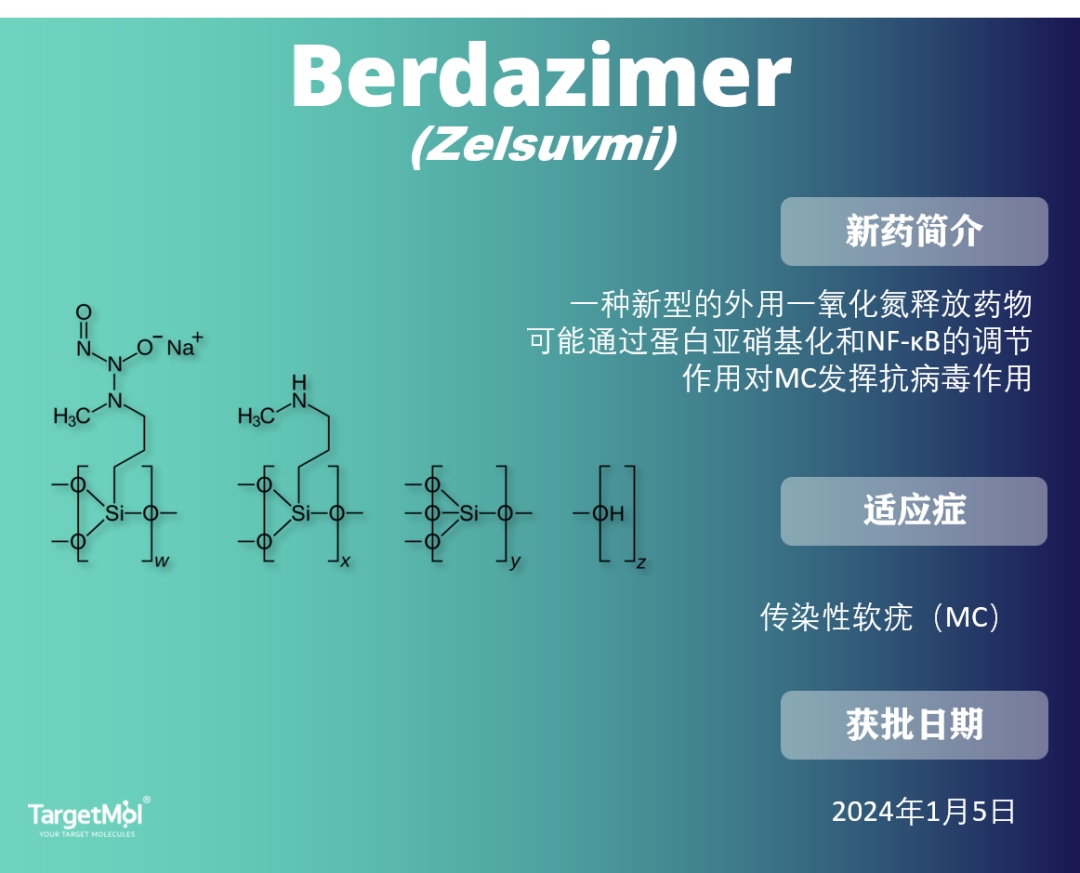
软疣是一种主要影响儿童和免疫系统受损患者的病毒性感染,是全球常见的五种皮肤病之一。此前 ,软疣的一线治疗方式是外科切除 。Berdazimer 凝胶是一种新型化学实体(NCE),它通过与质子供体(如水)的接触释放NO,从而降解N-二氮铵二酸盐结构,临床耐受性良好,不良事件发生率较低。在 2024年1月5日,它获得了 FDA 的批准。
附:2024年前三季度FDA批准的新药
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容