
2024-11-26 17:07:01来源:肽研社浏览量:1365
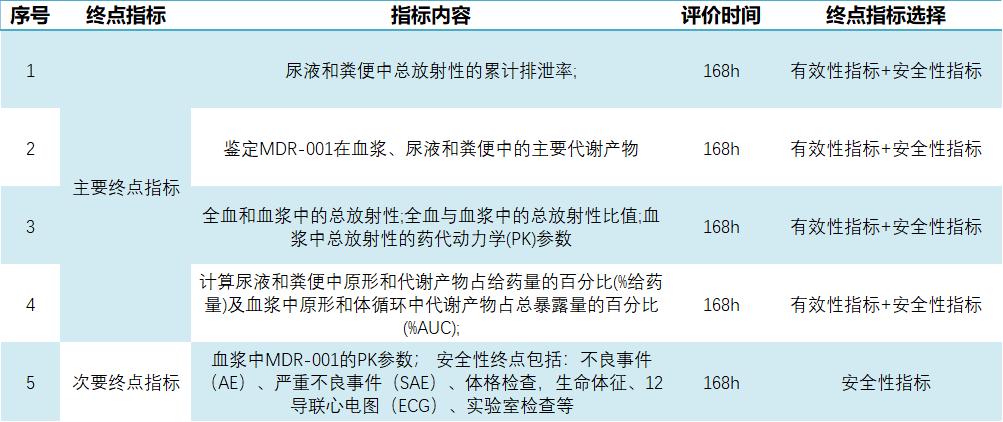
据药物临床试验登记与信息公示平台显示,2024-11-26,杭州德睿智药正式开展一项关于MDR-001片的I期临床试验(CTR20244449),旨在评估MDR-001单次口服给药在健康成年男性受试者中的物质平衡。该研究伦理审查早于今年11月13日获苏州大学附属第一医院同意。 图1. 临床试验截图 关于试验 此次德睿智药获批的临床试验预计入组人数10人,在空腹状态下接受120 mg(约150 μCi)MDR-001口服制剂,确保10 min内服下全部药物,持续用药7天。 本次临床试验主要终点为测量在168h后尿液和粪便中总放射性的累计排泄率、MDR-001在血浆、尿液和粪便中的主要代谢产物、全血和血浆中的总放射性以及 血浆中总放射性的药代动力学(PK)参数等。 次要终点为测量血浆中MDR-001的PK参数;安全性终点包括:不良事件(AE)、严重不良事件(SAE)、体格检查,生命体征、12导联心电图(ECG)、实验室检查等。 表1.试验主要及次要终点指标 关于MDR-001 MDR-001是德睿智药自主研发的β-arrestin 2高选择性GLP-1小分子激动剂,其保留了β-arrestin招募带来的胰岛细胞修复和保护功能,又避免β-arrestin 1招募带来的副作用,如胰岛素分泌受限及介导的内吞脱敏。 据MDR-001的临床前研究显示,其表现出优异的体内外药效和成药性优势(包括PK和安全窗大幅提高)。目前MDR-001已高效推进至IIb期临床研究,多款肿瘤 及代谢类药物正在进行IND-Enabling研究。 | 引用资料 [1] 中国药物临床试验与信息公示平台官网. Fromhttp://www.chinadrugtrials.org.cn/index.html. - END -
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容