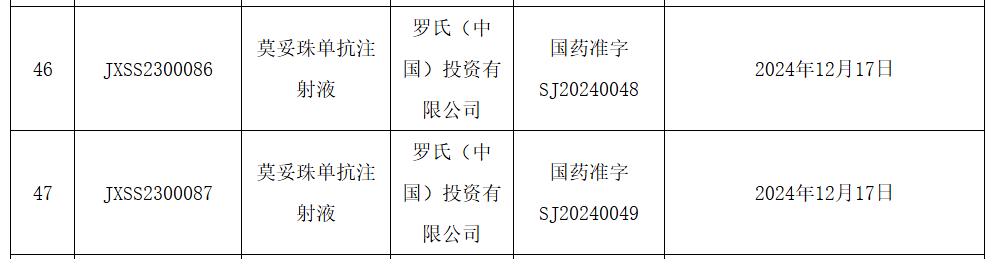
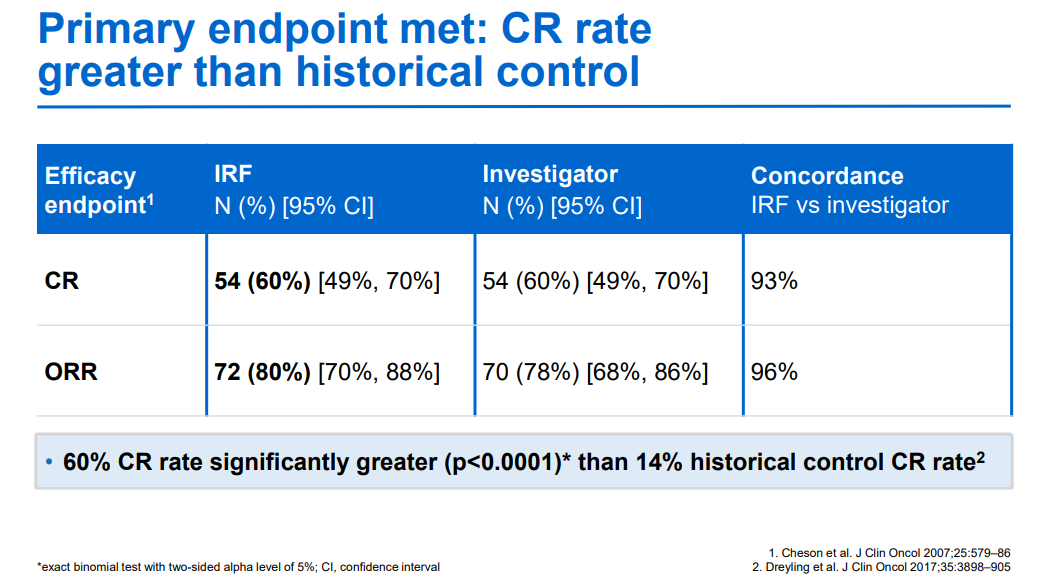
12月23日,NMPA官网显示,罗氏CD20/CD3双抗莫妥珠单抗(Mosunetuzumab)的上市申请已获批准,用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。Mosunetuzumab是一款CD20/CD3 T细胞衔接双特异性抗体,旨在靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向激活并重定向患者现有的T细胞,通过将细胞毒性蛋白释放到B细胞中消除恶性B细胞。此前基于一项代号为GO29781的多中心、开放标签I/II期研究积极结果,欧盟委员会和美国FDA已批准该药物上市,用于治疗既往接受过至少两种系统性治疗的复发或难治性FL患者。该项研究中,mosunetuzumab显示出较高完全缓解(CR)率和长久的临床疗效。中位随访18.3个月后,患者的客观缓解率为80%(n=72/90),CR率为60%(n=54/90),中位缓解持续时间为22.8个月。研究中出现的最常见的不良事件为细胞因子释放综合征(44.4%),一般为低级别(1级:25.6%;2级:16.7%),并且在治疗结束后消退。
Mosunetuzumab是罗氏在中国进行开发的第2款CD3/CD20双抗。2023年11月,罗氏的CD3/CD20双抗格菲妥单抗注射液(商品名:高罗华/Columvi)获NMPA附条件批准上市,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)成人患者。这也是国内获批的首款CD3/CD20双抗。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容