
2025-03-20 14:46:58来源:药方舟浏览量:1039
2025年3月19日,智飞生物发布关于15价肺炎球菌结合疫苗获得Ⅲ期临床试验总结报告的提示性公告,该疫苗具有良好的免疫原性及安全性,全面达到临床试验预设目标,在免疫原性方面非劣效于对照疫苗。

肺炎是一种肺部炎症性疾病,通常由细菌、病毒、真菌或其他微生物感染而引起,细菌性肺炎占人体感染的肺炎的80%,其中肺炎链球菌是重要的病原体。早在2008年,WHO就已将肺炎球菌疾病列为需“极高度优先”使用疫苗预防的疾病。
在我国,肺炎球菌疫苗尚未被纳入我国国家免疫规划,属于自费接种疫苗。从市场规模看,据观研天下数据显示,到2026年,中国肺炎球菌疫苗市场规模将突破200亿元,年复合增长率达到18.24%。
目前,国内上市的肺炎疫苗包括13价肺炎结合疫苗和23价肺炎多糖疫苗。据西南证券报告显示,2024年国内肺炎疫苗批签发110批次(-27%)。其中,13价肺炎结合疫苗批签发71批次(-23%);23价肺炎多糖疫苗批签发39批次(-34%),智飞生物的23价肺炎疫苗批签发4批次。

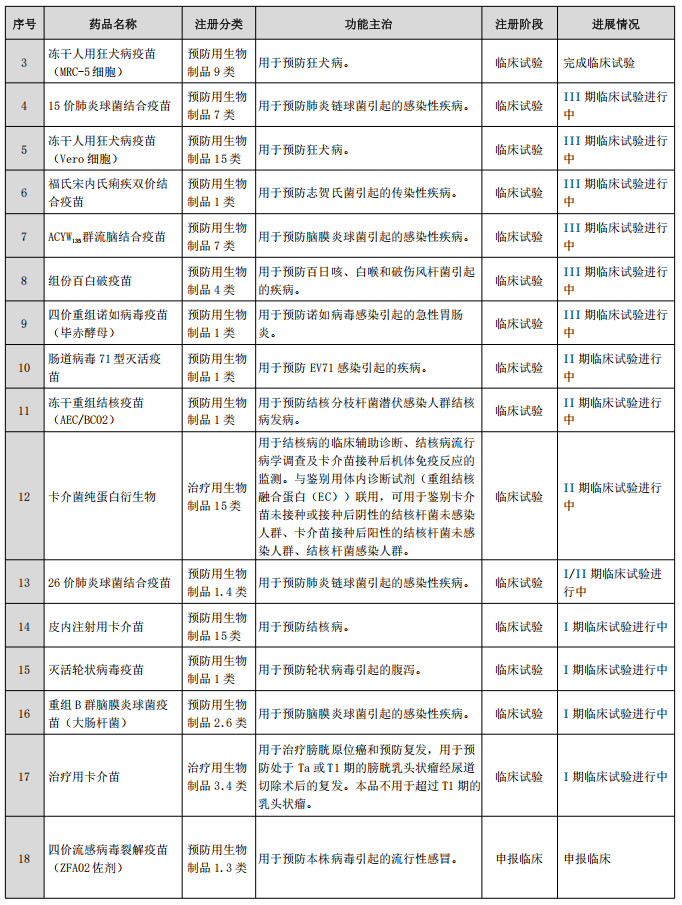
目前,智飞生物共有13种产品上市在售,1种产品附条件上市,包括预防流脑、宫颈癌、肺炎、轮状病毒、带状疱疹等传染病的疫苗产品,也涵盖提供结核感染诊断、预防、治疗有效解决方案的药品,覆盖人群包括婴幼儿、青少年、成人;自主研发项目共计32项(不含新冠系列项目),其中处于临床试验及申请注册阶段的项目18项。
在肺炎球菌疫苗产品方面,除了15价肺炎球菌结合疫苗外,智飞绿竹研发的23价肺炎球菌多糖疫苗已于2023年8月29日获批上市,26价肺炎球菌结合疫苗则处于I/II期临床试验。值得注意的是,公司的26价肺炎球菌结合疫苗是目前国内已获批临床试验的最高价次的同类产品。
而15价肺炎球菌结合疫苗获得Ⅲ期临床试验总结报告后可向国家药品监督管理局递交药品生产注册申请,此后还需经过技术审评、临床试验现场核查、生产现场检查等程序,待获得药品注册批件、且产品获得批签发后方可上市销售。

若未来公司的15价肺炎球菌结合疫苗成功获批上市销售,将与另外两款疫苗形成协同效应,进一步丰富公司肺炎疫苗矩阵产品结构,强化公司的市场地位,增强行业竞争力。

声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容