
2025-08-07 10:52:13来源:鼎泰集团TriApex浏览量:1274
随着肿瘤免疫治疗领域两大引领性产品 —— 纳武利尤单抗(Opdivo®)和帕博利珠单抗(Keytruda®)以及自身免疫性疾病领域重磅产品度普利尤单抗(Dupixent®)专利陆续到期,全球生物类似药研发进入了新的浪潮。与此同时,经过 10 多年的经验积累,医药行业与监管理念的协同进步也推动了生物类似药研发策略的不断演化和完善……
全文共:8396 字 52 图
预计阅读时长:25 分钟
★ 文章导览 ★
01 | 前言 |
02 | 生物类似药研究的基本路径和申报资料 |
03 | 中外生物类似药法规和技术指导原则层面的比较 |
04 | 从 FDA 完全回复函(CRL)看生物类似药质量比对研究的重要性 |
05 | 已上市生物类似药非临床研究的演化 5.1 曲妥珠单抗生物类似药 5.2 雷珠单抗生物类似药 5.3 依库珠单抗生物类似药 5.4 乌司奴单抗生物类似药 |
06 | 结语 |
前言
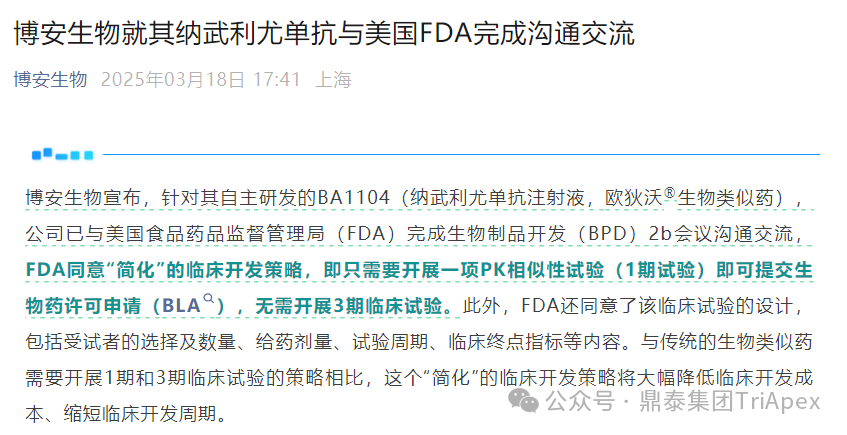
2025 年 3 月,博安生物宣布针对其自主研发的 BA1104(纳武利尤单抗注射液,欧狄沃®生物类似药),公司已与 FDA 完成生物制品开发(BPD)2b 会议沟通交流,FDA 同意“简化”的临床开发策略,即只需要开展一项 PK 相似性试验(Ⅰ 期试验)即可提交 BLA,无需开展 Ⅲ 期临床试验。此外,FDA 还同意了该临床试验的设计,包括受试者的选择及数量、给药剂量、试验周期、临床终点指标等内容。与传统的生物类似药需要开展 Ⅰ 期和 Ⅲ 期临床试验的策略相比,这个“简化”的临床开发策略将大幅降低临床开发成本、缩短临床开发周期。
2025 年 5 月,百奥泰也发布公告,称计划调整 BAT3306(帕博利珠单抗)的开发策略,计划终止正在开展的一项评价 BAT3306 联合化疗与可瑞达®联合化疗在 IV 期非小细胞肺癌受试者中的 Ⅲ 期临床有效性比对研究(BAT3306-002 研究)。指出根据美国 FDA 近期对生物类似药产品的技术指导内容,以及 EMA 于 2025 年 4 月发布的关于生物类似药审评的思考性文件,均体现出欧美药监官方在审批生物类似药产品的上市申请时,疗效比对研究的必要性已经大大下降。

我们不禁要问,关于生物类似药的研发,国外的监管思路发生了什么变化,导致出现这么大力度的调整?
早在 2023 年 10 月,EMA 的一篇文章《Do the Outcomes of Clinical Efficacy Trials Matter in Regulatory Decision-Making for Biosimilars? 》评估了临床疗效比对试验(CES)在生物类似药(如单抗和融合蛋白)监管决策中的必要性:通过分析 2012-2022 年 EMA 审查的 36 个生物类似药的案例(包括获批和撤回的利妥昔单抗、曲妥珠单抗等),比较了 CMC 与临床数据(PK、CES 等)对审批结果的影响。结果表明:质量数据是审批的核心依据(67% 案例中质量与临床结论一致;11% 因质量问题被拒,与临床数据无关),CES 结果对决策影响有限(差异多归因于试验设计问题),且先进分析方法能替代 CES 检测关键差异。认为生物类似药可通过质量比对 + 药代动力学(PK)比对研究证明相似性,无需强制 CES,建议修订指南以降低开发成本,加速患者可及性。

点击查看大图
2025 年 4 月,EMA 发布了 《Reflection paper on a tailored clinical approach in biosimilar development》 草案。文件指出,在生物类似药结构高度相似且质量分析充分的情况下,仅通过全面的质量比对+ PK 比对研究即可证明相似性,无需 CES 试验,但需确保生产一致性和免疫原性风险可控。这份文件标志着欧盟在推动简化生物类似药开发的进程中迈出了新的一步。

点击查看大图
本文通过对国内外指南进行逐一比较,以及按照上市的时间顺序分别对曲妥珠单抗、雷珠单抗、依库珠单抗和乌司奴单抗等案例进行分析,梳理非临床研究思路的演化,为抢占生物类似药赛道提供关键决策参考。
生物类似药研究的基本路径和申报资料
1
生物类似药研究基本路径
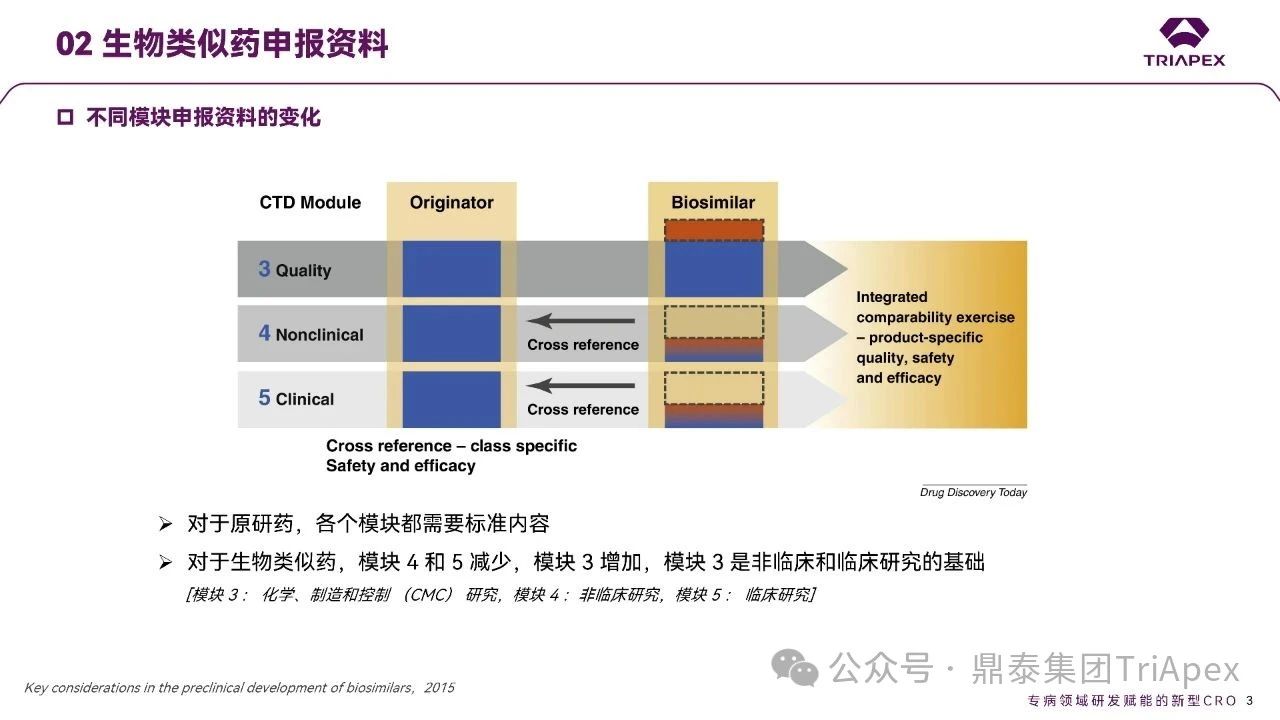
创新药的开发路径主要聚焦于临床有效性和安全性的评估,并涵盖三个核心板块 —— CMC、非临床和临床研究。在不同的开发阶段,各个板块的研究内容和比重有所差异:前期主要以非临床安全性研究为主,进入后期临床阶段,则重点围绕临床有效性和安全性的深入评估展开,尤其是支持药品上市的关键性临床试验。当然,CMC研究的深入程度也会根据产品所处的开发阶段和工艺成熟度进行必要的调整。
相比之下,生物类似药的开发途径则是基于和参照药之间的相似性证据,其整体研究内容呈“金字塔型”。其中,药学比对研究构成了该金字塔的基座,通过全面的质量比对研究来确立候选药物与参照药的质量一致性;在此基础上,非临床研究的内容可有所精简,同时临床药理学研究仍占据关键地位,必要时需开展临床比对试验以进一步确认相似性。这种递进式研发模式既体现了监管对于生物类似药评价体系的科学要求,也彰显了其在保证质量和疗效的同时降低成本、提高可及性的现实考量。

点击查看大图
2
支持生物类似药 IND 和 BLA 的申报资料
创新药的申报资料通常按照 ICH M4 进行准备,各个模块均需提供标准的内容。
对于生物类似药,除需对自身产品进行全面表征外,还需提供与参照药的系统性比对研究数据,并把这些资料纳入申报资料中。基于药学比对研究所建立的充分相似性,非临床和临床研究部分可酌情简化。例如,临床试验可能仅需开展 Ⅰ 期药代动力学(PK)比对试验和 Ⅲ 期药效比对研究,部分符合要求的药物甚至可豁免 Ⅲ 期药效比对研究。
点击查看大图
中外生物类似药法规
和技术指导原则层面的比较
1
法规层面
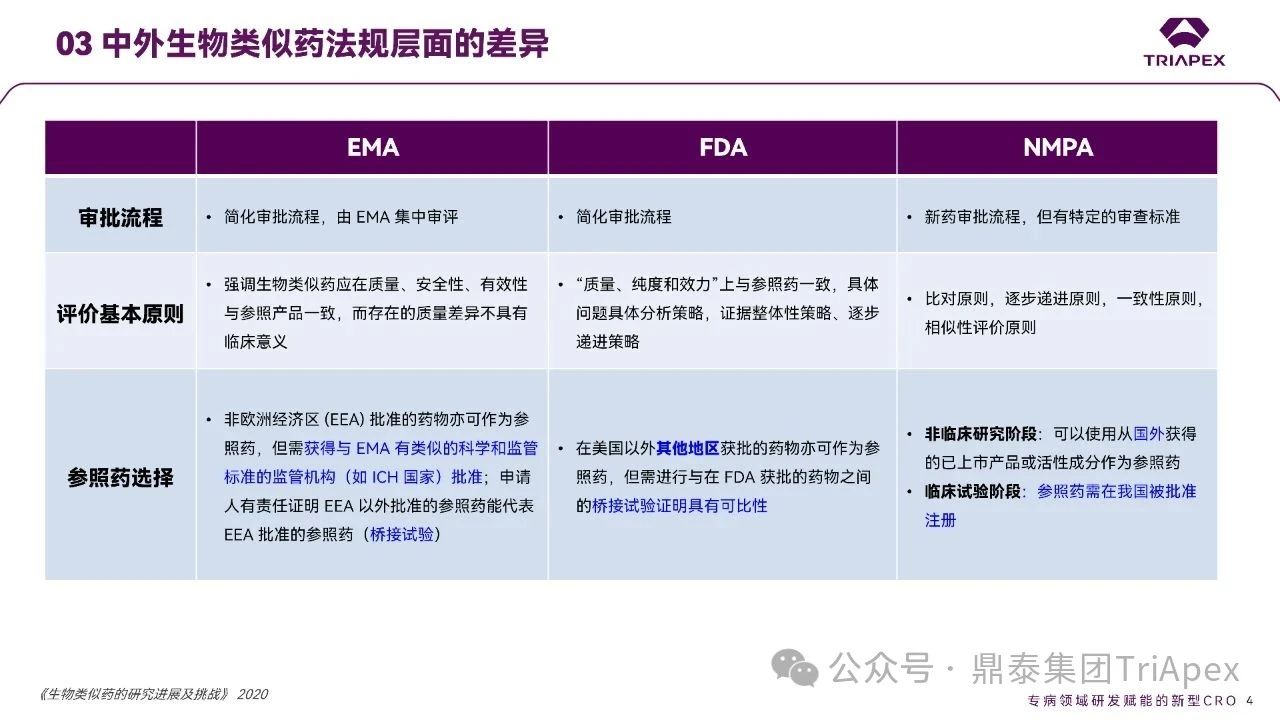
☆ 审批流程
EMA:简化审批流程,由 EMA 集中审评;
FDA:简化审批流程;
NMPA:新药审批流程,但有特定的审查标准。
☆ 评价的基本原则
EMA:强调生物类似药应在质量、安全性、有效性方面与参照药一致,存在的质量差异不具有临床意义;
FDA:“质量、纯度和效力”上与参照药一致,具体问题具体分析策略,证据整体性策略、逐步递进策略;
NMPA:比对原则,逐步递进原则,一致性原则,相似性评价原则。
☆ 参照药的选择
EMA:非欧洲经济区(EEA)批准的药物可作为参照药,但需获得与 EMA 有类似的科学和监管标准的监管机构(如 ICH 国家)批准;且申请人有责任证明 EEA 以外批准的参照药能代表 EEA 批准的参照药,即需进行某些桥接试验;
FDA:同样允许美国以外其他地区获批的药物作为参照药,但需进行与在 FDA获批的药物之间的桥接试验证明具有可比性;
NMPA:在非临床研究阶段可以使用从国外获得的已上市产品或活性成分作为参照药;但临床试验阶段参照药需在我国被批准注册。
点击查看大图
2
指导原则层面
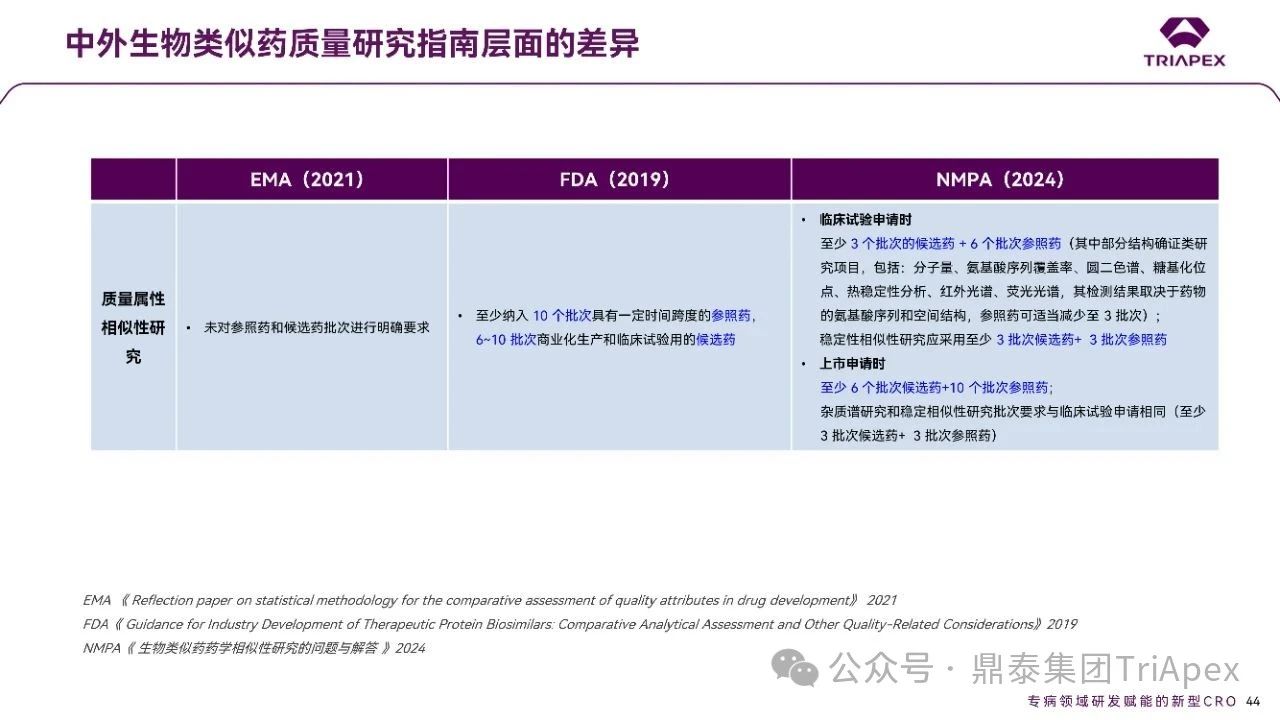
☆ 对参照药和候选药的批次要求
EMA:未对参照药和候选药批次进行明确要求,但强调了样品选择的随机性、能代表批次间的差异,且应考虑药物的产地、生产规模、原液批次、批次存放时间等;
FDA:至少纳入 10 个批次具有一定时间跨度的参照药,6~10 批次商业化生产和临床试验用的候选药;
NMPA:临床试验申请时,建议采用至少 3 批次的候选药进行质量属性相似性研究,参照药应至少包含 6 批次样品;稳定性相似性研究应采用至少 3 批次代表性批次候选药与 3 批参照药。上市申请时,建议采用至少 6 批次候选药和至少10批次参照药进行质量属性相似性研究;杂质谱研究和稳定相似性研究批次要求与临床试验申请相同。
点击查看大图
☆ 质量相似性评价方法
FDA 建议依据质量属性对临床的影响将其进行分层(Tier),对不同层级设立不同的相似性标准:
某些高度关键的属性:进行等效性检验
其他高到低风险属性:质量范围(mean±X SD)
关键程度非常低或不适用于其他评价方法的其他属性:原始数据/图示比较

点击查看大图
以美国 Amgen 公司在美国和欧洲获批的生物类似药 ABP501 为例,采用 FDA 推荐的 3-Tier 法进行了全面的药学相似性评价研究。




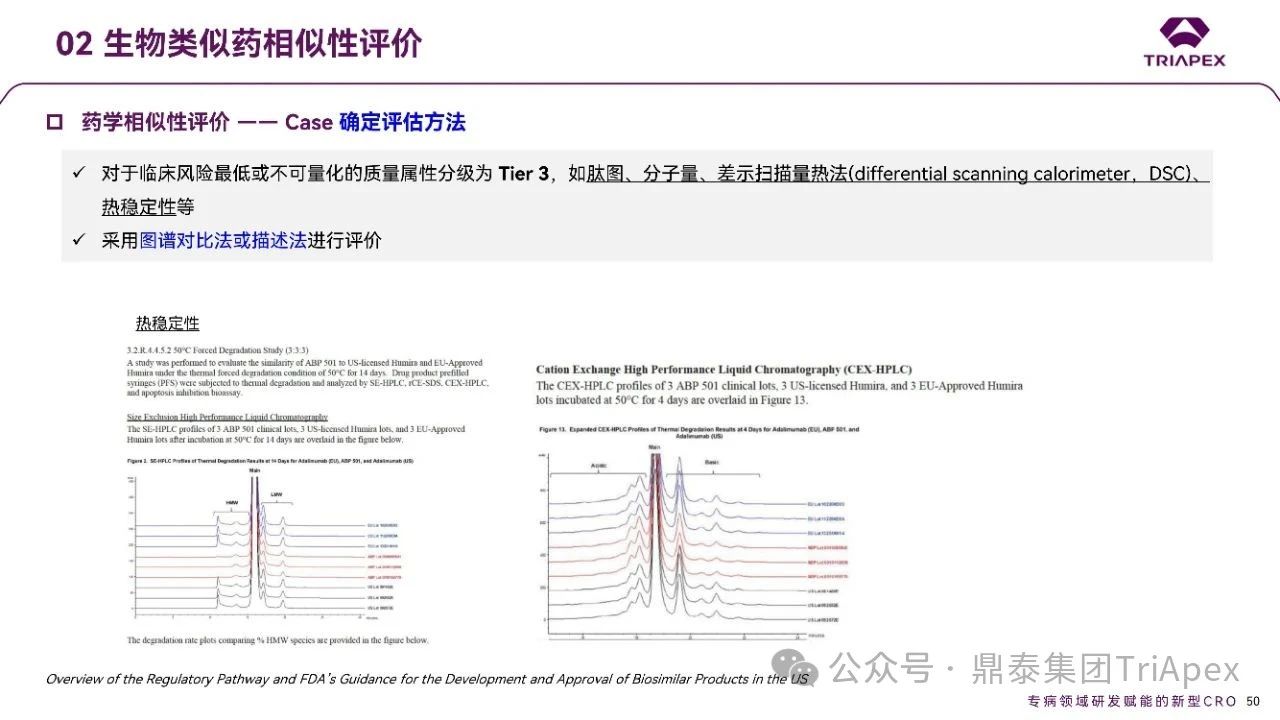

点击查看大图
目前国内外关于生物类似药非临床研究参考的通用指南主要为:
EMA《Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues》 2015
FDA《Scientific Considerations in Demonstrating Biosimilarity to a Reference Product》2015
NMPA《生物类似药研发与评价技术指导原则(试行)》2015
这几个指南均于 2015 年发布,但历史沿革、后续发展和演化不尽相同。
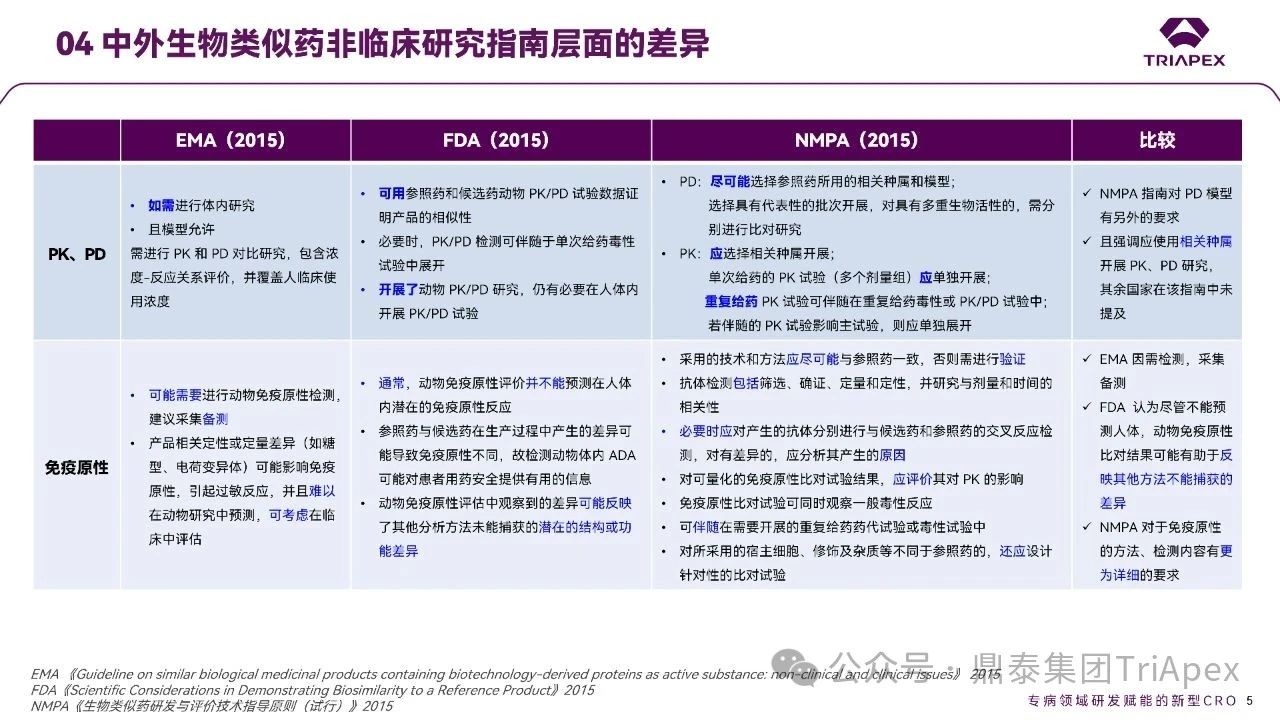
☆ 对于 PK、PD 试验的要求
EMA:在必要时且模型允许的情况下,可开展 PK/PD 试验以支持相似性评价;
FDA:可用参照药和候选药的动物 PK/PD 试验数据证明产品的相似性;
NMPA:建议尽可能开展相关研究,其中 PD 试验应尽可能选择参照药所用的相关种属和模型,PK 试验应选择相关种属开展,且单次给药的 PK 试验需单独开展,重复给药 PK 试验可伴随。
☆ 对于免疫原性的要求
EMA:建议在必要时进行免疫原性研究,并推荐预先采集样本以备后续分析;
FDA:认为动物免疫原性数据不能直接预测人体反应,但若观察到显著差异,可能提示候选药与参照药之间存在未被其他分析方法识别的结构或功能差异;
NMPA:通常将其视为需要开展的内容,并提供了更具体的建议,例如采用的技术和方法应尽可能与参照药一致,抗体检测包括筛选、确证、定量和定性等。
点击查看大图
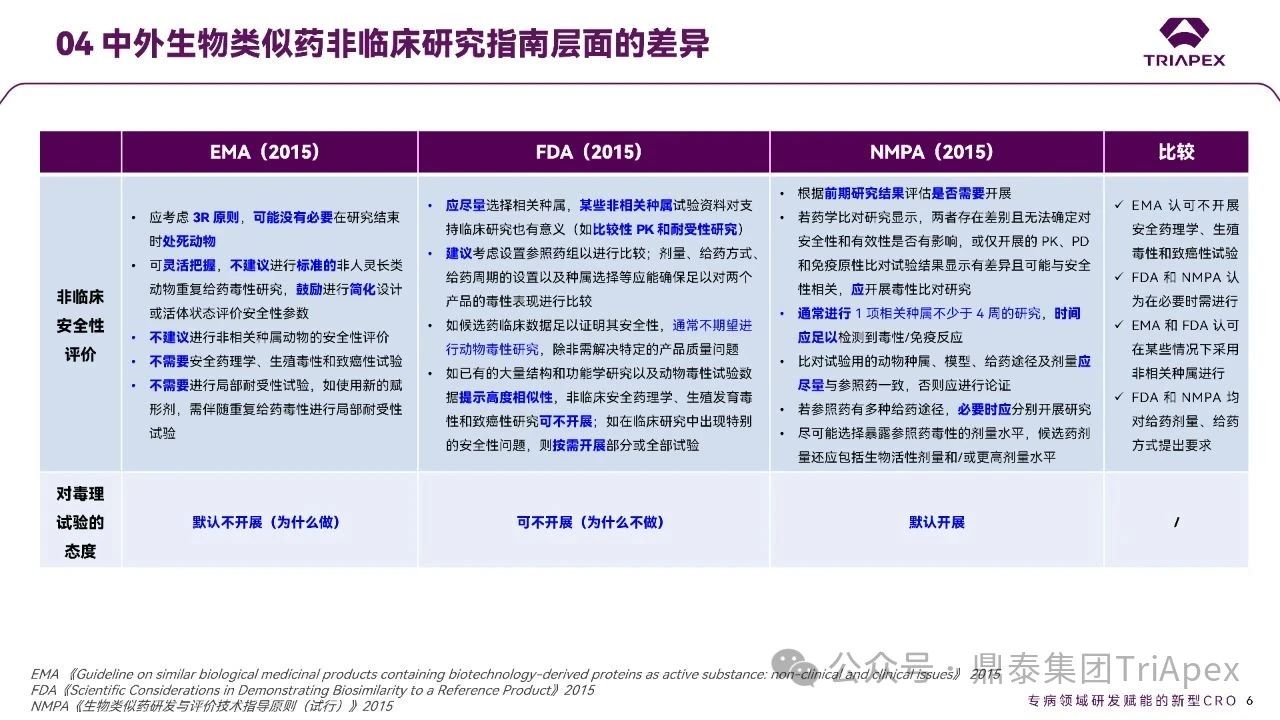
☆ 对于毒理试验的要求
EMA:遵循 3R 原则,明确不建议开展安全药理学、生殖毒性和致癌性试验;
FDA:建议采用相关种属进行试验,并鼓励与参照药进行比对研究;
NMPA:要求基于前期研究数据评估试验必要性,但评估主体、标准及结论的合理性较为复杂。建议进行 1 项相关种属不少于 4 周的研究;此外,对于试验用的动物种属、模型、给药途径及剂量应尽量与参照药一致,且剂量有着相应的要求。
总体而言,EMA 倾向于默认不开展,需额外试验时需提供理由;FDA 持灵活态度,但需论证不开展的理由;NMPA 倾向于开展并强调试验设计的可比性。
点击查看大图
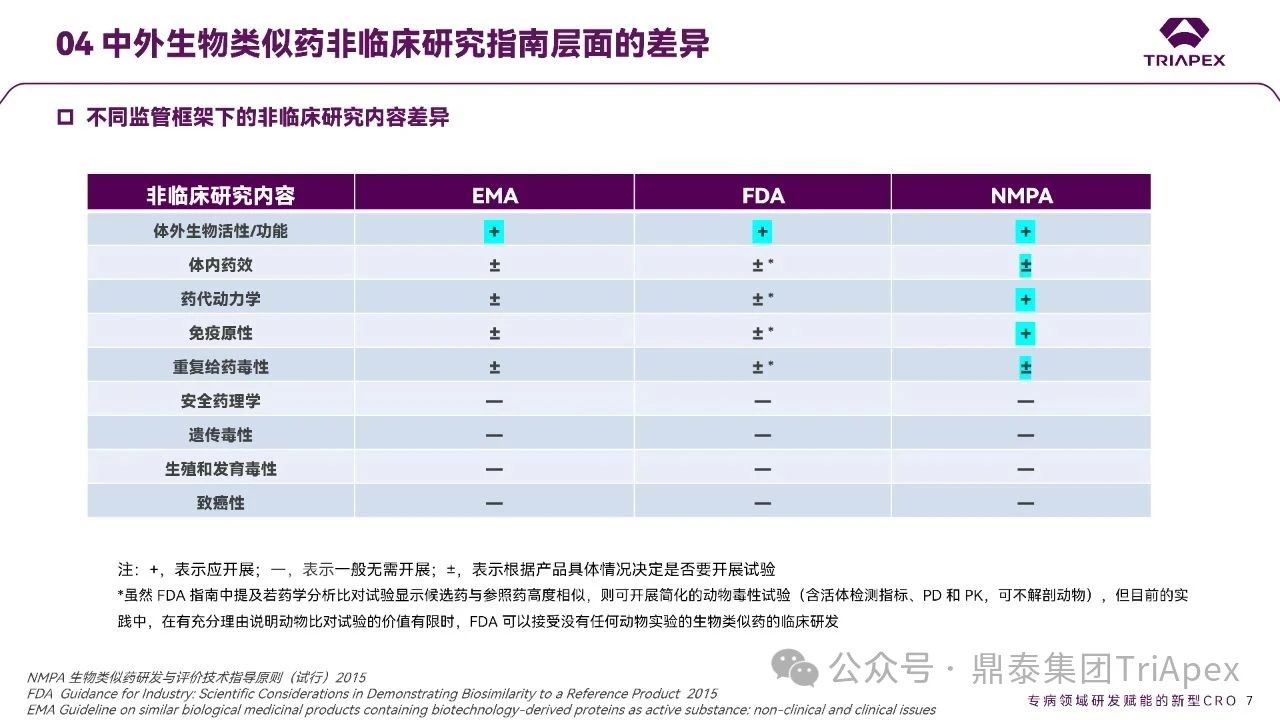
根据各监管机构指导原则,其对生物类似药关键研究要求的比对总结如下:
EMA 认为体外生物活性/功能是必需的,其他试验可不开展,若开展需给出理由;
FDA 同样关注体外生物活性/功能,其他试验认为可不进行,若不进行,需提供充分理由;
NMPA 则保持相对全面的证据要求,通常会开展体外生物活性/功能、体内药效、药代、免疫原性和重复给药毒性试验。对于生物类似药,安全药理、遗传毒性、生殖毒和致癌,通常可以不开展。此外,国内申报的注射剂,局部刺激性试验一般需关注。
点击查看大图
从 FDA 完全回复函(CRL)看
生物类似药质量比对研究的重要性
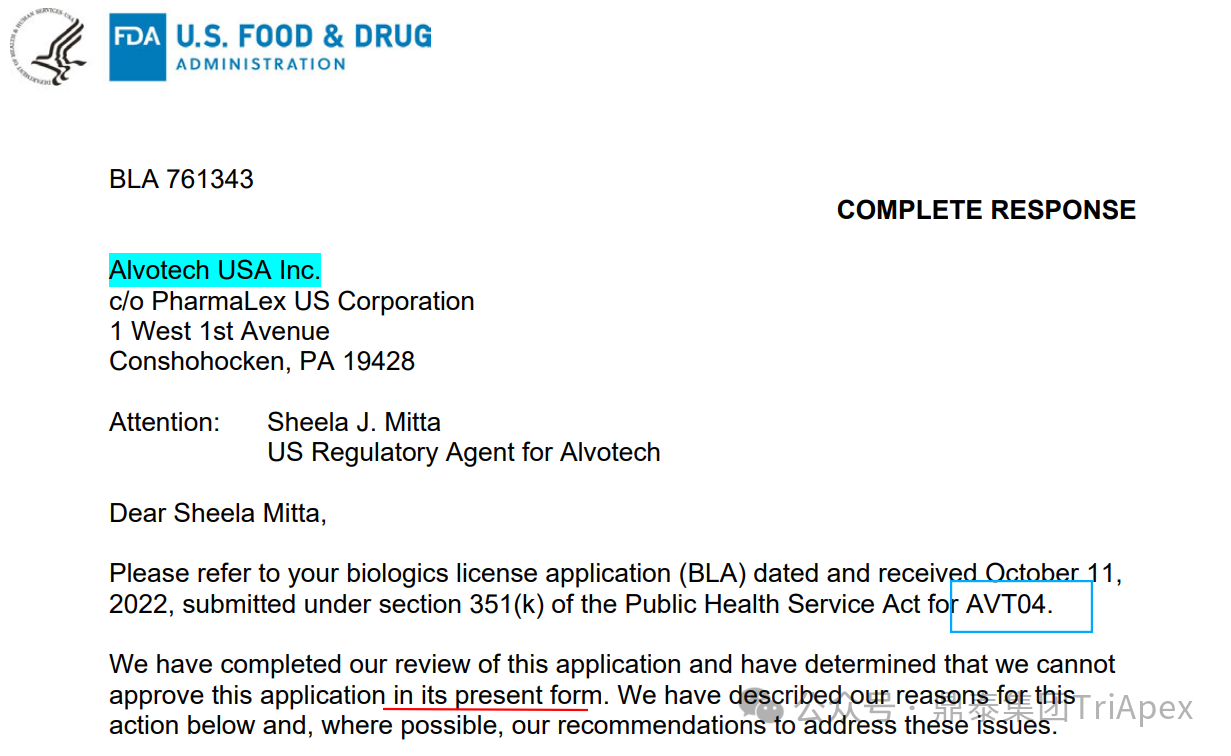

FDA 于 2025 年 7 月 10 日一次性公布了 202 封 CRL,涉及 2020 年到 2025 年间最终获批的 202 个药物。在这 202 个曾经未获批的药物中,相当一部分是生物类似药,该类药物未被批准的原因主要为竞品市场独占期未过期、现场核查问题等,部分产品则是由于关键质量属性无法建立相似性的原因未被批准。这里以 Alvotech 提交 BLA 的生物类似药 AVT04 为例,介绍在生物类似药审评过程中 FDA 最为关心的核心问题。
在于申请人提交的关于 FcγRIIIa 受体(158F 和 158V 变体)结合活性的比较分析数据存在严重缺陷。
首先
即使是参照药(US-Stelara 和 EU-Stelara),其使用 SPR 方法测得的结合活性数据也表现出极大的变异性。表现为:US-Stelara 的 158F 结合活性范围在 172%~260%,158V 在 153%~259%;EU-Stelara 的 158F 结合活性范围在 171%~282%,158V 在 182%~277%。这种普遍超过 100 个百分点的巨大波动范围表明所使用的 SPR 方法本身可能存在严重的不稳定性或系统性/操作性问题,从根本上动摇了基于此方法进行任何产品间比较的可靠性。
其次
在观察到参照药数据本身波动巨大的同时,FDA 进一步指出 AVT04 与参照药(无论是 US- 还是 EU-)在 FcγRIIIa 158F 和 158V 结合活性上的差异被报告为“非常大”。FDA 认为,考虑到分析方法存在的高变异性,观测到的这种“大差异”很可能部分甚至完全是方法缺陷造成的假象,而非产品间真实的差异。即使存在真实差异,在当前方法高变异性的背景下,也无法准确量化其大小和生物学意义。
★ 深入调查并合理解释为何其 SPR 方法在检测 FcγRIIIa 结合活性时会出现如此显著的批内/批间变异(包括参照药),可能的调查方向包括方法学本身(如配体固定化、缓冲液条件、数据分析模型)、试剂(如受体蛋白质量与稳定性)、仪器/操作(如性能漂移、人员差异)以及样品问题(如参照药批次间变异)。
★ 申请人必须提供充分的数据和/或信息,证明其用于评估 FcγRIIIa 结合活性的方法(无论是改进后的还是论证现有方法在特定条件下适用)是“适合其检测目的”的。这需要提供确凿证据证明方法的关键性能,特别是其精密度(可接受的重复性和中间精密度,这是 FDA 最核心关切点),以及准确性/可靠性、专属性、线性/范围、稳健性等。
★ 同时,申请人需要科学论证其报告结果形式(如相对结合百分比)的合理性,并提交完整且符合法规要求的方法验证报告,以证明该方法能够可靠、可重现地检测候选药与参照药在 FcγRIIIa 结合活性上的相似性或差异。
已上市生物类似药非临床研究的演化
基于前述监管指南的差异性分析,对代表性已上市生物类似药案例进行了对比分析,以实证方式探究不同年代获批的生物类似药非临床研发策略与审评标准的演化情况。
1
曲妥珠单抗生物类似药
曲妥珠单抗(Trastuzumab)作为首个获批用于实体瘤治疗的人源化单克隆抗体,在生物类似药开发领域具有重要意义。截至 2025 年 5 月,FDA 已累计批准 6 个曲妥珠单抗的生物类似药上市。为深入解析此类产品的审评标准演变过程,选取两个具有代表性的获批案例进行对比分析:2019 年 6 月获批的 Kanjinti®和 2024 年 4 月获批的 Hercessi®。这两个跨越 5 年的典型案例,或许可展现生物类似药评价体系的优化轨迹和监管决策的考量维度。

点击查看大图
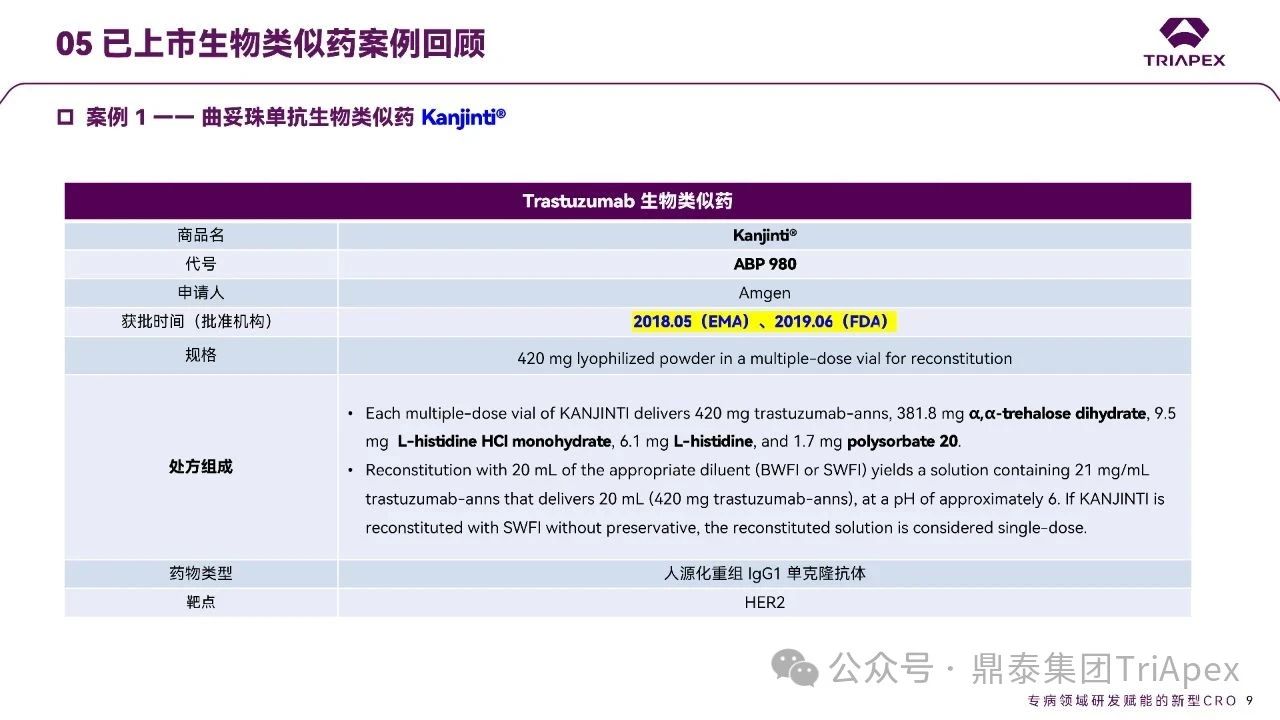
Ø Kanjinti®
Kanjinti®(ABP 980)由安进(Amgen)公司开发,于 2018 年 5 月率先获得 EMA 批准,随后于 2019 年 6 月获得 FDA 批准上市。该产品是曲妥珠单抗的首批生物类似药之一,其获批历程标志着生物类似药在抗肿瘤领域的重要进展。
点击查看大图
★ Kanjinti® CMC 研究基础
质量比对分析证实 ABP 980 与美国批准的参照药(US- Herceptin)高度相似,尽管在临床非活性成分上存在微小差异;
建立了 EU- Herceptin 和 US-Herceptin 之间的桥接证据。
★ Kanjinti® 非临床研究内容
药理学
采用 EU- Herceptin 作为对照,在模型小鼠中开展体内药效学比对研究。
毒理学
采用大鼠和食蟹猴开展试验;
候选药设置单一剂量组,参照药采用 EU- Herceptin;
PK 试验评估整合在毒性试验中同步进行;
额外开展组织交叉反应试验,该试验类型通常被认为非必需。


点击查看大图
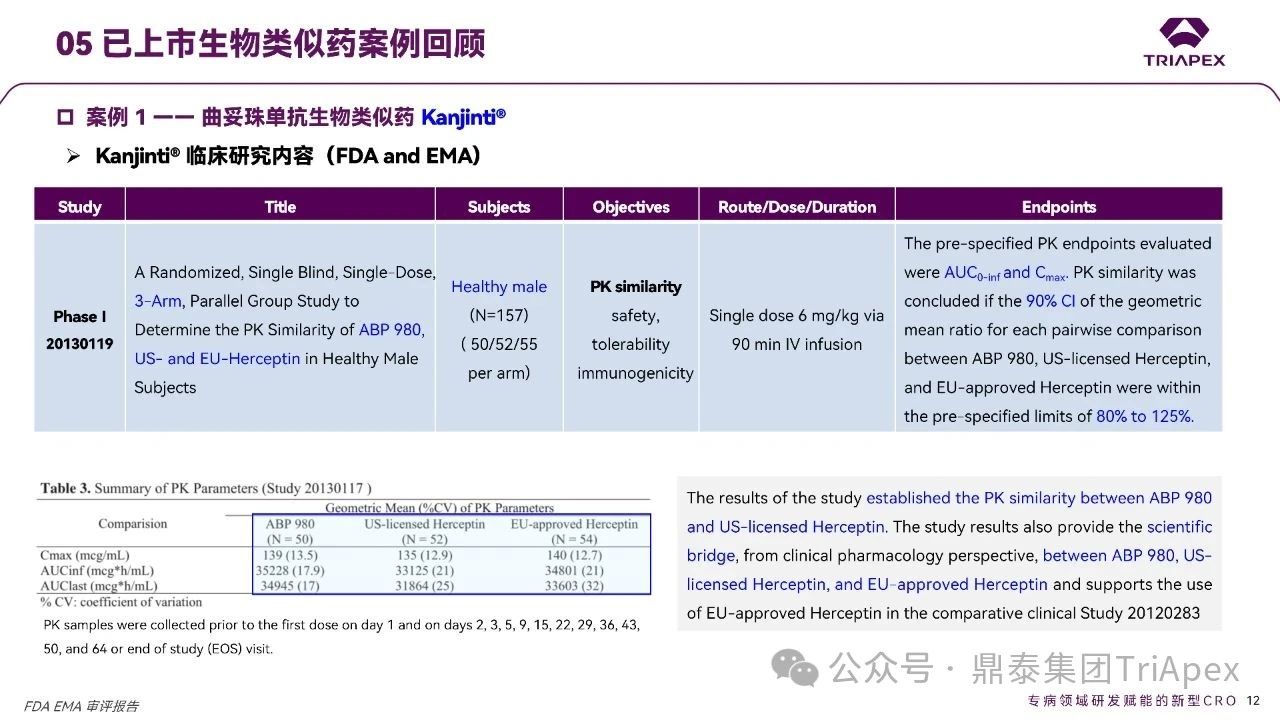
★ Kanjinti® 临床研究内容
临床 Ⅰ 期
研究设计:三臂、平行对照试验;
受试人群:健康受试者;
试验组设置:ABP 980(候选药)+欧盟获批参照药(EU-Herceptin)+ 美国获批参照药(US-Herceptin);
主要评估 PK 相似性,同时建立跨地区参照药的桥接数据。
临床 Ⅲ 期
受试人群:HER2 阳性乳腺癌患者;
对照选择:欧盟获批参照药(单一对照);
核心评估指标:有效性终点(主要疗效指标)+安全性特征(包括免疫原性);
基于 Ⅰ 期建立的 PK 相似性,Ⅲ 期采用单一地区来源参照药具有合理性。

点击查看大图
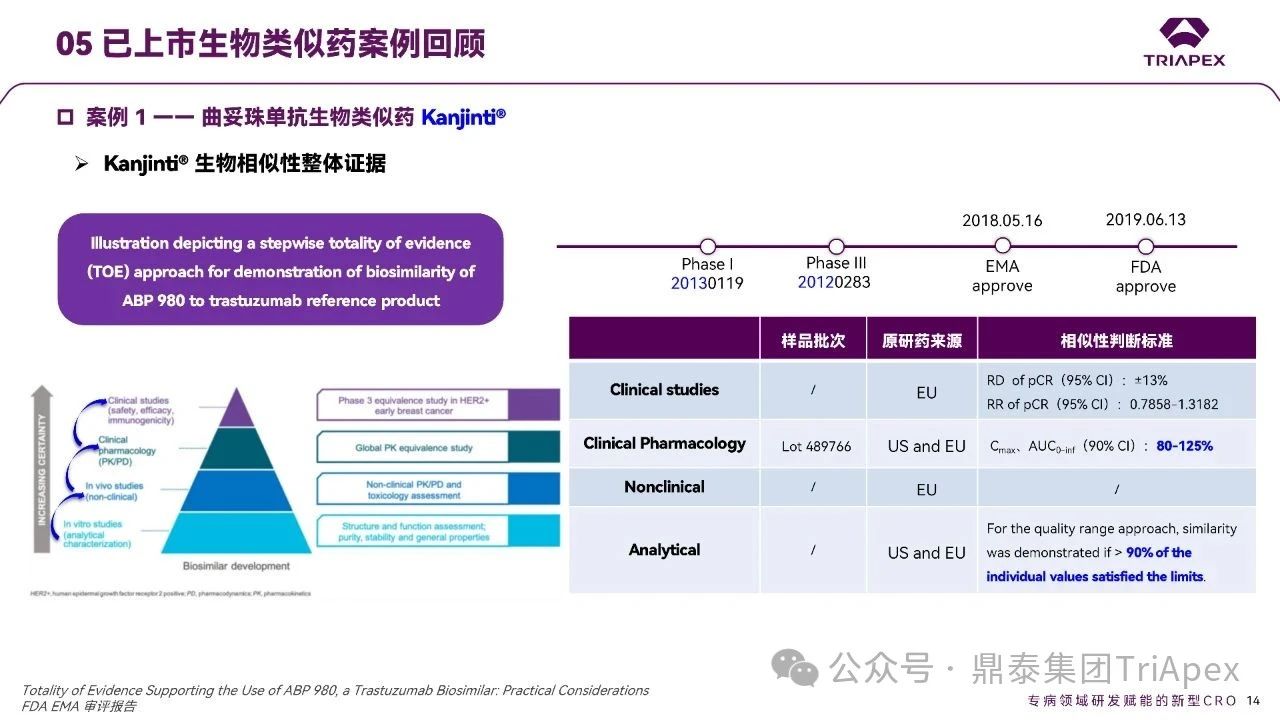
Kanjinti® 生物相似性整体证据——经典的生物类似药研发途径
基于总体 TOE,包括分析(结构和功能)、非临床 PK/PD、临床 PK 和安全性以及有效性研究显示,ABP 980 与曲妥珠单抗高度相似。
点击查看大图
Ø Hercessi®/Zercepac®
Hercessi®(FDA)/Zercepac®(EMA)是由复宏汉霖与 Accord 合作开发的曲妥珠单抗生物类似药(代号:HLX02)。该产品展现了典型的国际化开发路径,2020 年率先获得 EMA 与 NMPA 批准;2024 年完成美国市场准入,获 FDA 批准。

点击查看大图
根据 EMA 审评报告,HLX02(Zercepac®)的非临床研究如下:
药理学研究
完成全面的体外功能活性分析(HER2 binding、Anti-proliferation、ADCC、ADCP、Apoptosis、CDC、C1q binging、FcRn binging、RcγRⅠa binging、RcγRⅡa binging、RcγRⅡb/c binging、RcγRⅢa (F) binging、RcγRⅢa (Ⅴ) binging、RcγRⅢb binging);
安全药理学研究
在小鼠上开展了单独的神经系统安全药理学试验:候选药 3 个剂量组;
在食蟹猴毒理试验中伴随开展心血管和呼吸系统安全药理试验;
药代动力学研究
在食蟹猴中开展,设计了 3 个剂量候选药组和 1 个中国批准的参照药组;
针对工艺变更开展了 1 项附加试验。
毒理学研究
在食蟹猴中开展 1 项预试验和 1 项正式试验;
正式试验采用 3 个剂量候选药组和 1 个中国批准的参照药;
额外开展了组织交叉试验。

点击查看大图
根据 EMA 审评报告中的技术评估意见,监管机构对各项非临床研究提出了以下科学观点,包括对体内试验必要性、试验设计缺陷、所能提供的科学性依据等。


点击查看大图
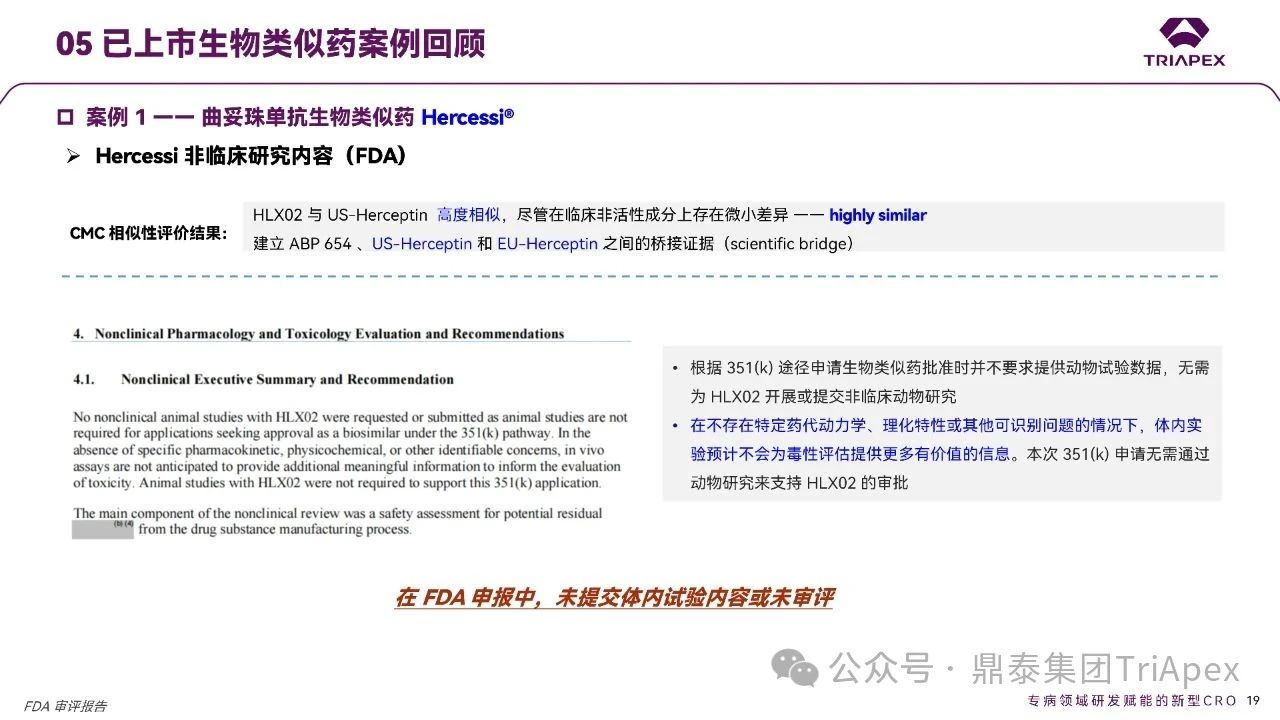
根据 FDA 审评报告,HLX02(Hercessi®)的非临床研究如下:
药学相似性评估:建立与参照药的相似性证据;
非临床研究豁免:FDA 认为在不存在特定药代动力学、理化特性或其他可识别问题的情况下,体内试验预计不会为毒性评估提供更多有价值的信息。本次申请无需通过动物研究来支持审批。
在 FDA 申报时,申请人未提交体内试验内容或 FDA 未进行审评。FDA 的这一审评立场体现了其先进的监管科学理念、对成熟靶点生物类似药的典型审评模式,即在充分的质量相似性证据基础上,合理减少非必要的动物实验。
点击查看大图
2
雷珠单抗生物类似药
全球生物类似药研发格局中,雷珠单抗产品的审批进展具有重要标志性意义:FDA 已先后批准 Byooviz®(三星)和 Cimerli®(Coherus)两款生物类似药上市,中国也在 2024 年迎来了首个国产雷珠单抗生物类似药——齐鲁制药的安卓明®(Rimmyrah®)获批。这一系列产品的审评历程为深入分析国内外生物制药企业在研发策略以及监管沟通等方面的差异化路径提供了极具价值的比较案例,下文将就此展开详细探讨。
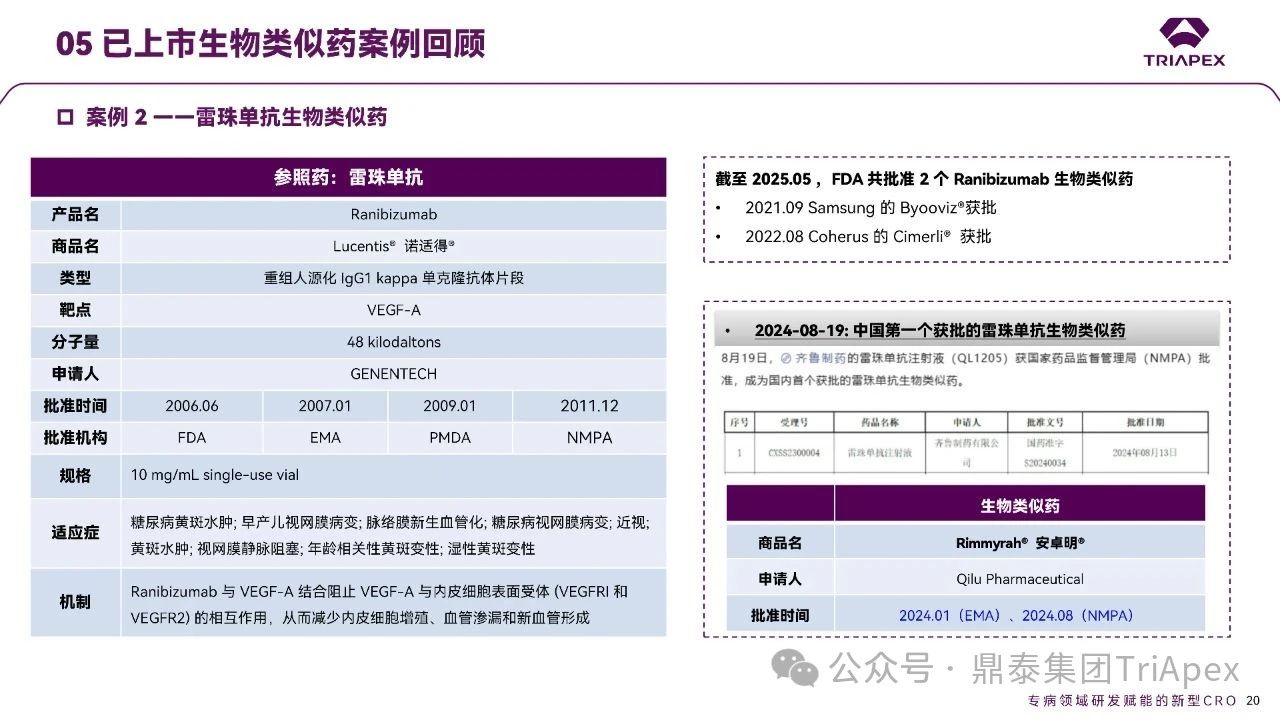
点击查看大图
Ø Rimmyrah®
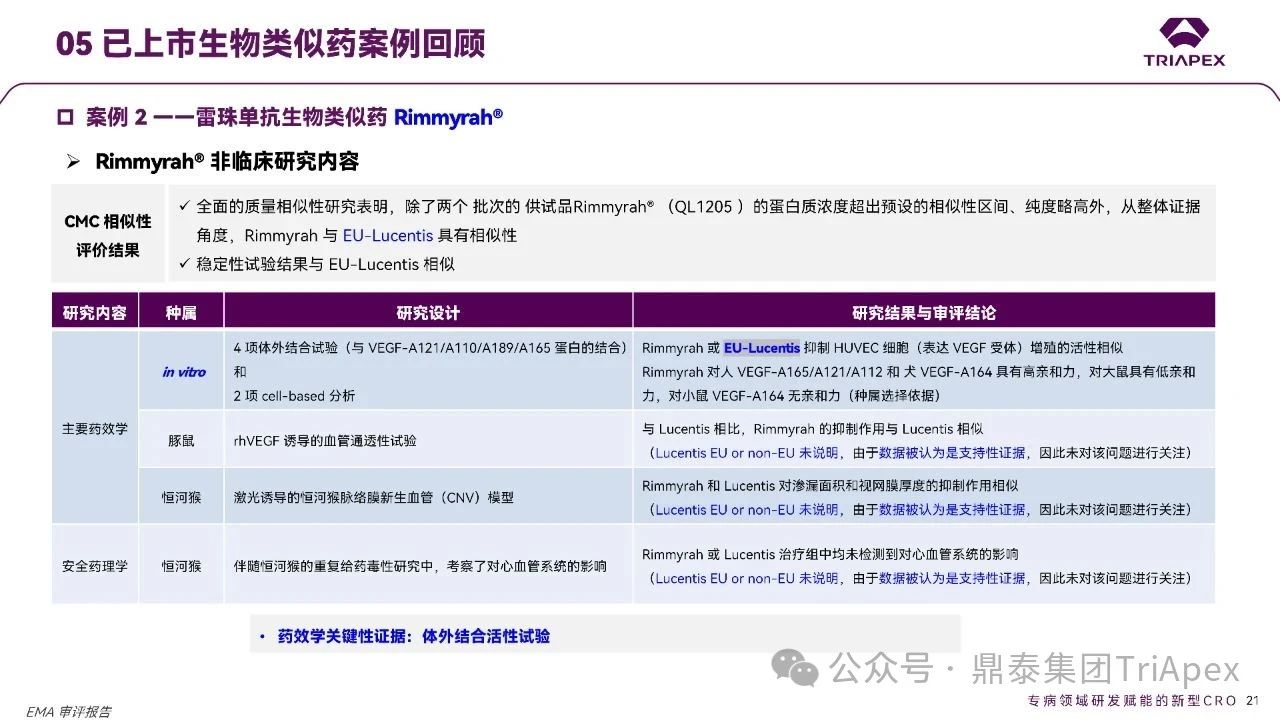
根据 EMA 审评报告,Rimmyrah® 的非临床研究如下:
CMC 研究
全面的质量相似性研究表明,除了两个批次的供试品的蛋白质浓度超出预设的相似性区间、纯度略高外,从整体证据角度,与 EU-Lucentis 具有相似性,且稳定性试验结果与 EU-Lucentis 相似。
药效学研究
采用 EU 批准的参照药开展了一系列体外试验;
在豚鼠和恒河猴上开展了体内研究(对于体内试验参照药的来源未进行说明,但是由于数据被认为是支持性的,未对这个问题进行关注);
安全药理学研究
药代动力学研究
毒理学研究
在恒河猴上开展 1 项预试验和 1 项正式试验;
正式试验供试品设置 2 个剂量组,参照药为中国批准;
审评结论:基于质量分析和体外活性试验的可比性,该研究被认为是不必要的,并且预计不会提供生物相似性结论方面的相关证据;
开展兔局部刺激性试验和体外溶血试验(EMA 不要求进行单独的局部耐受性试验)。

点击查看大图
EMA 的审评立场与科学考量:
鉴于 Rimmyrah® 和参照药之间良好的可比性,不鼓励进行非临床体内研究;但也认同进行的体内试验是为了满足全球其他地区的申报要求。对体内药效试验的态度是认为仅为支持性证据,对于毒理试验则认为是无关紧要的。

点击查看大图
Ø Byooviz®
关于 FDA 首个批准的雷珠单抗生物类似药 Byooviz®(三星,2021年获批)的非临床研究策略及 FDA 审评意见非常明确,即重视质量可比性研究,在认为质量可比性证据已建立的前提下,认为动物毒理试验不是必需的。

点击查看大图
Ø Cimerli®
Cimerli®(Coherus,2022 年获批),其非临床评价策略及监管考量则更加鲜明。

点击查看大图
本案例与前期获批产品共同完善了 FDA 对相关眼科生物类似药的审评框架,体现了基于风险的科学决策机制。
3
依库珠单抗生物类似药
截至 2025 年,FDA 已批准 2 个依库珠单抗生物类似药。作为补体抑制剂领域的代表性生物药,依库珠单抗的生物类似药开发面临独特挑战:由于缺乏相关种属,其非临床评价策略具有特殊考量。这一案例为解析以下关键问题提供了重要窗口:
1)无相关动物种属情况下的评价方法;
2)质量相似性研究的决定性作用;
3)监管机构对创新评价路径的开放态度。

点击查看大图
Ø Bkemv®
Bkemv®(研发代号:ABP 959)由安进公司开发,于 2024 年 5 月获得 FDA 批准上市。该产品的成功获批标志着补体抑制剂领域生物类似药开发的重大突破,其审评过程为缺乏相关动物种属的生物药类似性评价提供了重要参考案例。

点击查看大图
Bkemv® 的非临床评估策略体现了突破性科学理念:验证体外研究对特定靶点药物的充分性,为同类产品的开发建立了创新性参考标准。

点击查看大图
Ø Epysqli®
Epysqli®(代号:SB12)由三星开发,2023 年率先获得 EMA 批准,2024 年成功获得 FDA 上市许可。

点击查看大图
监管机构对 Epysqli® 的非临床评估达成科学共识:
FDA 基于全面的 CMC 相似性证据,在确认不存在特殊药代动力学特征或理化性质等问题的前提下,明确判定体内试验对毒性评估缺乏增值价值而予以豁免;
EMA 则通过系统化的体外药效学研究结合质量比对分析,在未发现潜在不确定性的科学基础上同样作出了免除体内研究的监管决策。
FDA 和 EMA 均确立了"质量属性+体外功能分析"的核心评估框架,这共同标志着生物类似药评价范式对特殊靶点产品的适应性发展。


点击查看大图
4
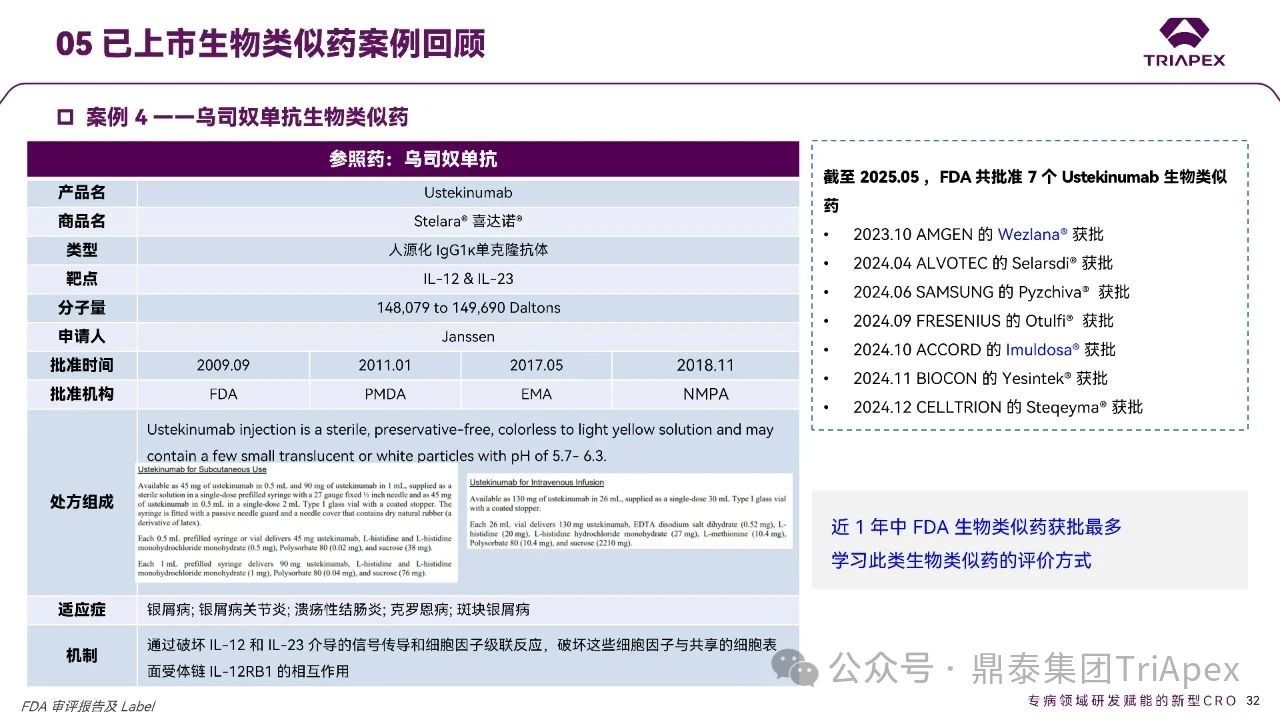
乌司奴单抗生物类似药
近年来乌司奴单抗生物类似药研发呈现爆发式增长,仅 2023-2024 年间 FDA 就累计批准了 7 个同类产品(食蟹猴为相关种属)。
为深入解析此类产品的技术评价要点,本文选取两个具有代表性的获批案例:2023 年获批的首个生物类似药 Wezlana® 与 2024 年 10 月获批的 Imuldosa® 进行对比分析。
点击查看大图
Ø Wezlana®
Wezlana®(代号:ABP 654)由安进开发,2023 年 10 月获得 FDA 批准,2024 年 6 月获得 EMA 上市许可。

点击查看大图
FDA 对 Wezlana® 的审评报告显示,申请人通过全面的 CMC 相似性研究建立了充分的质量可比性证据,严格遵循 FDA 生物类似药开发指南要求,科学论证了豁免动物试验的合理性。

点击查看大图
EMA 对 Wezlana® 的审评过程同样采用了基于科学风险的评估策略,申请人开展了丰富的体外试验,未开展体内试验。

点击查看大图
Ø Imuldosa®
Imuldosa®(代号:DMB-3115)由 Accord 开发,于 2024 年先后获得 FDA 与 EMA 批准。

点击查看大图
在 Imuldosa® 的全球监管审评中:
尽管申请人开展了食蟹猴单次给药 PK 研究和 4 周重复给药毒性试验,但 FDA 认为其生物相似性证明无需动物试验;
EMA 在评估相同研究时也表示,根据其生物类似药指南要求,4 周重复给药毒性研究为非必要内容。


点击查看大图
从上述案例,也可以看出 FDA 和 EMA 在基于科学比对原则下,对于非临床体内研究的开发态度。

点击查看大图
结语
生物类似药的开发遵循比对原则、逐步递进原则来确定与参照药在质量、安全性、有效性方面的一致性。在开发策略上,需重点考量以下关键要素:关于参照药的选择应兼顾科学合理性与国际化布局需求;深度的表征研究(包括相应的分析方法)至关重要,其决定后续非临床和临床比对研究的策略;对于处方的变化需谨慎评估,新辅料或工艺变更可能需要额外体内试验支持。此外,应正确看待毒理试验的价值和局限性。免疫原性评估策略是基于风险和综合证据。当前监管趋势显著简化,EMA/FDA 持续优化要求,包括非临床体内试验及临床 Ⅲ 期药效比对试验。
成功的生物类似药开发需要在科学严谨与申报效率间取得平衡,既要深入理解各监管机构的差异化要求,又要灵活运用策略性研究设计,方能在全球竞争中赢得先机。
供稿:转化科学和药政策略部
参考资料:
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容