
2025-08-21 09:00:00来源:浏览量:230
苏州2025年8月21日 /美通社/ -- 2025年7月,由博瑞医药联合AI药物设计平台予路乾行共同开发的候选药物BGM1812,正式发表于国际药物化学权威期刊《Journal of Medicinal Chemistry》。作为一款AMY3R与CTR的双重激动剂,BGM1812在动物模型中不仅展现出显著的体重控制效果,更在长期给药下保持了良好的瘦体重指标,体现出"减脂不减肌"的药效特征。[1]


JMC期刊发布
在持续扩张的减重药物市场中,如何在有效减少体脂的同时,避免瘦体重流失,已成为新一代代谢干预药物设计的关键目标。
面向真实的减重需求
随着肥胖相关疾病负担持续加重,全球范围内对安全、有效的体重控制药物提出了更高要求。根据世界卫生组织(WHO)数据,2022年,有25亿年龄在18岁及以上的成人超重,其中包括超过8.9亿成人患有肥胖症。
近年来,GLP-1类药物在减重领域的快速发展极大推动了市场扩容。国际投行巨头摩根士丹利(Morgan Stanley)在其报告中指出,全球减重药物市场预计将于2035年达到1500亿美元规模。
在GLP-1类药物带动全球减重药物市场快速增长的同时,其广泛使用中也逐渐暴露出一个不可忽视的风险:显著的瘦体重下降。
因此,目前市场已逐步形成行业共识:真正具有长期治疗价值的减重药物,不应仅仅关注"体重下降",而要实现脂肪减少与肌肉保留的动态平衡。
如何在实现有效体重管理的同时,保留肌肉质量、维持代谢稳定性,成为当前减重药物设计中的关键挑战。BGM1812,正是在这一问题导向下提出的解决方案。
实验结果显示多维药效优势
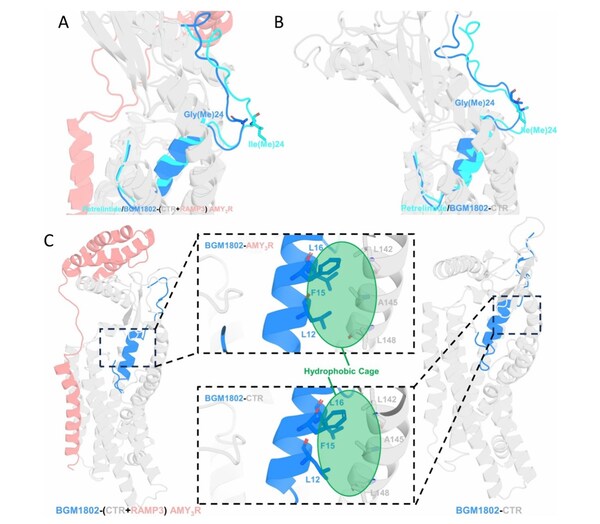
BGM1812是在AI辅助分子筛选与分子动力学模拟指导下设计的一种新型双靶点多肽分子。予路乾行研究团队首先以Petrelintide为基础,采用分子动力学方法,发现其Ile(Me)24突变为Gly(Me)24后可形成BGM1802,进而显著提升抗聚集倾向。模拟结果进一步揭示,BGM1802在AMY3R与CTR的结合位点中,其L12、F15、L16三联疏水残基与受体内疏水残基可共同构建"疏水笼"结构,增强受体配体复合物的稳定性,并促进受体激活。
基于这一疏水笼机制,研究团队借助分子动力学模拟与AI自由能打分方法,对L12和F15残基进行了α‑碳甲基化修饰,成功设计出新一代分子BGM1812和BGM1813,进一步强化与受体的疏水相互作用。
这一设计策略也在后续实验中得到了充分验证:
分子动力学模拟中的稳定构象
服务于多靶点设计的实际需求
在BGM1812项目中,予路乾行提供了从靶点建模、构象预测、能量评价到结构优化的全过程建模支持。该平台基于多尺度分子动力学模拟与AI算法融合的核心框架,能够在项目早期识别结合机制关键残基、提出优化建议,并辅助完成成药性评估与候选结构筛选。
BGM1812的成功发表,是博瑞医药与予路乾行基于机制共识和临床问题导向开展深度协同的又一成果。对于平台方而言,这不仅是一次结构优化能力的验证,更是AI药物设计在多靶点代谢干预方向上的落地案例。
.