本月CDE共受理32个仿制药质量和疗效
一致性评价申报的受理号
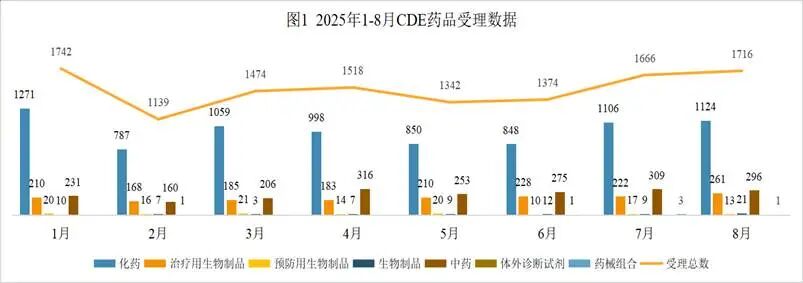
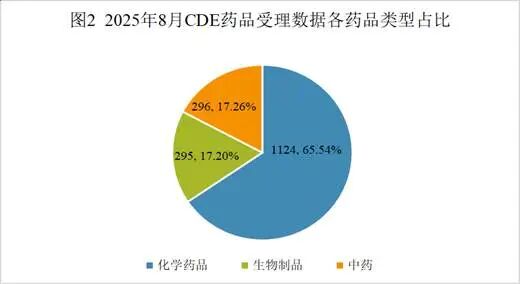
按药渡数据统计分析,2025年8月份药品审评中心(CDE)共承办1716个药品注册申请(按受理号计算),本月相比上月共增加了51个受理号,中药减少13个,生物药增加47个,化学药增加18个,药械组合减少2个。其中化学药品约占比65.54%,生物药约占比17.20%,中药约占比17.26%。
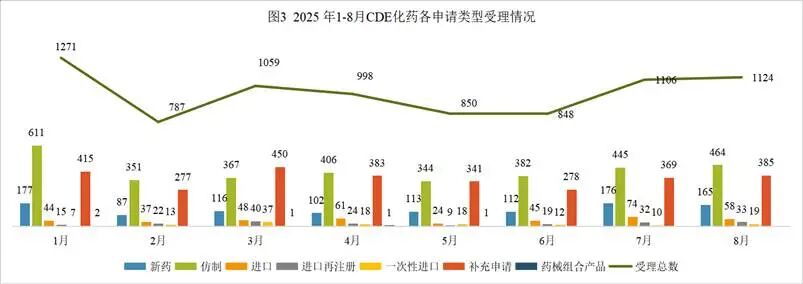
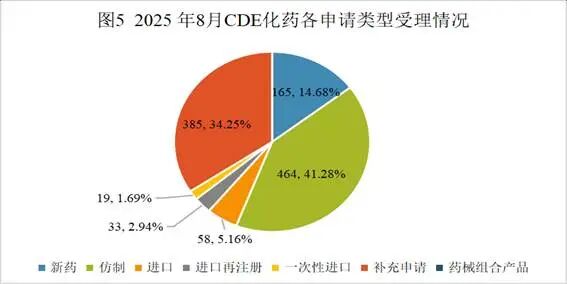
2025年8月份CDE共承办化药注册申请1124个(按受理号计算)。
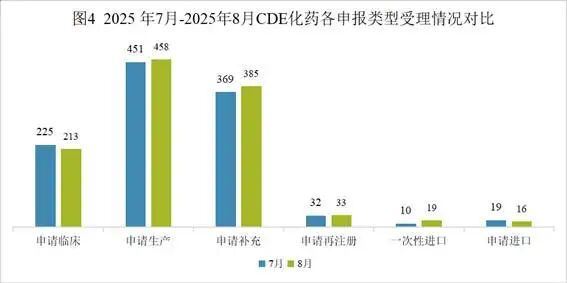
8月份化药申请生产458个,申请补充385个,申请再注册33个,一次性进口19个,相比上月申报数量均增多;申请进口16个,申请临床213个,相比上月申报数量减少。
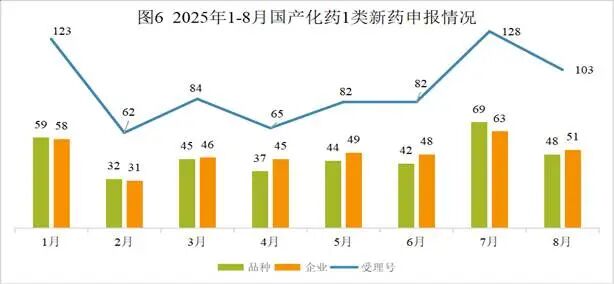
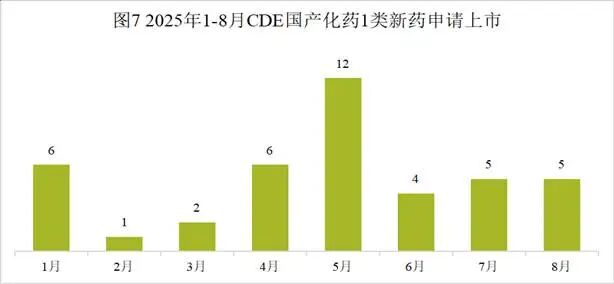
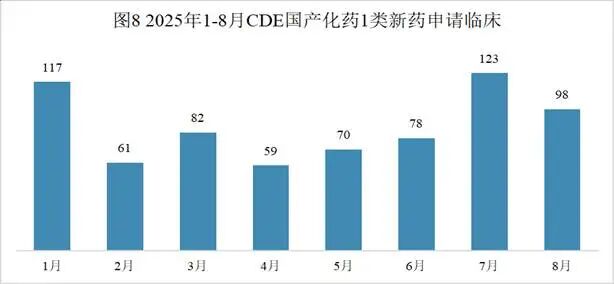
本月CDE受理国产化药注册1类新药共计103个受理号,涉及48个品种和51家企业,其中申请生产5个(4个品种),申请临床98个(44个品种)。
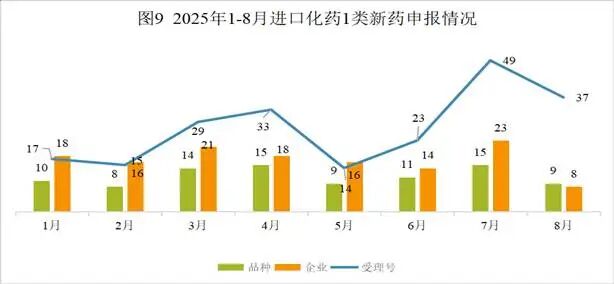
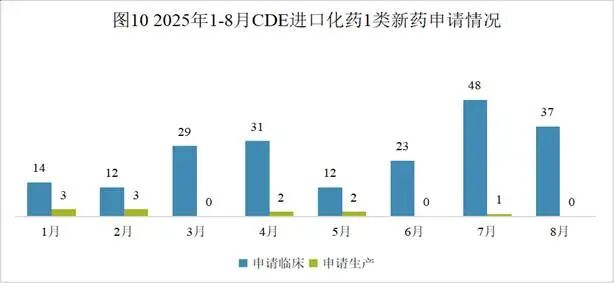
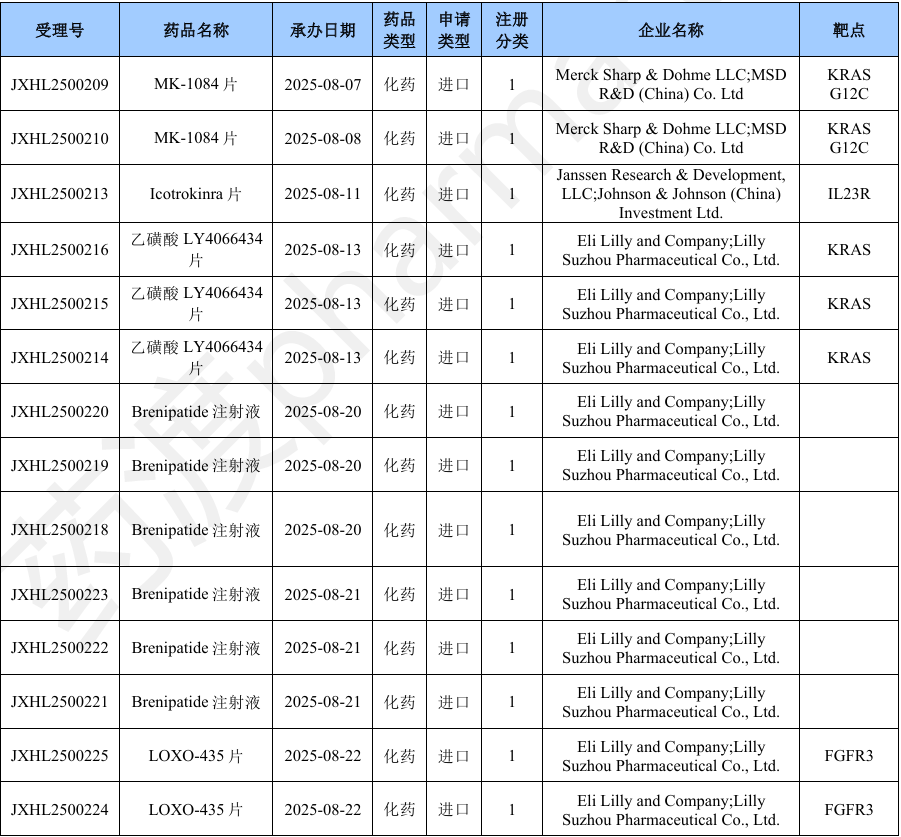
NH600001是由江苏恩华药业股份有限公司研发的一种小分子药物,是一种GABAAR激动剂。该药为中国化药一类。目前该药物最高研发阶段为申请上市,用于全身麻醉诱导和短时手术麻醉。2025年08月20日,由江苏恩华药业股份有限公司向中国国家药品监督管理局NMPA提交上市申请,用于全身麻醉诱导和短时手术麻醉。(CXHS2500099)2024年06月03日,由江苏恩华药业股份有限公司在中国大陆开展临床三期试验,用于治疗麻醉。(CTR20251685; CTR20241478)2023年03月23日,由江苏恩华药业股份有限公司在中国大陆开展临床二期试验,用于治疗麻醉。(CTR20230679)2022年01月08日,由江苏恩华药业股份有限公司在中国大陆开展临床一期试验,用于治疗麻醉。(CTR20242815; CTR20242814; CTR20242648; CTR20242273; CTR20223122; CTR20220012; CTR20242643)2021年10月12日,由江苏恩华药业股份有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗麻醉,为中国化药一类。(CXHL2101555)本月CDE受理进口化药注册1类新药共计37个受理号,涉及9个品种和8家企业,其中申请进口0个(0个品种),申请临床37个(9个品种)。
Enlicitide Decanoate(MK-0616)是由默沙东研发的一种小分子药物,是一种PCSK9抑制剂,可与PCSK9结合,并抑制PCSK9与低密度脂蛋白受体(LDL-R)的相互作用,从而降低LDL-C的水平,而LDL-C升高是导致心血管疾病的重要风险因素。目前该药物最高研发阶段为临床三期,用于治疗谷甾醇血症、高胆固醇血症、动脉硬化和II型高脂蛋白血症。2023年3月6日,默沙东在第72届美国心脏病学会(ACC)年度科学会议上公布了MK-0616的2b期临床试验数据。数据显示,治疗8周后,四个研究剂量中每一个剂量的MK-0616均使得LDL-C相对于基线水平显著降低,达到主要终点。MK-0616在第2周时就取得显著疗效,并且效果在8周的治疗期间持续存在,在接受最高研究剂量MK-0616的患者中,高达90% 的患者能够达到LDL-C目标。同时,第8周时,所有MK-0616剂量组的关键次要终点均出现改善。载脂蛋白B(ApoB,负责脂类转运的脂蛋白中的蛋白组成部分)和非高密度脂蛋白胆固醇(非HDL-C,包含所有致动脉粥样硬化脂蛋白)水平显著下降。MK-0616总体耐受性良好,未见与MK-0616相关的严重不良事件。2025年08月21日,由Merck Sharp & Dohme LLC开展临床三期试验,用于治疗谷甾醇血症。(NCT07058077)2024年11月22日,由Merck Sharp & Dohme LLC在美国开展临床一期试验,用于治疗肾功能不全。(NCT06643377)2024年09月20日,由Merck Sharp & Dohme LLC在美国开展临床一期试验,用于治疗肝功能衰退。(NCT06575959)2024年07月16日,由默沙东研发(中国)有限公司在澳大利亚、巴西和加拿大等国家和地区开展临床三期试验,用于治疗高胆固醇血症。(CTR20242333)2023年11月16日,由默沙东研发(中国)有限公司在中国台湾和中国大陆开展临床三期试验,用于治疗高胆固醇血症。(CTR20233296; CTR20242333)
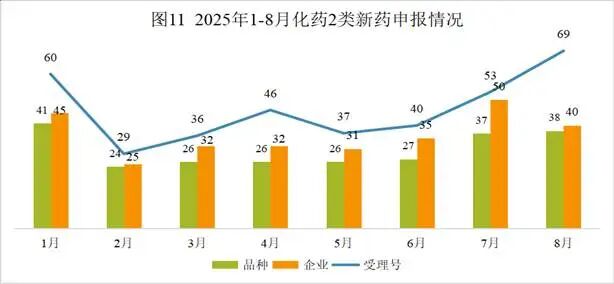
本月CDE受理化药注册2类改良型新药共计69个受理号,涉及38个品种和40家企业。
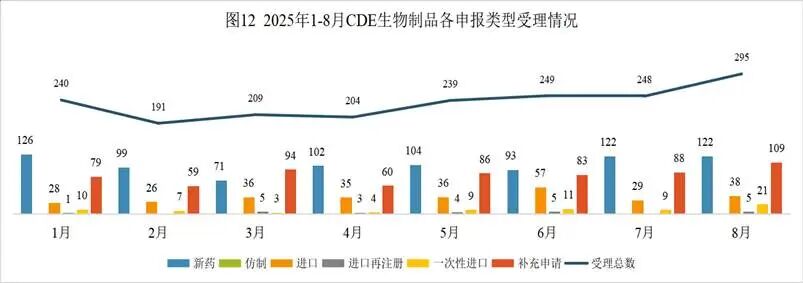
2025年8月份CDE共承办生物制品注册申请295个(按受理号计算)。
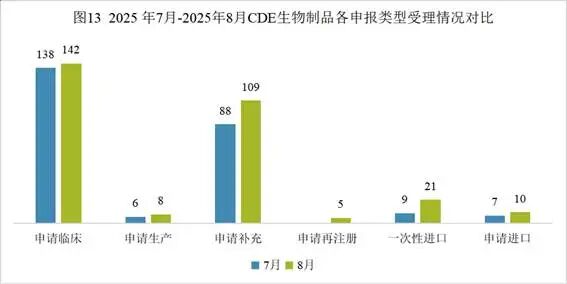
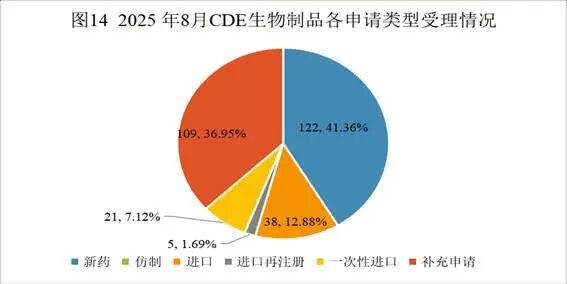
8月份生物药申请临床142个,申请生产8个,申请补充109个,申请再注册5个,一次性进口21个,申请进口10个,与上月申报数量相比均增多。
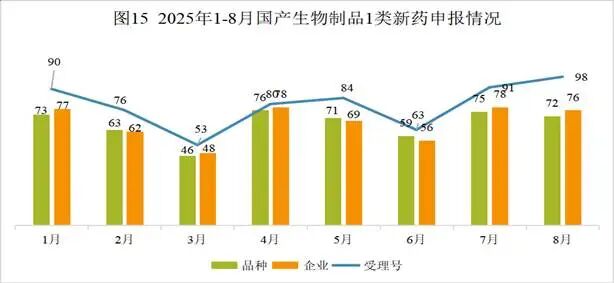
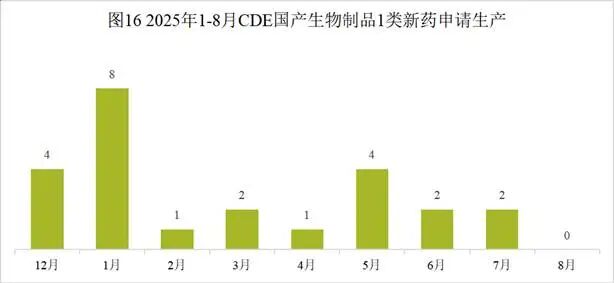
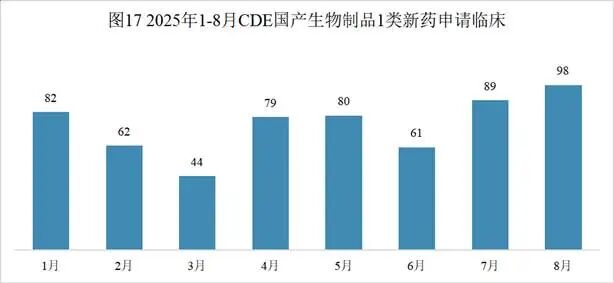
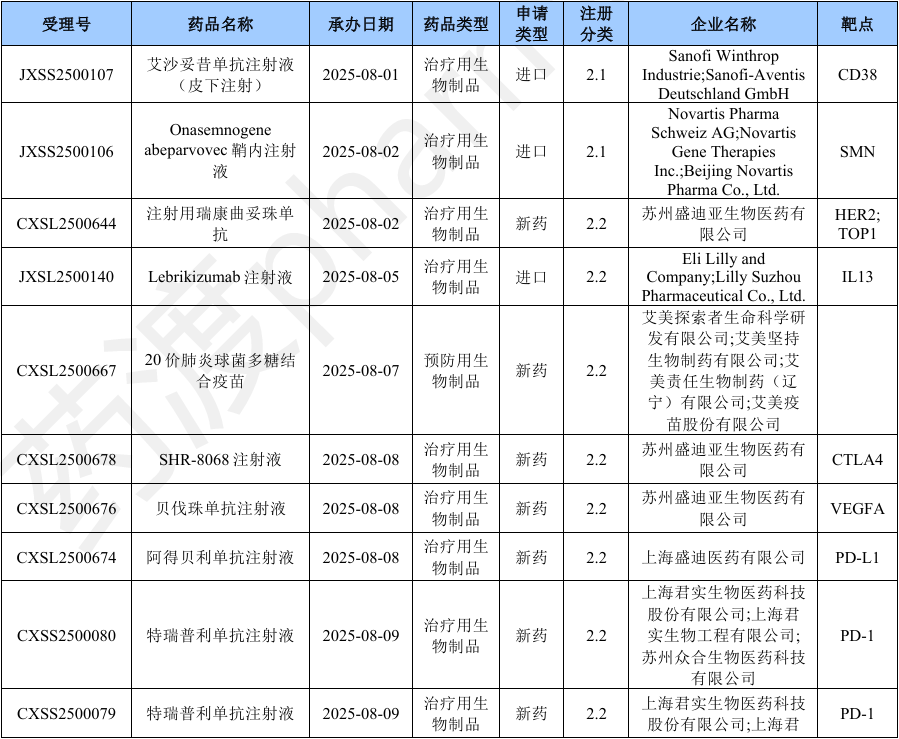
本月CDE受理国产生物制品注册1类新药共计98个受理号,涉及72个品种和76家企业,其中申请生产0个(0个品种),申请临床98个(72个品种)。
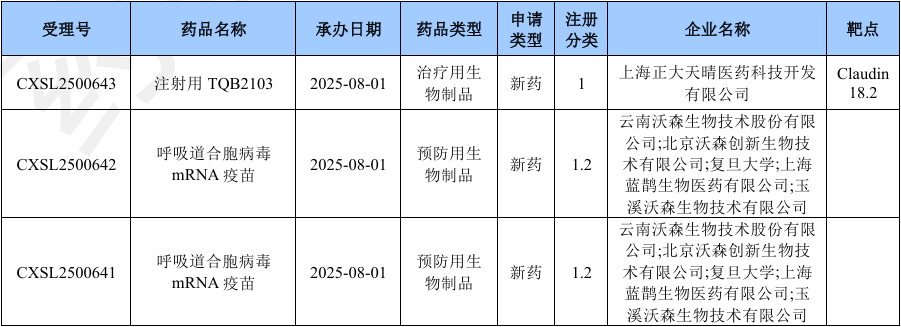
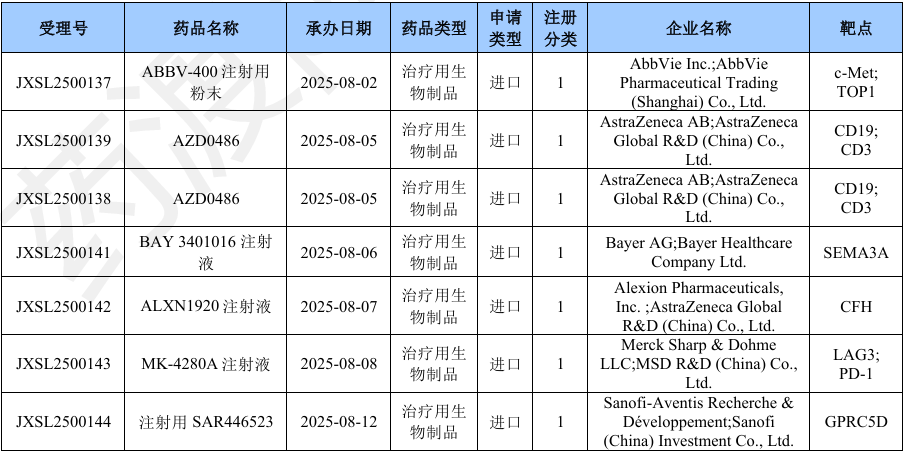
2025年8月国产生物制品1类新药申请临床(部分)
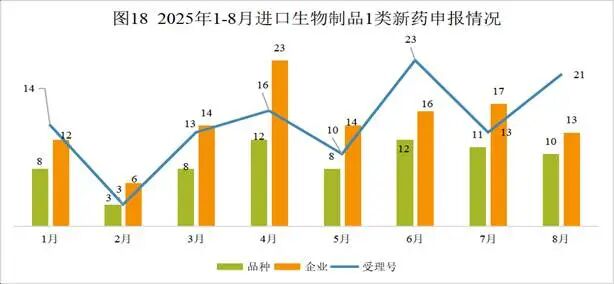
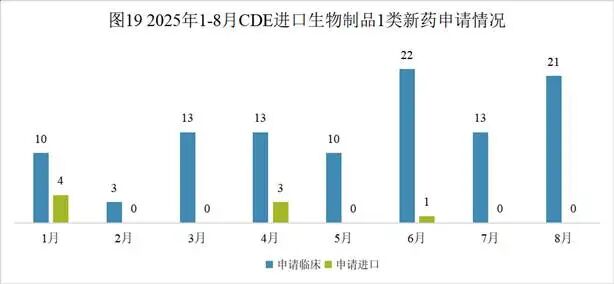
Pumitamig( PM-8002;BNT-327)一种双特异性抗体,是一种VEGFA抑制剂和PD-L1阻滞剂。该药为中国生物药一类。目前该药物最高研发阶段为临床三期,用于治疗小细胞肺癌、非小细胞肺癌和三阴性乳腺癌。2025年06月02日,Biontech和百时美施贵宝就BNT327达成合作。2023年11月06日,普米斯和Biontech就PM8002达成合作。2025年09月01日,由Biontech Se和普米斯生物技术(珠海)有限公司开展临床二期试验,用于治疗非小细胞肺癌。(NCT07111520)2025年08月20日,由百欧恩泰(上海)医药有限公司和珠海普米斯生物科技有限公司在澳大利亚和中国大陆开展临床二期试验,用于治疗实体瘤。(CTR20253266)2025年08月12日,由Biontech Se在英国开展临床二期试验,用于治疗实体瘤。(NCT07070232)2025年08月01日,由Biontech Se在中国大陆开展临床二期试验,用于治疗结直肠癌和实体瘤。(NCT07147348; NCT07133750)2025年07月23日,由映恩生物制药(苏州)有限公司在中国大陆开展临床二期试验,用于治疗肺癌。(CTR20252732)本月CDE受理进口生物制品注册1类新药共计21个受理号,涉及10个品种和13家企业,其中申请临床21个(10个品种)。
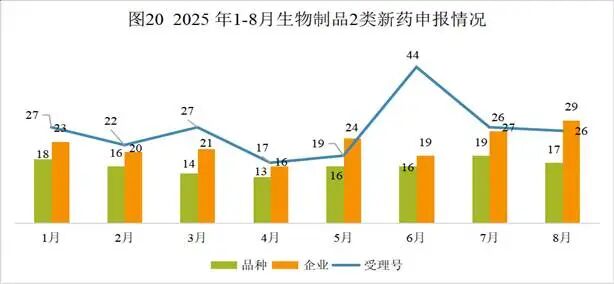
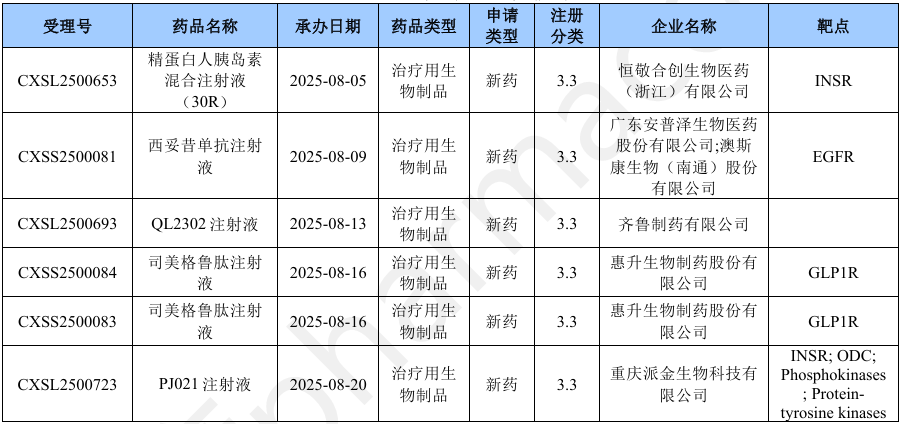
本月CDE受理生物制品注册2类改良型新药共计26个受理号,涉及17个品种和29家企业。
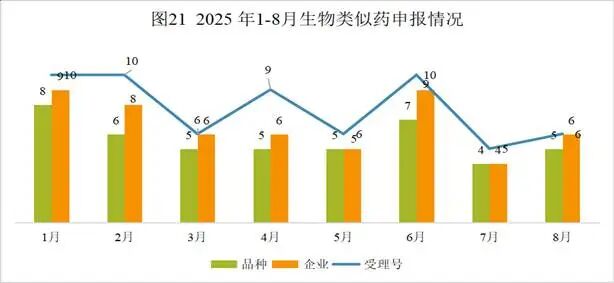
本月CDE受理生物类似药共计6个受理号,涉及5个品种和6家企业。
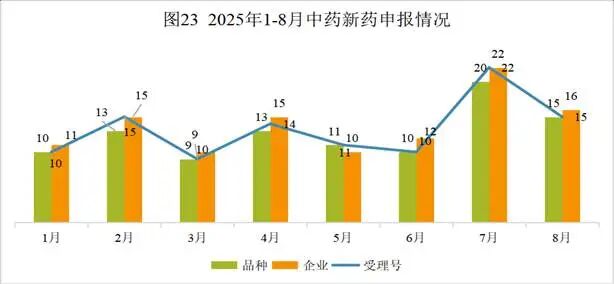
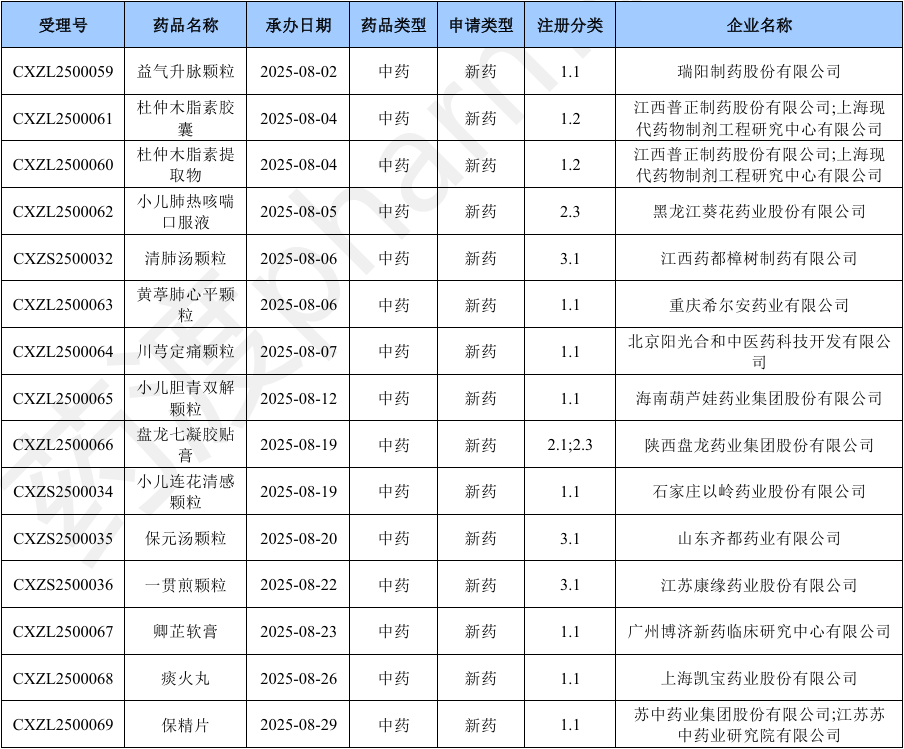
2025年8月份CDE共承办中药注册申请296个(按受理号计算)。本月CDE受理中药注册新药共计15个受理号,涉及15个品种和16家企业。
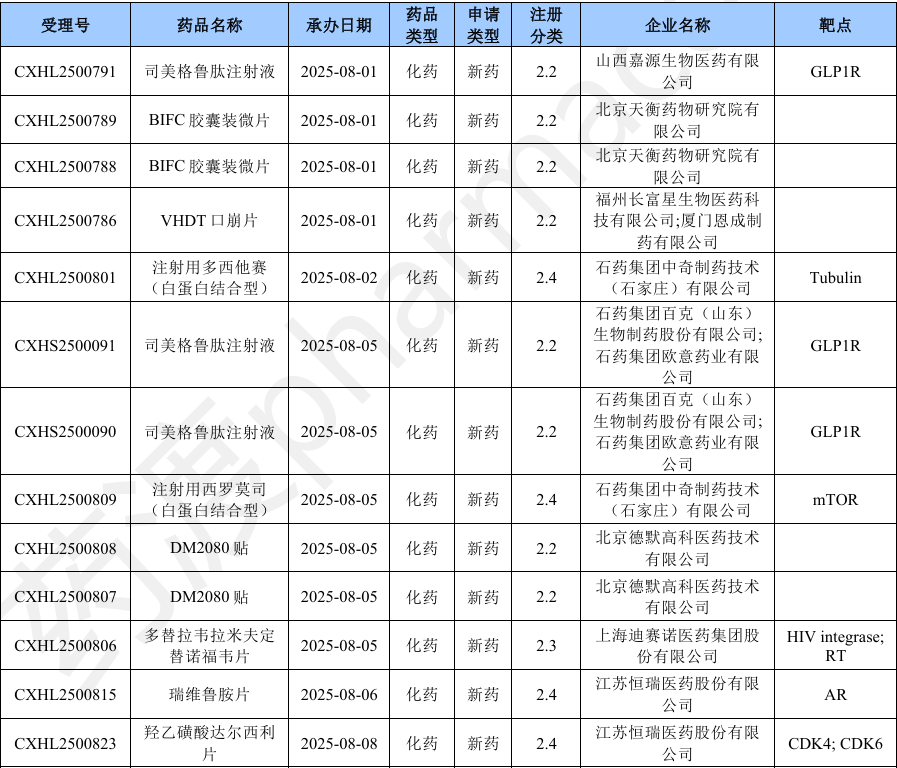
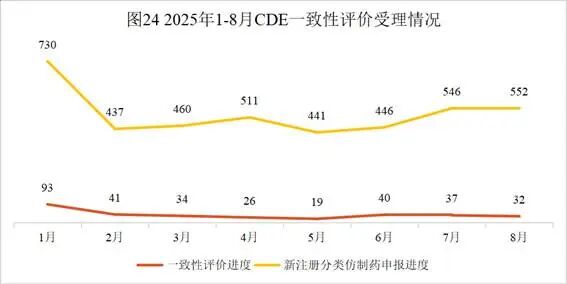
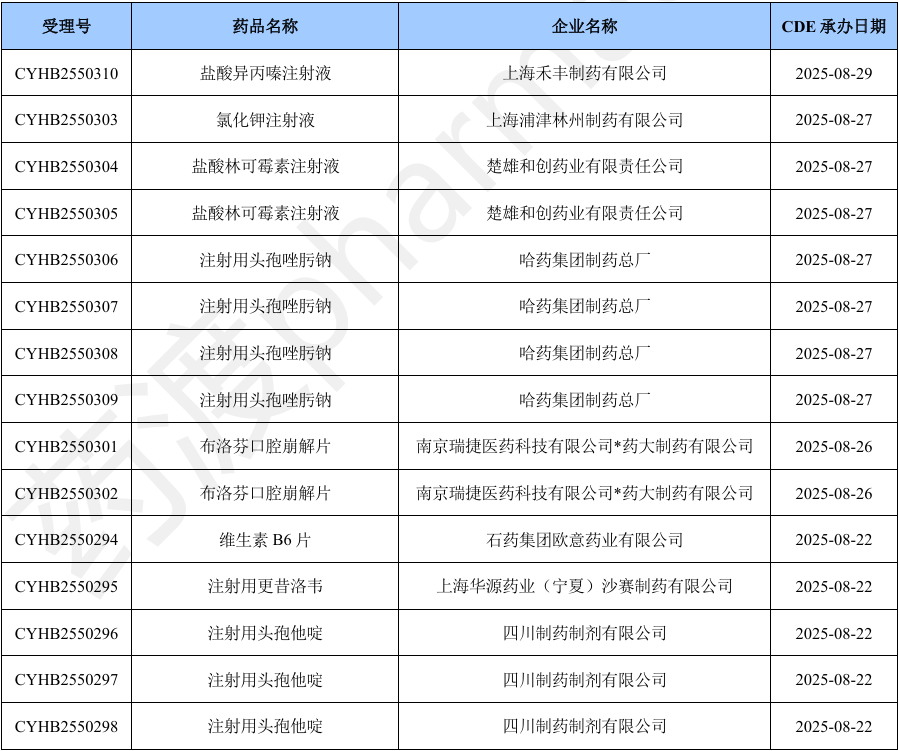
本月新增32个按一致性评价要求进行申报的受理号。
2025年8月CDE一致性评价受理情况(部分)
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容