
2025-09-29 10:44:39来源:学药笔记浏览量:3716
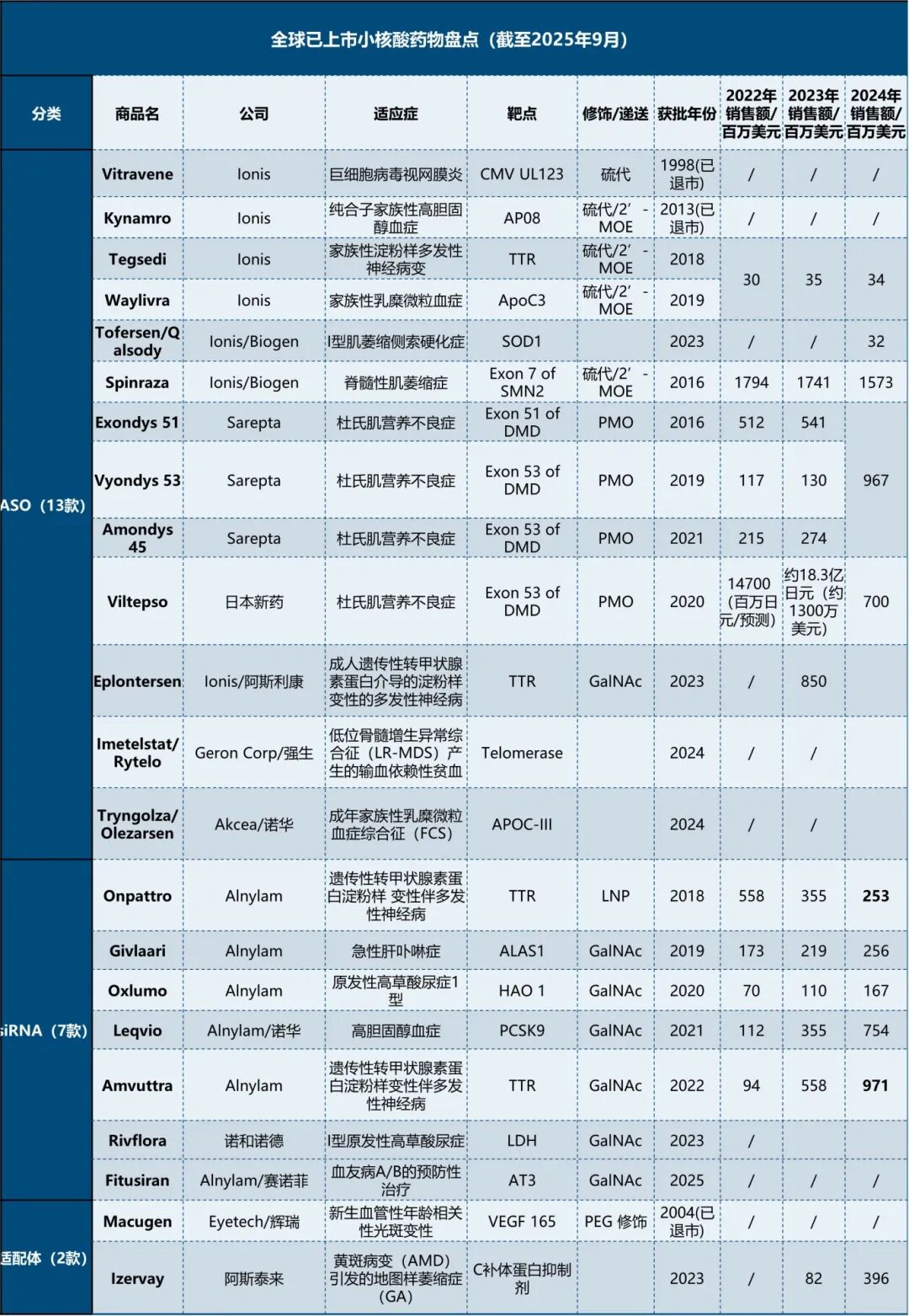
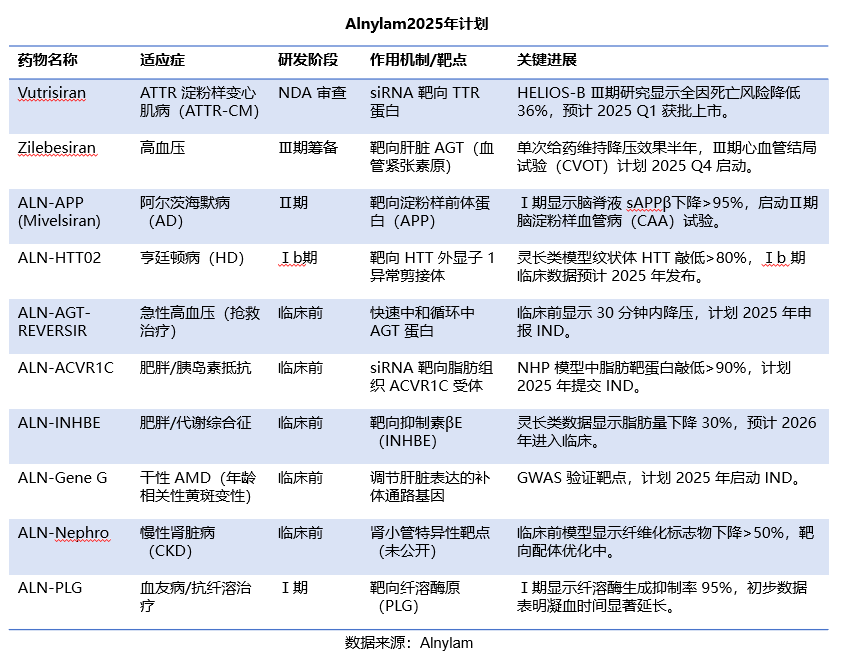
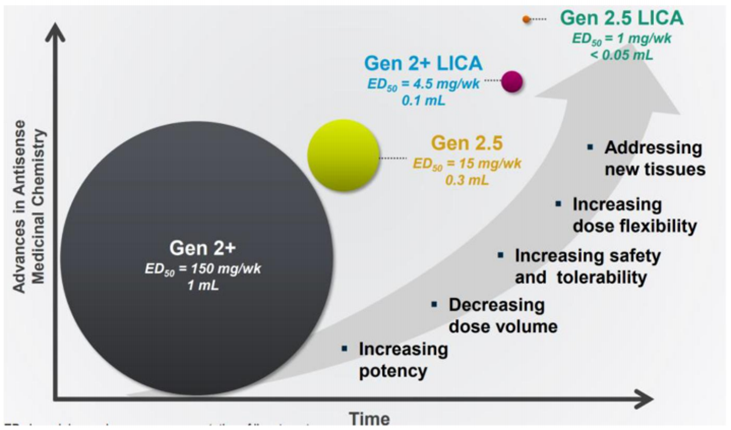
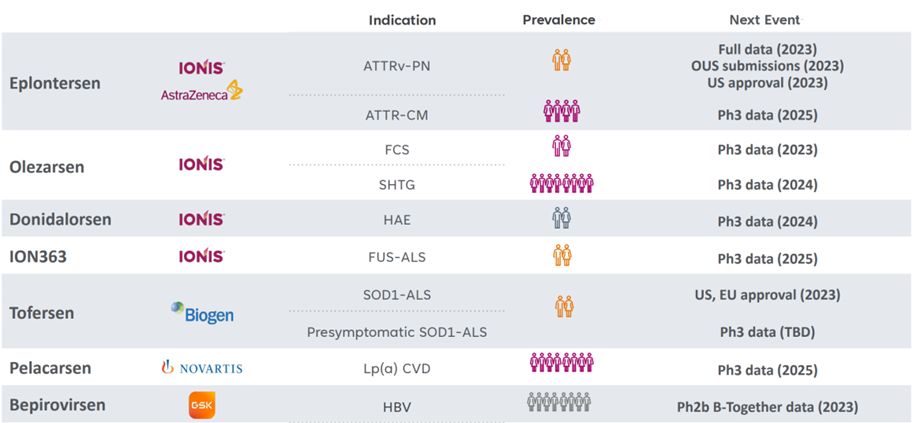
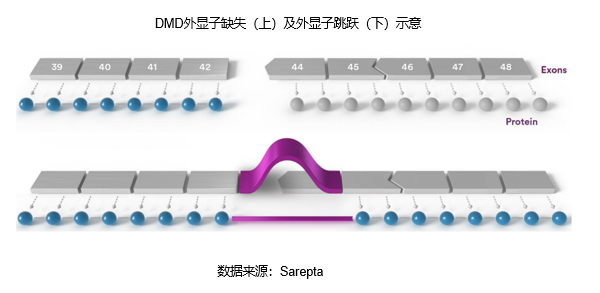
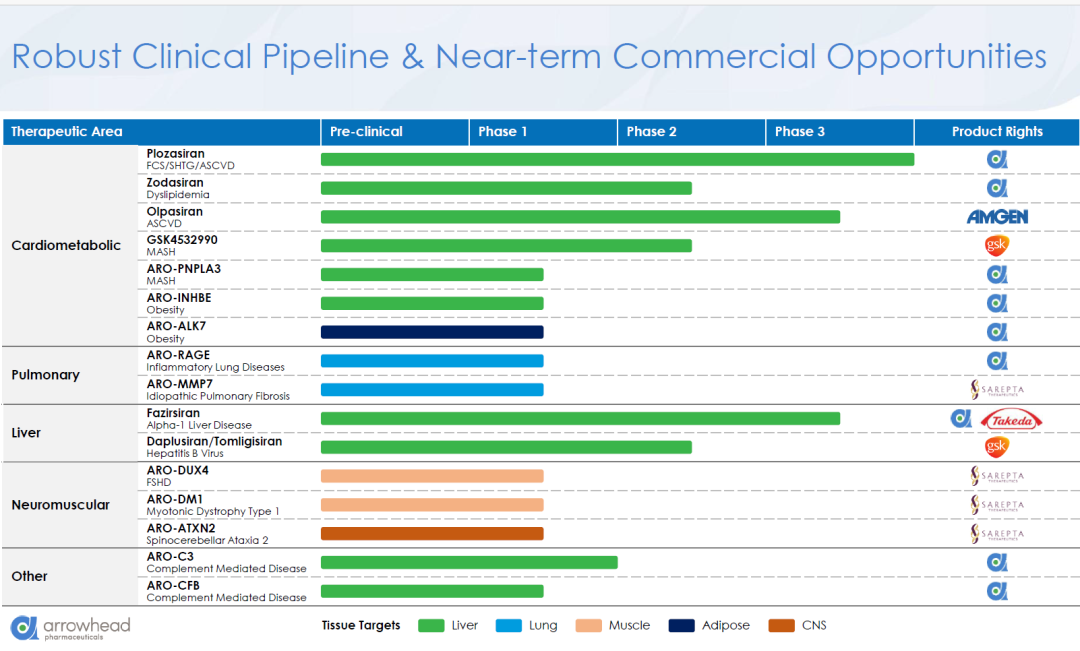
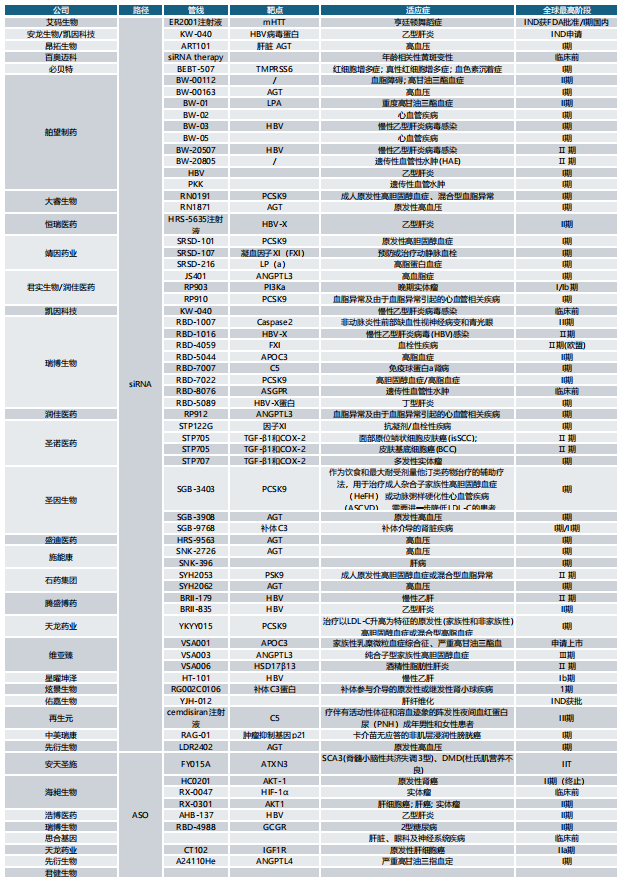
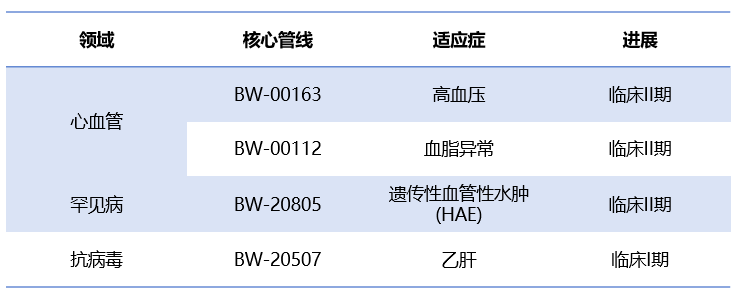
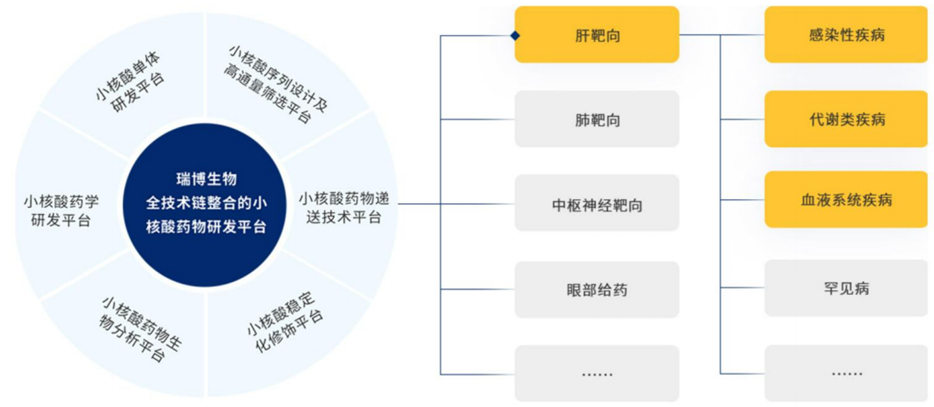
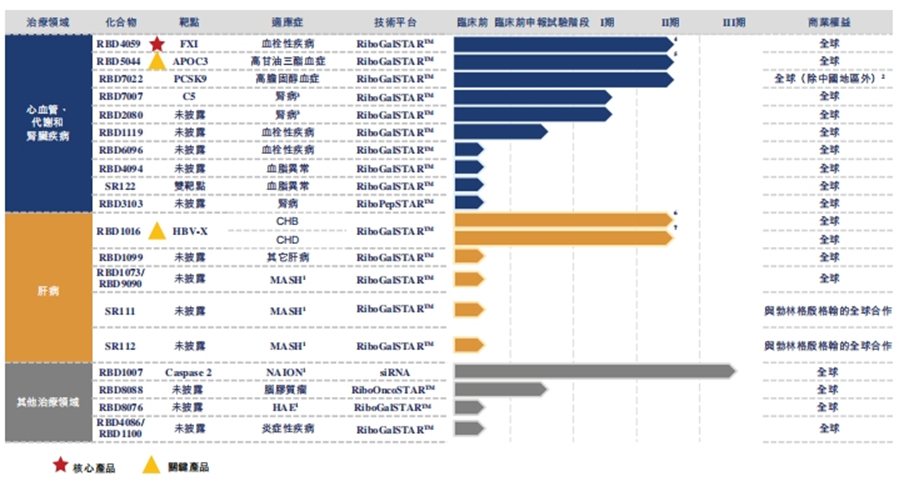
一、全球交易情况 小核酸药物在2023年经历一波火热的BD浪潮后,2025年被舶望制药与诺华的一笔总金额超过50亿美元的交易再度点燃,成为领域热烈讨论的话题。siRNA领域全球竞争越来越激烈,资本竞相追捧,小核酸药物逐渐显现出下一个大药的潜力。 从罕见病拓展至常见病,目前全球上市19款小核酸药物 截至目前,全球共有19款小核酸药物获批上市,另有3款已退市,19款中包含11款ASO药物,7款siRNA药物,1款适配体药物。其中渤健与Ionis开发Spinraza是最畅销药物,于2016年12月获得FDA批准作为首个用于治疗儿童和成人SMA的新药,全球年销售额超过15亿美元,自2016年上市至今累计销售额已超百亿美元。 在已获批的小核酸药物中,遗传罕见病是目前获批最多的适应症类别,主要由于这些罕见病致病靶点明确方便小核酸设计、缺少对应疗法可以加速进行临床以及罕见病对药物安全性耐受度较高等原因。 小核酸药物开发在从遗传病到常见慢性疾病扩展,siRNA介导的靶基因沉默其可编辑性强、药物半衰长、患者依从性高,适合慢性病病因复杂、病程长、服药依从性和持续性差、容易产生耐药性的特点,尤其是代谢类疾病肝靶向方面具有天然优势。Alnylam与诺华共同开发的Leqvio是首款用于降低低密度脂蛋白胆固醇(LDL-C)的siRNA药物,自获批以来销售额迅速增长,2025年上半年达5.55亿美元。 Spinraza(Nusiersen/诺西那生钠)是一种经修饰的反义寡核苷酸(antisense oligonucleotide,ASO),通过与SMN2外显子7的剪切位点结合,降低被截断的机会,增加全长SMN蛋白的产生,治疗5q脊髓性肌萎缩症,占SMA疾病的95%人群,是中国首个获批治疗SMA的药物。其治疗费用高昂,美国上市后定价212万美元,合计1350万人民币。国内每针定价70万,每4个月需要进行一次维持治疗,在2022年1月1日纳入国家医保正式执行后,Spinraza降至约3万元一针。目前多家国内企业如齐鲁制药、重庆药友制药等的诺西那生注射液仿制药已提交上市申请。 Spinraza通过局部给药(鞘内)的方法,药物直接注入脑脊液中,即刻就能达到较高的药物浓度,因此在给药时能够显著降低剂量,减轻毒副作用。为提高Spinraza患者依从性,2025年9月渤健以8500万美元预付款现金收购Alcyone Therapeutics,共同推进ThecaFlex DRx™的研发,为长期重复腰椎穿刺鞘内给药提供替代方案。目前,ThecaFlex DRx™系统正与Spinraza(诺西那生钠)联合用于脊髓性肌萎缩症(SMA)患者的临床评估。 Leqvio (inclisiran) 通过GalNAc递送系统进入肝细胞内,通过靶向破坏编码合成PCSK9蛋白的mRNA,从而阻断PCSK9的合成,提高肝细胞表面的LDL受体的数量,降低血液当中的LDL-C,起到降脂的作用,用于治疗高胆固醇血症及心血管患者。Leqvio为皮下注射,初始剂量为一剂,三个月后再注射一剂,然后每六个月注射一剂。 2021年美国获批上市,2023年8月在中国获批,美国定价超3000美元/针,中国定价9988元/针。2025年拓展适应症,取消必须与他汀联用的限制,正式获批作为单药治疗,四期研究覆盖了全球50个国家超6万名患者,Leqvio联合传统降脂治疗(LLT)治疗90天后,85%的患者实现LDL-C目标,而安慰剂联合LLT组仅31%(p<0.0001)。 三、国际龙头企业研发与布局 Alnylam成立于2002年,于2004年上市,是RNAi领域的龙头企业,近4年内有5款siRNA新药成功获批上市,Alnylam从罕见病适应症出发,覆盖领域逐渐向常见病领域发展,针对靶点也从肝部向其他组织推进,计划推出6个或更多的商业化产品,目前公司在研管线已经包括高血压、乙肝、NASH、II型糖尿病等慢性病。 其在2025年的发展计划包括几个方面:1. 递送技术:系统性突破肝外靶向瓶颈,从“肝脏优先”向“多组织覆盖”迈进;2.新靶点筛选:通过GWAS和功能基因组学的结合,精确锁定了多个高置信度靶点,逐步拓展至肥胖、神经退行性疾病等领域;2.制造革新:酶促连接技术降低成本,通过利用DNA连接酶实现RNA片段的酶促拼接,取代传统的固相合成(SPB)方法。 Ionis成立于1989年,专注于ASO药物的研发,目前有5款产品上市(2款已退市),目前总市值49亿美元。 公司的领先能力一方面体现在对核苷酸的化学修饰带来的ASO药物稳定性的提升,目前的第2.5代化学修饰药品相比第2代化学修饰药物效力高达10倍。另一方面体现在公司拥有的核心技术平台——配体共轭反义技术(Ligand Conjugated Antisense, LICA),通过配体与细胞表面受体特异性偶联,可以将药物高效递送至目标细胞。其2.5代化学修饰技术与LICA平台的结合共同打造了公司目前丰富的在研产品组合。同时公司也在积极开发LICA结合技术,以推进ASO药物在靶向肝以外组织的能力,2022年第四季度,公司成功推进了第一个基于LICA结合技术靶向肌肉组织的药物进入临床前研究。 Ionis基于自身的技术平台和阿斯利康、GSK、诺华等诸多大药企达成一系列合作,共同推进覆盖包括心血管、神经、呼吸系统、肿瘤、抗感染等在内的诸多领域的临床管线。管线处于临床后期有7款产品,分别是:用于治疗ATTRv-PN的Eplontersen(2022年12月提交NDA)、用于治疗家族性乳糜微粒血症综合征/甘油三酯偏高的Olezarsen、用于治疗遗传性血管水肿的Donidalorsen、用于治疗肌萎缩性侧索硬化症的ION636以及Tofersen(2022年7月提交NDA,PUDFA日期2023年4月25日)、用于降低脂蛋白(a)的Pelacarsen以及用于乙型病毒性肝炎的Bepirovirsen。 Sarepta成立于1980年,专注于罕见病的RNA疗法和基因治疗,目前有三款针对杜氏肌营养不良症(DMD)的药物上市,分别适用于确认肌营养不良蛋白基因突变的外显子45、51、53跳跃。目前总市值128亿美元。 Sarepta的第一代PMO技术平台,使用吗啉代替RNA中的核糖,在保持PMO与特定RNA序列正常结合的同时,也保持了高度抗降解性。DMD是一种罕见的X连锁隐性遗传病,特征是进行性肌肉退化和无力,是最常见的肌营养不良症类型。DMD是由抗肌萎缩蛋白缺乏引起的,而蛋白缺失则来自于一个或多个外显子缺失导致编译无法进行。目前上市的三款产品都基于公司的二氨基磷酸酯吗啉代寡聚物(PMOs)与外显子跳跃技术,让pre-mRNA在翻译时跳过发生突变的外显子,从而产生能够缓解DMD症状的抗肌萎缩蛋白。 Sarepta的第二代PPMO修饰技术正在快速推进,在PMO上通过共价键连接了细胞穿透肽,从而增强细胞内的递送能力。基于此开发的SRP-5051在临床前研究中,发现与PMO相比,抗肌萎缩蛋白的产量增加,反应时间更持久。此外,PPMO产品在非人灵长类动物的骨骼、心脏和平滑肌组织中带来了高水平的外显子跳跃,表明PPMO可能可以以更低的给药频率地送到肌肉以外的其他器官。 Arrowhead成立于1989年,专注于利用RNAi机制来开发治疗顽固性疾病的药物。Arrowhead通过使用广泛的RNA化学修饰与高效的递送方式触发RNAi机制,从而快速、深入、持久地实现靶基因的下调,抑制靶蛋白的产生。 Arrowhead经过十余年开发,建立了TRiMTM平台 (Targeted RNAi Molecule),利用配体介导的递送方式,形成结构简单的具有组织靶向特异性的药物系统。 TRiMTM平台可以为每个候选药物优化包括高亲和力靶向配体、多样化的连接子和化学物质、增强药代动力学的结构以及具有可以稳定特异性序列的化合物的高亲和力RNAi trigger。TRiMTM平台的优势包括制造流程简单、成本低以及支持多种给药途径,同时也在利用TRiMTM平台探索肝脏、肺、肿瘤、肌肉等器官或组织的递送。 国内部分小核酸管线如下,截至2025年9月,公开资料整理。 舶望制药 舶望制药(Argo Biopharma)成立于2021年4月,是一家专注于小干扰RNA(siRNA)药物开发的临床阶段生物科技公司 。在成立不足三年的时间内已建立起多元化的产品管线,适应症覆盖心血管疾病、罕见病、中枢神经系统疾病、病毒感染及代谢疾病等领域。 BD交易: 2024年1月与MNC诺华达成重大合作,将数款处于临床早期阶段的siRNA候选药物许可给诺华,交易首付款达1.85亿美元,总潜在金额高达41.65亿美元 。这一里程碑式的合作使舶望制药成为国内RNAi领域首个拿下大额国际授权交易的创业公司。 2025年9月,舶望制药宣布与诺华深化战略合作,加速心血管疾病新药研发。此次合作涉及多款siRNA药物,包括2款早研阶段分子的中国外权益的选择权,用于治疗sHTG和混合型血脂异常,以及ANGPTL3 siRNA的优先谈判权,该产品处于二期临床阶段,另一款临床前的siRNA药物中国外权益,预计2026年启动一期临床。根据协议,诺华支付1.6亿美元预付款,潜在里程碑总金额52亿美元。同时,诺华已经初步意向参与舶望制药下轮融资。 管线布局: 公司拥有超20条管线涉及心血管疾病、罕见病、病毒感染及代谢疾病等多领域,重点布局心血管、抗病毒、罕见病治疗方向,也有差异化管线,针对代谢大市场药物正面与龙头公司对擂。 在心血管领域,BW-00163是重点项目,通过作用于血管紧张素原基因(AGT)从源头上减少血管紧张素的产生,从而达到长效降血压的作用 ,目前已推进到2期临床,对标Alnylam公司的同靶点降压siRNA(Zilebesiran),得到诺华下注。 罕见病领域, BW-20805是一款siRNA药物,目前该产品正在澳大利亚进行临床I期试验,该研究旨在评估BW-20805的安全性、耐受性,以及PK/PD;于2023年10月获得CDE临床默示许可,用于治疗遗传性血管性水肿(HAE)。 抗病毒方面,BW-20507是公司自主研发的一种靶向HBV的siRNA药物,瞄准了乙肝功能性治愈的市场,目前正在中国香港、澳大利亚和泰国进行I/II期临床,以评估在健康受试者及慢乙肝患者中的安全性、耐受性、药代特征及疗效。 瑞博生物成立于2007年,在小核酸药物化学修饰领域积累深厚,同时也基于GalNAc递送方法开发了独有的RIBO-GalSTAR®技术平台,在肝脏以外的递送系统研究取得了一定进展。 公司于2025年4月25日向港交所递交招股书,中金、花旗为保荐人。瑞博生物目前拥有6款自研管线处于临床试验阶段,涉及7种适应症,其中4款处于2期临床试验中,一款已进入III期临床试验。公司还有20个计划推进到临床开发阶段的临床前项目。 核心产品RBD4059(靶向FXI的siRNA)为全球首款、也是临床开发进展最快的用于治疗血栓性疾病的siRNA药物,通过选择性抑制FXI,RBD4059可在不显著增加出血风险(传统抗凝剂的常见局限性)的情况下降低血栓形成的风险,同时以低频率的给药产生持久的疗效,提高患者的依从性。 圣诺医药成立于2007年,2021年登陆港交所,成为“国内小核酸药物第一股”。圣诺医药开发了超过20条管线适用于广泛的适应症领域,尤其是在肿瘤领域进行了深入的探索,及纤维化疾病、心脏代谢、病毒性疾病和肝脏疾病均有布局,已有治疗实体肿瘤的siRNA药物管线进入临床3期阶段。圣诺医药正推进优先产品管线及在美国就主要临床候选药物STP705及STP707连同STP122G开展五项siRNA临床试验,这两种药物均通过双靶点(TGF-β1和COX-2)小干扰核酸和专有的PNP导入系统来增强肝细胞和肿瘤细胞靶向性。此外还有其非全资附属公司RNAimmune主导的mRNA疫苗项目RV-1730及RV-1770,已获得美国FDA的研究用新药申请批准。




声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容