
2021-07-14 14:51:42来源:药智网浏览量:985
导读:肺癌治疗进入精准时代!多款靶向药跑步进入市场
肺癌疾病概述
(1)肺癌定义
原发性支气管肺癌,简称肺癌,是起源于气管、支气管黏膜或腺体,是最常见的肺部原发性恶性肿瘤。早起肺癌分型以病理组织学为主,肺癌大致能够分为非小细胞肺癌〔nonsmallcelllungcancer,NSCLC〕和小细胞肺癌〔smallcelllungcancer,SCLC〕两大类,其中非小细胞肺癌约占80%~85%,其余为小细胞肺癌,非小细胞肺癌主要包括两个亚型,腺癌和鳞癌。肺癌无传染性,但具有一定的家族聚集性和遗传易感性;从基因分型来看,常见基因分型包括EGFR突变、ALK突变、ROS1突变、BRAF突变等。
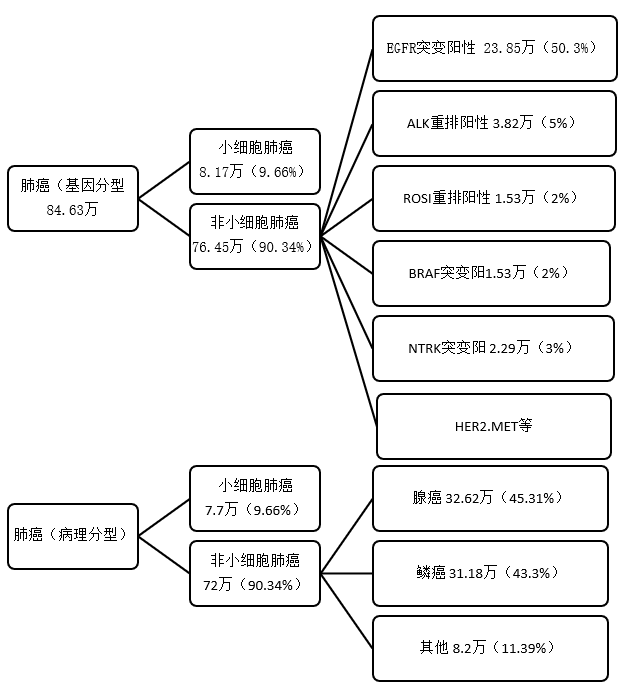
图1 肺癌病理组织学分型和驱动基因分型
中国与欧美在肺癌驱动基因图谱上存在明显差异。在中国,EGFR突变占比50.3%,KRAS突变与ALK突变分别占比6.7%、4.3%;而相比之下,欧美KRAS占比较大(25.0%)、EGFR突变占比较小(EGFR sensitizing与EGFR other合计29.0%)、ALK突变略高(7.0%)。EGFR突变率在亚洲肺癌患者中显著高于欧美人种,因此EGFR-TKI被称为上帝送给亚洲人的“礼物”。
(2)致病原因与临床症状
肺癌的病因至今未完全明确,致病因素主要包括吸烟、职业暴露、空气污染、电离辐射、饮食、遗传、肺部病史等。
肺癌的临床表现具有多样性但缺乏特异性,因此常导致肺癌诊断的延误。周围型肺癌通常不表现出任何症状,常是在健康查体或因其他疾病行胸部影像学检查时发现的。肺癌的临床表现能够归纳为:原发肿瘤本身局部生长引起的症状,原发肿瘤侵犯邻近器官、结构引起的症状,肿瘤远处转移引起的症状以及肺癌的肺外表现〔瘤旁综合征、副肿瘤综合征〕等。
(3)疾病分类与分期
根据临床疾病进展,对肺癌患者病情状况进行分期:小细胞肺癌划分为局限期和广泛期两个主要阶段;非小细胞肺癌分为ⅠⅡⅢⅣ期,其中Ⅰ期属于早期,指肿瘤位于肺组织中,尚未发生转移。Ⅱ期属于中期,指癌细胞已经转移到了肺门附近的淋巴结。Ⅲ期属于中晚期,指癌细胞已经进一步转移到纵隔或肺外淋巴结。Ⅳ期属于晚期,指肿瘤出现胸膜转移、胸腔积液或全身多处转移,如肝、脑、骨等。
疾病流行病学研究
大量流行病学研究证实,吸烟是肺癌的最大风险因素,烟草中有50多种物质会引起癌症,70%~80%的肺癌与吸烟(包括被动吸烟)相关,随着年龄的增长,患肺癌的概率就会增大,被诊断为肺癌患者有一半年龄在70岁以上,另外,有癌症病史者、与致癌剂(氡、砷、煤烟、二氧化硅等)长期接触者、其他肺部疾病患者(如COPD、肺纤维化)患肺癌的风险也会增大。
根据CA
Cancer J
Clin,2018年全球有大约1810万癌症新发病例和960万癌症死亡病,肺癌依旧是发病比例(11.6%)和死亡比例(18.4%)第一位的肿瘤,新发病例209.4万,死亡病例176.1万。分地区看,亚洲肺癌新发病例(48.4%)和死亡病例(57.3%)在全球的比重最高,其中中国占比最高。
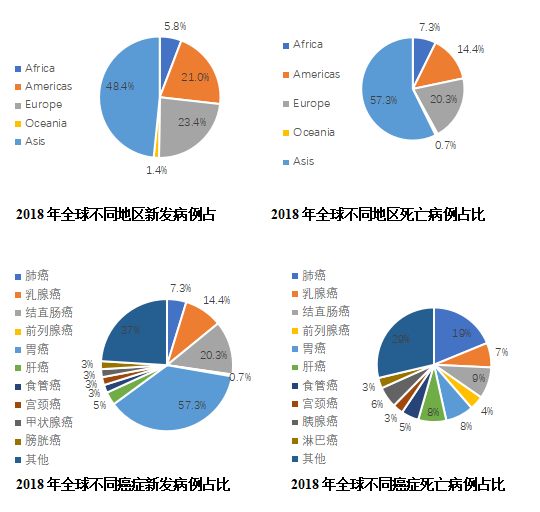
图2 2018年全球癌症流行病学饼图
根据国际癌症研究机构2018年分析报告,肺癌的发病率为22.48/10万(每年新增患者209.4万),死亡率为18.51/10万(每年新增死亡人数176.1万)发病率和死亡率均居首位。
根据美国癌症中心网站数据,美国肺癌发病率为60.5/10万,死亡率为41.9/10万,发病率排第二,死亡率均居首。
根据中国癌症统计数据,中国肺癌发病率为57.13/10万,死亡率为45.8/10万,二者均居所有癌症首位。
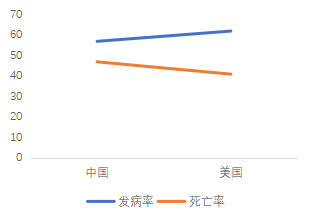
图3 中美肺癌发病率与死亡率对比(例/10万)
国内肺癌的5年生存率偏低。根据2018年发表在柳叶刀数据显示,2010-2014年,日本肺癌5年生存率最高达32.9%,美国肺癌5年生存率为21.2%,中国为19.8%(略高于胰腺癌、肝癌),尽管与德国、法国、英国等欧洲国家相比中国肺癌生存率略高,但与日本、美国相比偏低,对比其他癌种的生存率也存在显著差异。

图4 2000-2014年中、美、德、法、英肺癌五年生存率(%)
疾病治疗分析
3.1肺癌的诊断与治疗
(1)肺癌的筛查与诊断
高危人群的筛查,在高危人群中开展肺癌筛查有益于早期发现早期肺癌,提高治愈率。低剂量螺旋CT low dose computedtomography LDCT)对发现早期肺癌的敏感度是常规X线胸片的4~10倍,可以早期检出早期周围型肺癌。国际早期肺癌行动计划数据显示,LDCT年度筛查能发现 85% 的期周围型肺癌,术后10年预期生存率达92%。
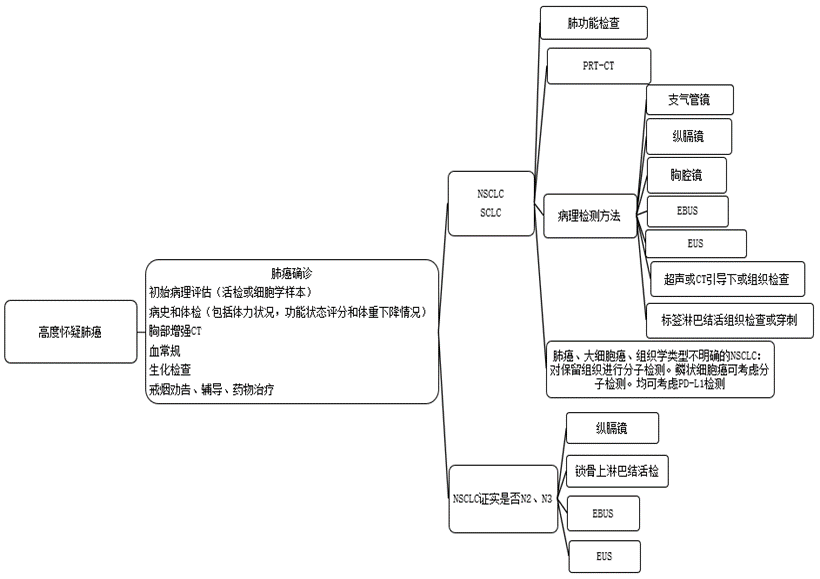
图5 肺癌活组织检查流程图
1)影像学检查
胸部X线:可了解肺癌的部位、大小对邻近部位的侵犯性、伴发的炎性病变等,是早期发现肺癌的一个重要手段。"S形倒影”(或称“反S征”)是诊断肺癌的典型征象。
计算机断层成像(CT):胸部CT可进一步验证病变所在的部位、范围,也可大致区分良恶性,是目前诊断肺癌的重要手段。
磁共振成像(MRI) 、B超、发射型计算机断层成像(ECT) 、正电子发射计算机断层显像(PET-CT) 等,特别适用于判断肺癌颅脑、淋巴结、骨等组织的转移。
内镜检查可直接观察病变情况,并获取病变部位的组织或细胞,便于进行病理诊断。
支气管镜是诊断肺癌的主要方法之一,可直接观察到支气管内的病变情况,主要适用于中央型肺癌,必要时可行超声引导下的纵隔淋巴结活检(EBUS) ,明确病理诊断。
纵隔镜是目前临床评价肺癌纵隔淋巴结状态的金标准,主要用于伴有纵隔淋巴结转移,不适合手术治疗,又不能通过其他方法进行病理诊断的病例。
胸腔镜在胸腔镜下对肺部微小病变、可疑淋巴结、胸膜、心包等组织进行病灶切除送检等,可对肺癌进行准确诊断和临床分期,适用于经支气管镜检查和经皮肺内病灶穿刺活检无法取得病理标本或合并胸膜病变的诊断。
2)病理学检查
细胞学检查:对内镜检查、细针穿剌、胸腔积液、痰液获得的细胞,进行细胞学检查,可以进行初步诊断。
组织学检查:对肺活体组织进行检查,是确诊肺癌的金标准。
基因检查:对肿瘤组织进行基因检查,如EGFR基因突变、ALK与ROS1基因融合检测等,有利于个体化的靶向治疗。
实验室检查:血常规、肝肾功能及其他必要的生化免疫检测、出凝血功能检测等,便于术前、术后对患者的整体状况进行评估。
肿瘤标志物如癌胚抗原(CEA) 、神经特异性烯醇酶(NSE)、细胞角蛋白19片段抗原(CYFRA21-1) 、胃泌素释放肽前体(ProGRP) 、鳞状细胞癌抗原(SCC-Ag) 等联合检查,对肺癌的诊断具有一定的参考价值。
(2)肺癌的治疗

图6 肺癌国内外治疗指南总览
肺癌的治疗应当采取多学科综合治疗〔multipledisciplinaryteam
,MDT〕与个体化治疗相结合的原那么,即依照患者的机体状况、肿瘤的病理组织学类型和分子分型、侵及范围和进展趋向采取多学科综合治疗的模式,有计划、合理地应用手术、放疗、化疗、分子靶向治疗和免疫治疗等手段,以期达到最大程度地延长患者的生存时间、提高生存率、操纵肿瘤进展和改善患者的生活质量。
1)外科治疗
解剖性肺切除术是早中期肺癌的要紧治疗手段,也是目前临床治愈肺癌的重要方法。肺癌手术分为完全性切除、不完全性切除和不确定性切除。应力争完全性切除,以期达到完整地切除肿瘤,减少肿瘤转移和复发,同时进行精准的病理TNM分期,力争分子病理分型,指导术后综合治疗。
2)放射治疗
肺癌放疗包括根治性放疗、姑息放疗、辅助放疗和预防性放疗等。
表1 肺癌放射治疗

3)药物治疗
肺癌的药物治疗包括化疗、分子靶向治疗以及免疫治疗。化疗分为新辅助化疗、辅助化疗、姑息化疗,应当严格掌握临床适应证,并在肿瘤内科医师的指导下施行。
肺癌的药物治疗包括化疗、分子靶向治疗以及免疫治疗。化疗分为新辅助化疗、辅助化疗、姑息化疗,应当严格掌握临床适应证,并在肿瘤内科医师的指导下施行。化疗应当充分考虑患者病期、体力状况、不良反应、生活质量及患者意愿,幸免治疗过度或治疗不足。应当及时评估化疗疗效,紧密监测及防治不良反应,并酌情调整药物和〔或〕剂量。分子靶向治疗需要明确基因突变状态,依据分子分型指导靶向治疗。近年,以免疫检查点抑制剂〔如PD-1
单抗或PD-L1单抗等〕为代表的免疫治疗取得了可喜的进展。基于免疫检查点抑制剂已被证实的生存获益,同时基于在中国人群中被证实的显著生存获益,国内首个PD-1
抑制剂纳武利尤单抗〔Nivolumab 〕等获批上市用于驱动基因阴性的晚期NSCLC患者。
晚期NSCLC的药物治疗
一线药物治疗:含铂两药方案是标准的一线化疗方案,在化疗基础上能够联合血管内皮抑素;关于晚期无驱动基因、非鳞NSCLC患者,还可在化疗基础上联合贝伐珠单抗;肺癌驱动基因阳性的患者,如EGFR基因突变〔包括19外显子缺失、21 外显子L858R和L861Q、18 外显子G719X、以及20 外显子S768I 〕阳性的患者, 可选择表皮生长因子受体酪氨酸激酶抑制剂〔EGFR-TKI〕治疗,包括吉非替尼、厄罗替尼、埃克替尼或阿法替尼治疗,一线给予吉非替尼治疗时还可考虑联合培美曲塞和卡铂。ALK或ROS1融合基因阳性的非小细胞肺癌患者,可选择克唑替尼治疗。目前可选用的治疗药物详见表2、表3。
表2 非小细胞肺癌常用的一线化疗方案
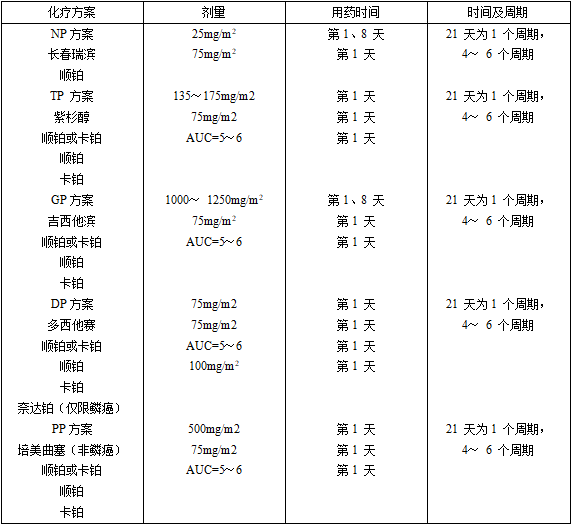
表3 非小细胞肺癌常用的抗血管新生药物和靶向治疗药物
对一线治疗达到疾病操纵〔完全缓解、部分缓解和稳定〕的患者,可选择维持治疗。目前同药维持治疗有循证医学证据支持的药物有培美曲塞〔非鳞癌〕、贝伐珠单抗〔非鳞癌〕和吉西他滨;有循证医学证据支持的换药维持治疗的药物有培美曲塞〔非鳞癌〕,关于EGFR基因敏感突变患者能够选择EGFR-TKI进行维持治疗。
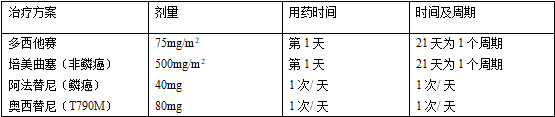
二线药物治疗:二线治疗可选择的药物包括多西紫杉醇、培美曲塞、Nivolumab
、EGFR-TKI
和克唑替尼。肺癌驱动基因突变阳性的患者,假如一线和维持治疗时没有应用相应的分子靶向药物,二线治疗时应优先应用分子靶向药物;一线EGFR-TKIs
治疗后耐药同时EGFRT790M突变阳性的患者,二线治疗时应优先使用奥希替尼。关于ALK阳性,一线同意克唑替尼治疗后出现耐药的患者,二线治疗时可序贯使用塞瑞替尼。关于一线同意EGFR-TKI
或者克唑替尼治疗出现耐药,
二线同意化疗治疗的患者,可依照患者的ECOGPS评分选择含铂双药或者单药治疗方案。关于驱动基因阴性的患者,应优先考虑化疗,关于无驱动基因且组织学类型为鳞状细胞癌的患者,可选择使用阿法替尼。
关于含铂两药联合化疗/ 靶向治疗失败后的NSCLC患者可选择PD-1 抑制剂Nivolumab 。
三线药物治疗:可选择参加临床试验,三线治疗也可选择VEGFR-TKI单药口服。目前VEGFR-TKI三线治疗有循证医学证据支持的药物有安罗替尼。
表4 非小细胞肺癌常见的二线治疗方案
不能手术切除的NSCLC的药物治疗,推举放疗、化疗联合,依照具体情况可选择同步或序贯放化疗。同步治疗推举化疗药物为依托泊苷联合顺铂〔EP〕或卡铂〔EC〕、培美曲塞联合顺铂或卡铂、紫杉醇或多西紫杉醇联合铂类。序贯治疗化疗药物为顺铂+依托泊苷,顺铂+紫杉醇,顺铂+多西他赛,顺铂或卡铂+培美曲塞〔非鳞非小细胞肺癌〕。多学科团队讨论评价诱导治疗后降期患者手术的可能性,如能做到完全性切除,可考虑手术治疗。
NSCLC的围手术期药物治疗
术后辅助化疗:完全切除的Ⅱ~Ⅲ期NSCLC,推举含铂双药方案术后辅助化疗4 个周期。辅助化疗始于患者术后体力状况差不多恢复正常,一般在术后4~6 周开始,最晚建议不超过手术后3 个月。
新辅助化疗:对可切除的Ⅲ期NSCLC可选择含铂双药,2~3
个周期的术前新辅助化疗。应及时评估疗效, 监测并处理不良反应,幸免增加手术并发症。手术一般在化疗结束后2~4
周进行。术后辅助化疗应当依照术前分期及新辅助化疗疗效,有效者连续原方案或依照患者的耐受性酌情调整,无效者那么应当调整治疗方案。建议围手术期化疗共进行4
个周期。
SCLC的药物治疗
一线治疗方案:T1~2N0 局限期小细胞肺癌推举肺叶切除术+肺门、纵隔淋巴结清扫术,术后辅助化疗。超过T1~2N0 局限期小细胞肺癌推举放、化疗为主的综合治疗。化疗方案推举依托泊苷联合顺铂〔EP〕或依托泊苷联合卡铂〔EC〕方案。广泛期小细胞肺癌推举化疗为主的综合治疗,有局部症状或伴脑转移者推举在化疗基础上联合放疗或其他治疗方法。化疗方案推举EP、EC、伊立替康联合顺铂〔IP 〕、伊立替康联合卡铂〔IC 〕或依托泊苷联合洛铂〔EL〕方案。〔2〕二线治疗方案:一线化疗后3 个月内复发或进展者推举拓扑替康、伊立替康、吉西他滨、替莫唑胺或紫杉等药物治疗;3~6 个月复发或进展者推举拓扑替康、伊立替康、吉西他滨、多西他赛、替莫唑胺或长春瑞滨等药物治疗;6个月后复发或进展者可选择初始治疗方案。鼓舞患者参加新药临床试验。
4)支气管镜介入治疗
随着支气管镜在临床应用的日益普及,对不能手术和放疗的患者,以下局部治疗手段可作为治疗选择,各种支气管镜介导的激光、高频电刀、射频消融、氩等离子体凝固术〔argonplasmacoagulation , APC〕、微波、激光、光动力治疗、冷冻、气道支架、球囊扩张、黏膜下或瘤体内药物注射等技术,实施支气管腔内介入治疗必须严格掌握适应证,明确治疗目的,客观评估拟采纳的某项治疗技术能否实现预期目标,并在有条件的医院开展治疗。
3.2靶向治疗
(1)EGFR:靶点及TKIs作用原理
EGFR是表皮生长因子受体(HER)家族成员之一,主要由胞外区、跨膜区以及胞内区酪氨酸酶三部分构成,其与胞外的表皮生长因子(EGF)结合时会形成二聚体结构从而激活下游的信号通路。
EGFR过度表达,会激活下游信号通路,使得细胞生长无法抑制,肿瘤细胞增殖、转移等特性得以增强,最终促使肿瘤的发生与进展受体与配体结合,与EGF、TGFα等配体结合,受体活化后形成二聚体,胞内区酪氨酸激酶相互磷酸化后,磷酸化的的酪氨酸部位与胞内的信号传导蛋白结合,形成信号传导蛋白复合物,同时信号传导蛋白被激活。持续活化的EGFR通路将向肿瘤细胞内传递生长、增殖和抗凋亡信号。下游信号通路包括Ras-MAPK(促进基因转录、细胞分裂和细胞周期进程)、PI3K/Akt(抗凋亡通路和新血管生成)、JAK/STAT(细胞增殖和延长细胞生存)、PLCγ/PKC(细胞分化、凋亡等)等。
EGFR-TKIs通过抑制胞内络氨酸激酶的磷酸化阻碍下游信号传递。小分子抑制剂通过与ATP竞争性结合目标,阻断络氨酸激酶与ATP结合,从而影响下游通路的激活,对肿瘤细胞产生抑制。
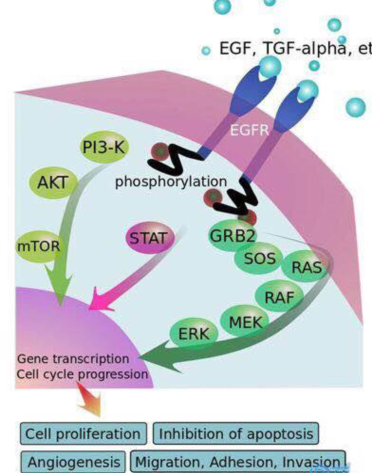
图7 EGFR信号通路
(2)EGFR:19del和L858R是常见突变位点
EGFR基因的常见突变位点发生在18、19、20和21号外显子上。根据核苷酸的变化,EGFR突变可以分为3类:以19外显子编码的E746到S752的缺失突变为代表;单个核苷酸的替换;插入或重复突变。
在所有的突变类型中,85%-90%为19外显子缺失突变(19del)以及21外显子L858点突变(L858R),这两种突变都会导致酪氨酸激酶域的激活(与对EGFR-TKI的敏感性有关),所以将这两种突变称为EGFR敏感突变。其余对EGFR-TKI也敏感的不常见突变有19外显子插入突变、20外显子插入突变A763_Y764insFQEA、L861Q、G719S和S768I。EGFR基因突变是预测NSCLC患者使用EGFR-TKIs疗效的重要靶标,针对EGFR基因突变已有多种靶向药物上市,不同的EGFR突变状态对应不同的靶向药物选择。
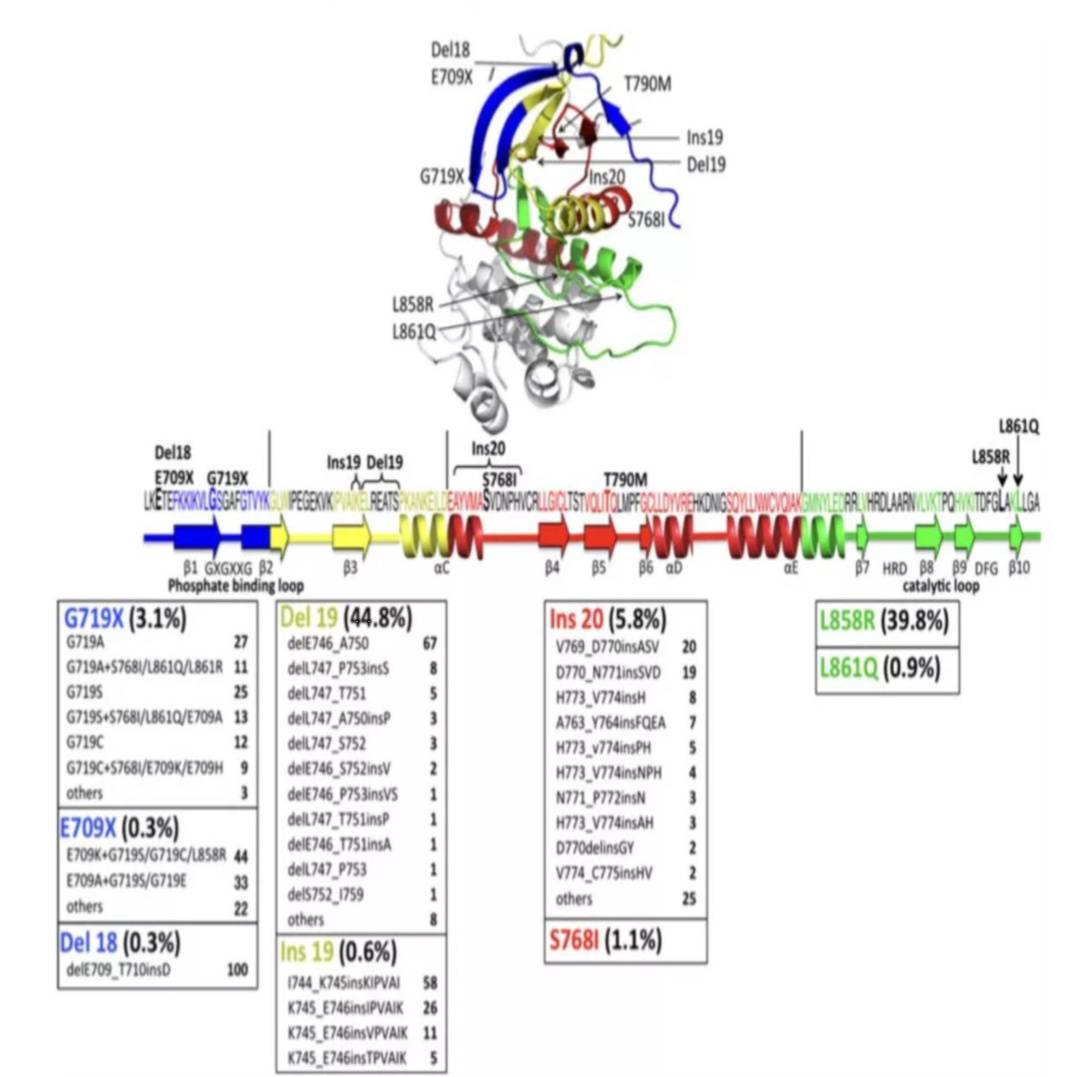
图8 EGFR基因常见突变位点
(3)EGFR敏感突变阳性治疗
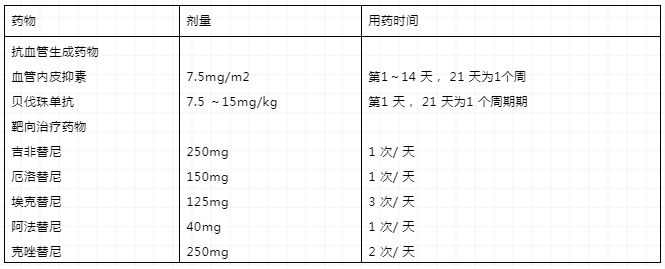
NCCN治疗指南要求患者在接受治疗前进行病理分型检测和分子检测,以确定具体NSCLC的病理类型(鳞癌or非鳞癌)与基因突变类型;2020V3指南把奥希替尼列为EGFR敏感突变一线用药首选,推荐厄洛替尼、阿法替尼、吉非替尼和达可替尼为其他一线用药,若治疗中发现T790M耐药突变(占比约60%),则需选择奥希替尼继续治疗,若小分子抑制剂治疗后依旧无效,则考虑采用免疫抑制剂(首选)或者其他化疗药物治疗。
表5 NCCN推荐EGFR突变阳性患者用药
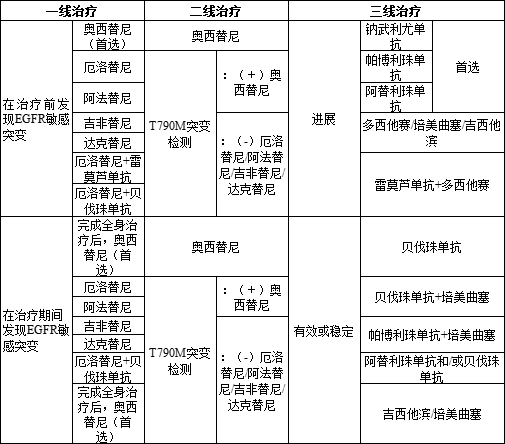
吉非替尼、厄洛替尼、埃克替尼是肺癌靶向药物第一代治疗药物,与靶点的结合并不牢固,结合一段时间就分开,因为也被称为可逆的靶向药物,阿法替尼、达克替尼为二代靶向药物,能与靶点不可逆的结合,永久锁住靶点。大多数在接受一代、二代EGFR-TKI药物治疗的患者,在治疗一年左右出现耐药,其原因为患者出现T790M突变,奥西替尼作为三代靶向药物,能作用于一代或者二代靶向药物发生耐药性的特定基因突变(T790M),具有高度的特定基因突变选择性。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!